超高压液相色谱法测定鱼油中的EPA-EE和DHP-EE
2013-07-12陈伟珠晋文慧洪专张怡评方华易瑞灶
陈伟珠,晋文慧,洪专,*,张怡评,方华,易瑞灶
(1.国家海洋局第三海洋研究所海洋生物资源化学与化工中心,福建 厦门 361005;2.厦门大学化学化工学院化学系,化学生物学福建省重点实验室,福建 厦门 361005)
二 十 碳 五 烯 酸(cis-5,8,11,14,17-eicosapentaenoic acid,EPA)和二十二碳六烯酸(cis-4,7,10,13,16,19-docosahexaenoic acid,DHA),属于ω-3 系高度不饱和脂肪酸,其中EPA 被誉为“血管清洁剂”,DHA被称为“脑黄金”。EPA 和DHA 是人体难以合成,需由食物供给的必需脂肪酸,是理想的功效食品或营养品。研究表明[1-2],EPA、DHA 与人体许多生命现象有关,对维护人体健康有重要作用,目前广泛应用于各种保健食品中。EPA、DHA 都为人体所必需的脂肪酸,主要来自于海洋鱼类,难以从一般食物中加以补充。当前市场上鱼油产品层出不穷,深受消费者欢迎,但是由于产地、加工工艺等原因,其有效成分EPA、DHA含量存在较大差异,因此迫切需要建立起测定EPA、DHA 含量的快速有效的方法。由于EPA 和DHA 不稳定,一般是做成酯类,通常采用乙酯化[3]。目前,关于二十碳五烯酸乙酯(EPA-EE)和二十二碳六烯酸乙酯(DHA-EE)的检测技术,文献报道的大多数都采用常规的高效液相色谱方法[4-5]、液质联用法[6]和气相色谱方法[7],运行一个样品需要10 min 以上。近年来,随着商品化亚2 μm 填料的逐步推广,构建超高压液相色谱系统(UPLC)及其分析方法已经成为分析化学领域研究的热点之一。UPLC 是指一种采用小粒径填料色谱柱(<2 μm)和超高压系统(>105kPa)的新型液相色谱技术,可显著改善色谱峰的分离度和检测灵敏度,同时大大缩短分析周期,特别适用于微量复杂混合物的分离和高通量研究,已有很多文献报道[8-13]。但目前国内外尚未见有关超高压液相色谱在鱼油中EPA-EE和DHA-EE 检测的相关报道。本文拟采用超高压液相系统建立起检测鱼油中EPA-EE 和DHA-EE 的快速、灵敏的方法。
1 材料与方法
1.1 仪器与设备
超高压液相色谱仪配TUV 检测器:ACQUITY,美国Waters公司;ACQUITYUPLCTMBEHC18(2.1 mm×50 mm,1.7 μm):美国Waters 公司;Milii-Q 超纯水纯化系统:美国Millipore 公司;百万分之一分析天平:德国梅特勒公司。
1.2 试剂与材料
DHA-EE、EPA-EE:美国Sigma-Aldrich 公司;粗鱼油:国内某产家提供;乙腈:色谱纯,美国天地有限公司;实验用水为Milli-Q 超纯水。
1.3 实验条件
1.3.1 标准溶液的配制
分别精密称定EPA-EE 对照品13.041 mg 和DHA-EE 对照品12.914 mg,置于25 mL 量瓶中,加甲醇稀释至刻度,摇匀,分别配制成EPA-EE 和DHAEE 储备液(当天使用),使用时用甲醇逐级稀释成系列标准溶液。
1.2 液相色谱条件
色谱柱:ACQUITY UPLCTMBEHC18(2.1mm×50 mm,1.7 μm);流动相:乙腈-水(80∶20,体积比);流速:0.5 mL/min;检测波长:220nm,进样量3μL,柱温:30℃。
2 结果与讨论
2.1 流动相的选择与优化
对于液相色谱而言,流动相的组成和配比对物质分离的影响显著。考察了以甲醇-水与乙腈-水分别为流动相时的分离效果。在乙腈-水流动相中,EPA-EE与DHA-EE 分离效果较好,继续再调整乙腈与水的比例,比较了乙腈的比例分别为75%、80%和85%时对分离效果的影响(如图1 所示)。
由图1 可见,当流速同为0.5 mL/min 时,乙腈-水(75∶25,体积比)、乙腈-水(80∶20,体积比)和乙腈-水(85∶15,体积比)这3 种流动相,EPA-EE 与DHA-EE的都能达到基线分离,达到分析要求,尤其以乙腈-水(75∶25,体积比)为流动相时效果最佳,分离度最大,但是综合考虑运行时间和分析,选择乙腈-水(80∶20,体积比)作为流动相。
2.2 流速的选择与优化
在确定乙腈-水(80∶20,体积比)为流动相后,本文进一步考察流速分别为0.3、0.4、0.5 和0.6 mL/min的分离情况。结果表明,在这几种流速下,EPA-EE 和DHA-EE 都能完全达到基线分离,随着流速增加,柱压增高,保留时间缩短,如图2 所示。综合考虑分离度、保留时间和峰形及鱼油中杂质等因素,流动相的流速定为0.5 mL/min,此时保留时间合理,峰形美观对称。
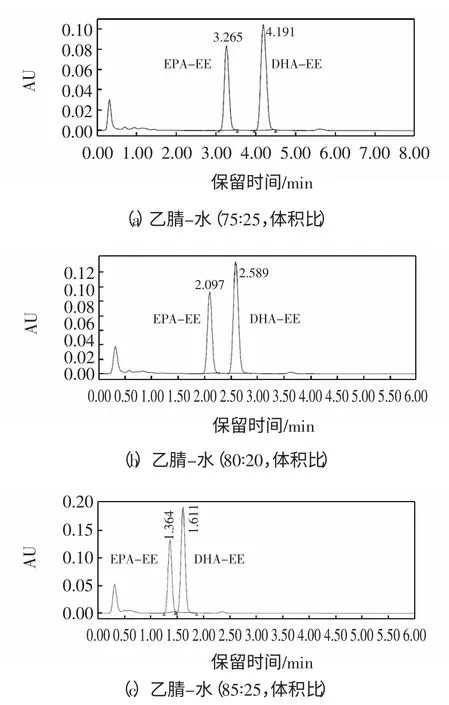
图1 相同流速,相同柱温,不同流动相下EPA-EE 与DHA-EE 的色谱图谱Fig.1 Chromatograms of EPA-EE and DHA-EE in different mobile phases with the same flow rate and the same column temperature
2.3 检测波长及柱温的确定
检测波长根据文献报道[4],选择220 nm 为检测波长。柱温考察了30、35、40 ℃。实验结果表明,在相同流动相和流速的条件下,鱼油中的EPA-EE 和DHA-EE 的保留时间随着柱温的升高而提前(如图3 所示)。本文考虑到EPA-EE 和DHA-EE 分离效果和实际样品中杂质的问题,选择柱温为30 ℃。综合上述的流动相、流速试验的结果,确定色谱条件为流动相为乙腈-水(80∶20,体积比),流速0.5 mL/min,柱温30 ℃,检测波长220 nm。
2.4 标准曲线、检测限及定量限
分别精密量取EPA-EE储备液100、200、400、800、1 000、1 500、2 000 μL 置于7 个5 mL 量瓶中,加甲醇稀释至刻度,摇匀,配制7 个不同浓度的标准溶液。DHA-EE 系列标准溶液,与EPA-EE 标准溶液配制方法相同,配制7 个不同浓度的标准液进样。每个样品进样3 μL,按上述色谱条件测定,测定结果如表1所示。

图2 相同流动相,相同柱温,不同流速下EPA-EE 与DHA-EE 的色谱图Fig.2 Chromatograms of EPA-EE and DHA-EE in the same mobile phases and the same column temperature with different flow rate
采用峰面积对其浓度作标准曲线,EPA-EE 线性回归方程为y=49 273.19x+0.60(y 为峰面积,x 为样品浓度),相关系数r=0.999 4。DHA-EE 线性回归方程为y=14 288x-466.1(y 为峰面积,x 为样品浓度),相关系数r=0.999 7。在各自的浓度范围内,EPA-EE和DHA-EE 的线性关系良好,而且线性范围较宽。逐级稀释溶液测定检出限、定量限,当信噪比(S/N)为3 时,EPA-EE 和DHA-EE 的检出限分别为4 ng 和6 ng。当信噪比(S/N)为10 时,EPA-EE 和DHA-EE 的定量限分别为10 ng 和15 ng。
2.5 精密度试验

图3 相同流动相,相同流速,不同柱温下EPA-EE 与DHA-EE 的色谱图Fig.3 Chromatograms of EPA-EE and DHA-EE in the same mobile phases and the same flow rate with different column temperature

表1 EPA-EE 和DHA-EE 线性测定结果Table 1 Calibration curve for EPA-EE and DHA-EE
分别取EPA-EE 和DHA-EE 配制的标准溶液,浓度分别为104 μg/mL 和103 μg/mL,精密吸取3 μL 进样,分别连续进样6 次,考察仪器的精密度,EPA-EE和DHA-EE 的峰面积RSD 分别为1.09%和0.34%,表明本方法的精密度良好。
2.6 重复性试验
分别取EPA-EE 和DHA-EE 储备液,配制浓度分别为104 μg/mL 和103 μg/mL 的供试品溶液,每种样品同一浓度分别配制6 份,精密吸取3 μL 进样进行测定,分别计算EPA-EE 和DHA-EE 的重复性,结果EPA-EE 和DHA-EE 的重复性RSD 分别为1.54%和1.29%,表明本方法重复性良好。
2.7 回收率试验
分别取EPA-EE 和DHA-EE 对照品适量,精密称定,分别用甲醇溶解并稀释制成每1 毫升约含EPAEE 和DHA-EE 80、100、120 μg 的溶液各3 份,作为供试品溶液进行测定,计算回收率。EPA-EE 平均回收率为102.26%,RSD 为1.33%,DHA-EE 平均回收率为96.64%,RSD 为1.05%,结果见表2。

表2 EPA-EE 和DHA-EE 回收率考察测定结果Table 2 The result of recovery for EPA-EE
表2 结果表明,本方法回收率良好。
2.8 鱼油中EPA-EE 与DHA-EE 的检测
利用本试验所建方法对两种鱼油样品中EPAEE、DHA-EE 含量进行检测,并与参照国标GB/T 17377-2008《动植物油脂脂肪酸甲酯的气相色谱分析》[20]规定的色谱条件测定的数据进行比较,结果见表3。
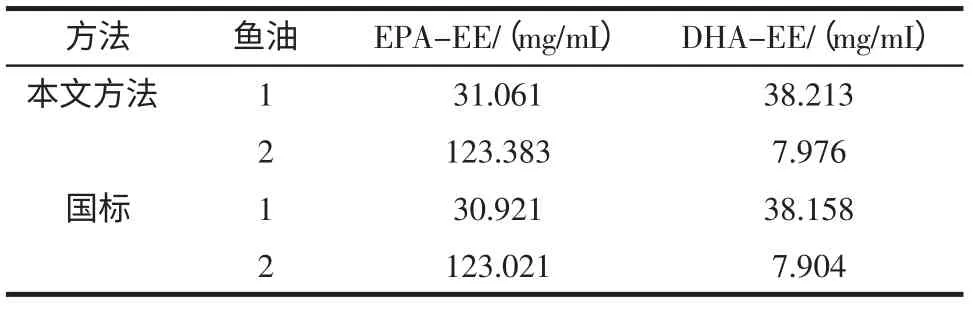
表3 测定的鱼油样品的EPA-EE、DHA-EE 含量Table 3 The content of EPA-EE and DHA-EE in Sample by two methods
由表3 的结果可看到,用本文所建立的超高压液相方法测定国内某产家提供的两种粗鱼油的结果,与国家规定的的气相色谱法测定的结果基本一致,但分析时间更短,操作更简单。
3 结论
本试验采用超高压液相色谱法快速测定鱼油中的EPA-EE、DHA-EE 含量,流动相简单,分析时间短,一次进样只要6 分钟,操作简便,定量准确,重现性好,此外,由于UPLC 使用填料颗粒小的短柱,柱容量较常规HPLC 小,因而检测限也比常HPLC 低许多,可作为鱼油中EPA-EE 和DHA-EE 的快速、灵敏的定量检测方法。
[1]卢定强,陈钧.二十碳五烯酸和二十二碳六烯酸的代谢和生理机理[J].江苏理工大学学报,1998,19(3):29-36
[2]杨彩霞,计成,戎易.鱼油及n-3 不饱和脂肪酸的营养功能的研究进展[J].中国农业大学学报,1997,2(1):65-70
[3]彭宏伟,张博,杨小川,等.HPLC 法测定鱼鱼油中二十碳五烯酸、二十二碳六烯酸的含量[J].中国药房,2010,21(13):1228-1230
[4]ALKIO M,JANTTI M,AALTONEN O.Purification of polyunsaturated fatty acid esters from tuna oil with supercritical fluid chromatography[J].Journal of the american oil chemists society,2000,77(3):315-321
[5]肖小年,侯小晶,易醒,等.HPLC 法测定微乳中DHA 的含量[J].食品科技,2011,36(2):290-292
[6]全文琴,陈小娥,陈洁,等.高效液相色谱/质谱联用直接测定鱼油中EPA/DHA 含量[J].食品与机械,2008,24(2):114-117
[7]刘爱琴,罗超杰,孙晓霞,等.气相色谱法测定鱼油微胶囊中EPA 和DHA 的含量[J].中国食品添加剂,2010(4):273-276
[8]刘怡君,郭明,刘涛.超高压液相色谱法分析12 种氟苯甲酸示踪剂[J].分析试验室,2010,29(9):61-64
[9]卢建锋.超高压液相色谱法测定金银花中绿原酸的含量[J].安徽农业科学,2011,39(7):3946-3947
[10]陈皓,刘颖,刘海玲,等.超高效液相色谱法检测土壤中的多环芳烃[J].色谱,2008,26(6):769-771
[11]陈德文,汪欢晃,金训伦,等.超高压液相色谱法测定化妆品中马来酸二乙酯[J].理化检验:化学分册,2011,47(3):342-343
[12]佘永新,刘佳佳,王静,等.超高压液相色谱-串联四极杆质谱法对牛奶中24 种磺胺类药物残留的检测[J].分析测试学报,2008,27(12):1313-1317
[13]YANG F Q,GUAN J,LI S P.Fast simultaneous determination of 14 nucleosides and nucleobases in cultured Cordyceps using ultraperformance liquid chromatography[J].Talanta,2007(73):269-273
