云南丽江产白雪茶多糖提取工艺及抗氧化作用
2013-07-12林春榕罗永会张翠香韩红胡志强左绍远
林春榕,罗永会,张翠香,韩红,胡志强,左绍远
(1.大理学院基础医学院,云南 大理 671000,2.大理学院基础医学院2004级医学检验班,云南 大理 671000)
白雪茶(Thamnolia vermicularis(Sw.)Ach),又称地衣,太白茶,为地衣类地茶科地茶属植物,全株呈白色或灰绿色,管状,长3 cm~7 cm,直径3 mm~5 mm。雪茶为耐寒植物,生长于海拔4 000 m 以上的高山地区,在云南的迪庆、丽江、大理苍山等地区分布较广泛,在滇西北地区一直作为一种传统饮品及旅游食品使用。雪茶性寒,具有清热、消暑、生津止渴等功效[1],对中暑、肺热咳嗽、高血压及肥胖等有一定防治作用[1]。多糖是一类结构复杂的生物大分子物质,具有多种复杂而广泛的生物学活性[2-4],已成为功能性食品新资源的研究开发的热点之一。我们前期研究表明,白雪茶多糖具有促进免疫功能的作用[5]。为综合开发利用云南白雪茶资源,我们对云南丽江产白雪茶中多糖的分离提取工艺及其在体外抗氧化活性进行了研究,以期为研究开发白雪茶深加工食品、扩大白雪茶的用途提供参考。
1 材料
1.1 试剂与原料
D-葡萄糖标准品:Sigma 公司;硫酸亚铁、水杨酸、双氧水、三羟甲基氨基甲烷、无水乙醇、丙酮、乙醚、正丁醇、三氯甲烷、硫酸等试剂:均为国产化学分析纯。白雪茶,云南丽江红叶土特产经营公司产品(批号:20101102)。
1.2 仪器
HH-W420/600 恒温水浴箱:金坛市瑞华仪器有限公司;AG 135 电子天平:瑞士梅特勒-托利多公司;RE-52A 型旋转蒸发仪:上海亚东生化仪器厂;FD-1型冷冻干燥机:北京博医康技术有限公司;UV2550 型紫外可见分光光度计:日本岛津苏州仪器有限公司;TDL-5-A 低速台式大容量离心机:上海安亭科学仪器纯厂。
2 方法
2.1 标准曲线的绘制[6]
精密称取105 ℃干燥至恒重的葡萄糖标准品100.0 mg 置100 mL 容量瓶中,用蒸馏水溶解后,稀释至100 mL 定容,得葡萄糖标准储备液。吸取储备液10.0 mL 置100 mL 容量瓶中,用蒸馏水定容,得葡萄糖标准应用液(100 μg/mL)。精密吸取应用液0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80 mL,分别置于具塞试管,补蒸馏水至总体积2.0 mL,加6.0 %苯酚试剂1.0 mL后,各管迅速加浓H2SO45.0 mL,摇匀,沸水加热10 min,迅速流水冷却,另取2.0 mL 蒸馏水,同法操作,加入试剂作空白对照,在490 nm 测定吸光度。以吸光度为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线。
2.2 白雪茶多糖的提取工艺流程与多糖提取率的测定
称取白雪茶200.0 g,粉碎后用石油醚、95%乙醇各回流1 次,每次2 h。滤渣加蒸馏水水浴浸提2 次,合并滤液,减压浓缩至适当体积后加95%乙醇至乙醇体积分数为75%醇沉,置4 ℃过夜,离心,沉淀用Sevag法脱蛋白[6]至280 nm 无明显蛋白吸收峰后,加95%乙醇至乙醇体积分数为80%醇沉,沉淀用蒸馏水透析24 h,醇沉,沉淀依次用无水乙醇、丙酮、乙醚洗涤3次,-20 ℃冷冻干燥至恒重,得白雪茶粗多糖样品,置玻璃干燥器中备用。精密称取白雪茶粗多糖样品100.0 mg,按2.1 方法同法操作,测定吸光度。根据葡萄糖标准曲线计算出粗多糖样品中多糖的质量分数。按公式:多糖提取率(%)=[多糖质量分数(%)×粗多糖样品质量(g)/蜂花粉干重质量(g)]×100 计算多糖提取率。
2.3 白雪茶多糖提取的正交试验
本实验选择提时间、提取温度,料液比为观察因素,采用L9(34)正交试验表设计试验(见表1),以多糖提取率为考察指标,筛选最佳提取条件。
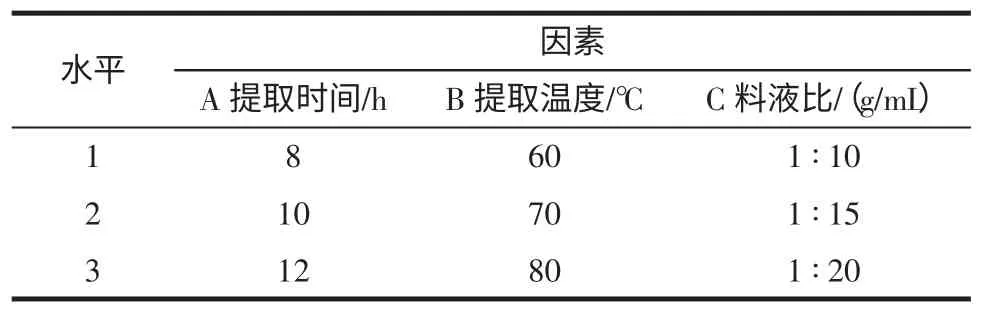
表1 白雪茶多糖提取正交试验因素水平表Table 1 Factors and levels of orthogonal experiments for extraction Thamnolia vermicularis polysaccharide
2.4 白雪茶多糖对清除羟基自由基(·OH)的作用
[7-8]方法进行。将多糖样品配制为0.10、0.20、0.30、0.40、0.50、0.60 mg/mL 质量浓度溶液,各取1.0 mL,分别加入9.0 mmol/L FeSO4、9.0 mmol/L水杨酸-乙醇各1.0 mL,对照组以蒸馏水1.0mL 代替多糖溶液。最后加8.8 mmol/L H2O2启动反应,37 ℃水浴反应0.5 h 后,以蒸馏水调零,在波长510 nm 下测定吸光度。为扣除多糖溶液本身可能产生的吸光值,以不加H2O2的多糖溶液作为本底管。以VC作阳性对照品,临用前用蒸馏水配制成与多糖溶液相同的质量浓度。同法操作,进行对照试验。每个质量浓度做3 个平行管,结果取平均值。按清除率(%)=[(A0-Ax-Ax0)/A0]×100 计算清除率。式中:A0为对照组吸光度值,Ax为多糖样品吸光度值,Ax0为本底管吸光度值。
2.5 白雪茶多糖对清除超氧阴离子自由基的作用
采用邻苯三酚自氧化法进行测定[9-10]。多糖样品配制同2.4。取pH8.2 的Tris-HCl 缓冲液0.50 mL 于具塞试管,加不同质量浓度的多糖液1.0 mL 置25 ℃水浴保温20 min 后,再加入在25 ℃预热的5.0 mmol/L 邻苯三酚溶液0.5 mL,混匀后25 ℃水浴4 min,快速摇匀,在325 nm 处,以pH 8.2 的Tris-HCl 缓冲液调零,每隔30 s 测定1 次吸光度,连续测定4min,计算加入多糖样品后的自氧化速率△Ax。自氧化速率=(最后1次测定值-第1 次测定值)/4。空白对照组以1.0 mL 蒸馏水溶液代替多糖样品,同法操作,测定自氧化速率△A0。同法以VC作为阳性对照试验。按公式:清除率(%)=[(△A0-△Ax)/△A0]×100 计算清除率。
3 实验结果
3.1 标准曲线的绘制
以吸光度为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线,计算出回归方程为:A=0.006C-0.005,R2=0.998 2,表明葡萄糖质量浓度在10 μg/mL~80 μg/mL范围内与吸光度值有较好的线性关系。
3.2 白雪茶多糖提取正交试验结果
白雪茶多糖提取正交试验结果见表2、表3。
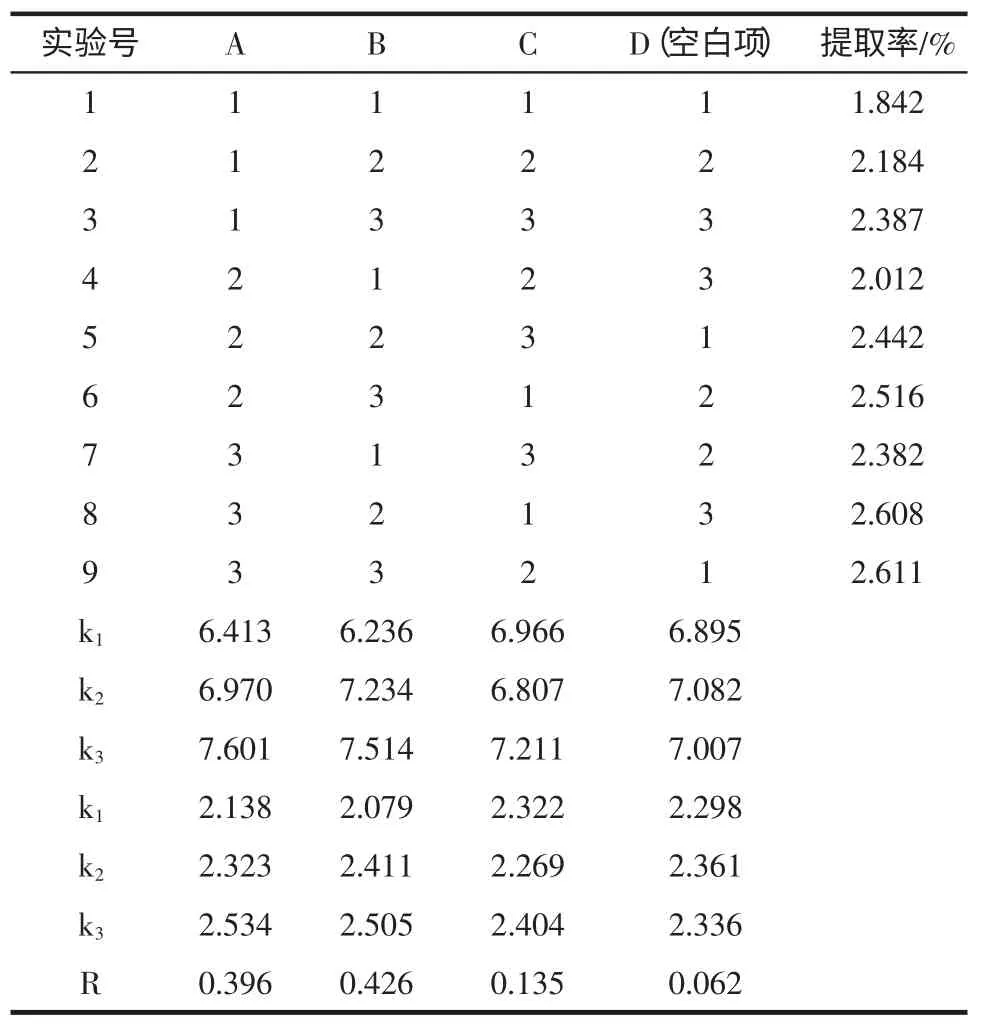
表2 白雪茶多糖提取正交试验结果Table 2 Results of orthogonal experiments for extraction Thamnolia vermicularis polysaccharide

表3 白雪茶多糖提取正交试验方差分析表Table 3 Variance analysis of orthogonal experiments for extraction Thamnolia vermicularis polysaccharide
由表2 可直观看出,正交试验极差R 的大小顺序为RB>RA>RC,即对多糖提取率的影响依次为提取温度>提取时间>料液比。方差分析表明,提取温度、提取时间对提取率的影响有显著性差异(P<0.05),而料液比影响较小(P>0.05)。考虑到后续减压浓缩等因素,料液比不宜过大,故本实验选择白雪茶多糖的最佳提取条件为A3B3C2,即提取温度为80 ℃,浸提时间为12 h,料液比为1∶15。为进一步验证A3B3C2提取条件,本实验按此工艺对白雪茶多糖提取进行了3 组平行试验,结果表明,3 次试验的多糖提取率分别为2.605 %、2.614%、2.607%,平均提取率2.609%(RSD=1.48%)。表明A3B3C2工艺组合稳定可行。
3.3 白雪茶多糖对清除羟基自由基(·OH)的作用
白雪茶多糖对清除羟基自由基(·OH)的作用结果,见图1。

图1 不同质量浓度白雪茶多糖和VC对·OH 的清除率Fig.1 Different mass concentration of Thamnolia vermicularis polysaccharide and vitamin C on the effect of scavenging hydroxyl free radical
结果表明,在质量浓度低于0.30 mg/mL 时,多糖清除·OH 的作用较小,而质量浓度从0.30 mg/mL 增加到0.40 mg/mL 时,清除率从11.02 %迅速升高至36.56%。表明雪茶多糖对清除·OH 的作用有剂量依赖关系,在40.0 mg/mL~0.60 mg/mL 剂量范围内,表现出一定的剂量效应关系。

图2 不同质量浓度白雪茶多糖和VC对·的清除率Fig.2 Different mass concentration of Thamnolia vermicularis polysaccharide and vitamin C on the effect of scavenging superoxide anion free radical
4 讨论

参考文献:
[1]江苏新医学院.中药大辞典:上册[M].上海:上海人民出版社,1986:992-994
[2]魏桂芳,徐磊,姚宏.红花的鉴定标准与药理研究[J].陕西中医,2010,31(6):376-377
[3]朱欣婷,植物多糖的生物活性研究进展[J].安徽农业科学,2008,36(28):12076-12077
[4]董莎莎,左绍远.花粉多糖抗肿瘤作用机理研究进展[J].中国民族民间医药,2009,18(3):29-30
[5]张丙灿,左绍远,董莎莎.雪茶多糖对免疫功能的影响[J].亚太传统医药,2010,6(3):11-13
[6]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:13-14
[7]Smimorff N,Cumbes Q J.Hyroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060
[8]王德才,高丽君,高艳霞.泰山四叶参多糖体外抗氧化活性的研究[J].中国生化药物杂志,2008,29(2):104-106
[9]范三红,周立波.油松花粉多糖提取及其清除羟自由基活性研究[J].食品科学,2009,29(12):274-277
[10]张泽庆,田应娟,张静.防风多糖的抗氧化活性研究[J].中药材,2008,31(2):268-269
