不同萃取体系对小球藻藻渣成分的影响
2013-07-07尹丰伟郑洪立郑艳萍
尹丰伟,段 珺,高 振,郑洪立,郑艳萍,黄 和,2
(1.南京工业大学生物与制药工程学院,南京211800;
2.南京工业大学材料化学工程国家重点实验室,南京210009)
不同萃取体系对小球藻藻渣成分的影响
尹丰伟1,段 珺1,高 振1,郑洪立1,郑艳萍1,黄 和1,2
(1.南京工业大学生物与制药工程学院,南京211800;
2.南京工业大学材料化学工程国家重点实验室,南京210009)
考察5种萃取体系(A:正己烷,B:正己烷/乙醇,C:正己烷/异丙醇,D:氯仿/甲醇,E:氯仿/乙醇)对小球藻(Chlorella phyrenoidosa)油脂的提取效果及藻渣成分的影响。实验结果表明:不同的萃取体系下,油脂得率为D(12.27%)、E(8.87%)、C(7.71%)、B(6.80%)、A(3.91%),藻渣蛋白含量为A(52.60%)、E(46.23%)、B(40.19%)、C(39.52%)、D(32.52%),藻渣碳水化合物含量为A(23.28%)、E(16.15%)、B(13.24%)、D(13.50%)、C(9.06%);藻渣色素含量为A(1.75%)、E(1.29%)、B(1.14%)、C(0.96%)、D(0.58%);藻渣灰分含量为D(3.63%)、E(2.94%)、C(2.23%)、B(2.25%)、A(1.48%)。综合考虑微藻生物柴油的生产及藻渣的可利用性,V(氯仿)/V(乙醇)=1是一种油脂萃取效果较好,藻渣营养成分损失较小的小球藻油脂萃取体系。
小球藻;萃取;油脂;微藻;营养成分
当前,由于全球能源、资源和环境压力,使研究者的目光投向了对生物质资源的开发与利用[1],在众多的生物质原料中,微藻光合效率高、生长速度快、油脂含量高,具有开发成生物柴油原料的潜能[2],但因生产成本高[3],未能实现规模化生产。微藻柴油生产中,油脂的提取是其中一个关键环节,有机溶剂萃取法因成本较低、溶剂可回收利用等优势[4],是微藻油脂提取中的常用方法。前人关于微藻油脂的提取做了大量研究,并针对不同的微藻提出了不同的有机溶剂萃取体系和提取方法[5-7],其中以混合萃取体系(极性与非极性有机溶剂混合)的提取效果最好[8]。微藻除了含有可供生产生物柴油的油脂外,还含有大量的蛋白、多糖、色素、矿质元素等,因此藻渣中会残留丰富的营养成分,并且微藻油脂提取后会产生50%~80%的藻渣[9]。有报道指出将微藻油脂生产和藻渣的利用结合起来是降低生物柴油生产成本的有效途径之一[10],同时也可避免藻渣堆积带来的环境污染。
虽然有关微藻油脂提取方面的研究已取得很大的进展,但这些研究很少涉及并考虑到不同萃取方法对提油之后藻渣的影响。针对该问题,笔者拟在前人研究的基础上,综合目前实验中常用的萃取体系,考察不同萃取体系对蛋白核小球藻(Chlorella phyrenoidosa)藻渣成分的影响,为小球藻油脂的提取和藻渣利用提供参考。
1 材料与方法
1.1 小球藻
实验所用的蛋白核小球藻(Chlorella phyrenoidosa)由笔者所在课题组培养。
1.2 油脂的提取
根据前人研究,拟采用5种不同的萃取体系(所用的试剂均为分析纯,以后皆用A~E表示):A正己烷[11],B正己烷/乙醇(体积比1∶1)[6],C正己烷/异丙醇(体积比1∶1)[7],D氯仿/甲醇(体积比1∶1)[5],E氯仿/乙醇(体积比1∶1,由笔者根据文献[8]提出)。
称2 g藻粉,液氮破壁[6]后收集于50 mL具塞三角瓶中,分别加入20 mL A~E的萃取体系,25℃、200 r/min条件下振荡萃取2 h.萃取结束后加10 mL蒸馏水分层[8],分别取正己烷层和氯仿层于25 mL圆底烧甁中,并再用相同体积的正己烷和氯仿萃取2次。有机溶剂经减压蒸馏去除,即得粗油脂,具体流程见图1。

图1 小球藻油脂的提取与藻渣获取路线Fig.1 Roadmap of lipid extraction and algae⁃residues obtained from C.phyrenoidosa
1.3 藻渣的获得
油脂提取之后,将剩下的含小球藻细胞碎片的藻液离心(在4℃下5 000 r/min离心10 min)弃上清,细胞碎片再用蒸馏水洗3次,收集沉淀,60℃烘干,即得藻渣(图1)。
1.4 分析方法
油脂得率的计算及脂肪酸分析参照文献[6]。蛋白质的测定参照文献[12],以6.25作为总N转化为蛋白质的系数。
氨基酸测定:称取0.02 g藻渣于10 mL水解管中,加10 mL 6 mol/L HCl,120℃条件下水解24 h。氨基酸的分析方法参照文献[13]。
藻渣碳水化合物的测定采用H2SO4蒽酮法[14]。
藻渣色素的提取与分析参照文献[15]。
藻渣灰分的测定参照文献[16]。
藻渣矿质元素的分析:藻渣灰化后以1∶49(体积比)的HNO3溶解后,进行ICP分析[17]。
2 结果与讨论
2.1 萃取体系对油脂得率的影响
考察萃取体系对油脂得率的影响,结果见图2。由图2可知:小球藻的油脂约占细胞干质量的10%,不同的萃取体系下的油脂得率差异明显;单一非极性有机溶剂(A)下的油脂得率最少,只有3.91%,混合萃取体系下油脂的得率较高,其中D条件下可达到12.27%。Halim等[11]发现正己烷/异丙醇条件下获得的油脂要比单一的正己烷条件下多3倍左右,并提出了微藻油脂的萃取机制[8],认为极性和非极性有机溶剂可针对不同类型油脂的萃取,而混合萃取体系更利于微藻油脂的萃取,原因与细胞中同膜蛋白相连的油脂相关。这是因为藻细胞含有极性脂,并通过氢键或其他较强的静电键与膜上的蛋白质相连,萃取体系中的极性溶剂可以破坏这种连接[11],将这类脂从膜蛋白上“拉”出来并溶于有机溶剂中。本实验进一步证实了该机制,并发现不同非极性/极性有机溶剂组合变化对油脂的提取效果不同。

图2 萃取体系对小球藻的油脂得率的影响Fig.2 Effects of extraction system s on lipid yield of C.phyrenoidosa
2.2 萃取体系对脂肪酸分布的影响
表1为萃取体系对脂肪酸分布的影响结果。由表1可知:该蛋白核小球藻的脂肪酸类型分布为C14∶0~C18∶3,不饱和脂肪酸(UFA)含量较高,约占总脂肪酸的77%;所有脂肪酸中,以C18∶2(亚油酸)、C16∶0(软脂酸)和C18∶3(亚麻酸)的含量较高。由表1还可以看出,不同萃取体系下得到的脂肪酸具有明显的差别:单一正己烷条件(A)不利于饱和脂肪酸的提取,饱和脂肪酸(SFA)占总脂肪酸的21.04%,这可能是由于不饱和脂肪酸多以极性结构脂的形式存在有关;其他4种混合萃取体系,以B得到的饱和脂肪酸比例较高,达到总脂肪酸的24.43%,以C条件下的最少,为22.74%。这说明油脂在细胞内有不同存在形式,且进一步说明不同的萃取体系对细胞内油脂的作用力不同。

表1 萃取体系对小球藻的脂肪酸分布及含量的影响Table 1 Effects of extraction system s on the fatty acid composition and contents in C.phyrenoidosa
2.3 萃取体系对藻渣蛋白含量的影响
图3为不同萃取条件下藻渣的蛋白含量结果。由图3可知:该小球藻藻渣中的蛋白质占到藻渣干质量的45%左右,可作为一种良好的蛋白食品或蛋白饲料源;A条件下的藻渣蛋白含量较高,占藻渣干质量的52.60%,D条件下得到的最少,为32.52%。本实验采用液氮研磨对细胞进行破壁处理[6],因此细胞膜上的极性脂与蛋白的复合体有可能在萃取时一并进入到有机溶剂中,造成藻渣蛋白含量的减少。另外,混合萃取体系中的极性溶剂(水醇相)含有色素、蛋白质、氨基酸和其他的非油脂成分[18],造成部分蛋白质的流失。实验中所用到的几种极性溶剂极性各不相同,可能会造成不同萃取体系中的水醇相蛋白含量不同。因此,藻渣蛋白含量受多种因素影响,具体原因和机制有待进一步深入研究。
2.4 萃取体系对藻渣的氨基酸组成及含量的影响
表2为藻渣中的氨基酸及其含量。由表2可知:4种混合萃取体系(B~E)下的氨基酸含量相似,但单一萃取体系(A)与混合萃取体系(B~E)相比在某些氨基酸含量上具有较大差异,这可能与萃取过程中因萃取体系不同而造成的蛋白质流失有关。

图3 萃取体系对藻渣的蛋白含量的影响Fig.3 Effects of extraction systems on protein contents in algae⁃residues

表2 萃取体系对藻渣中氨基酸的组成及含量的影响Table 2 Effects of extraction system s on am ino acid compositions and content of algae⁃residues
2.5 萃取体系对藻渣的碳水化合物含量的影响
图4为不同萃取体系下的藻渣中碳水化合物含量结果。由图4可知:小球藻细胞中含有较多的糖脂(glycolipid),约占细胞干质量的5.7%[19]。糖脂作为一种极性脂是膜脂的重要组成成分[20],在油脂的萃取过程中一部分糖脂溶于有机溶剂而被提取出来,使藻渣中的碳水化合物含量降低。另外,小球藻的部分碳水化合物因溶于水醇相中而流失[18],也会降低藻渣碳水化合物的含量。从图4还可以看出,混合萃取体系对藻渣碳水化合物的含量影响较大,且不同的混合萃取体系之间也有较大差别。

图4 萃取体系对藻渣的碳水化合物含量的影响Fig.4 Effects of extraction systems on content of total carbohydrate in algae⁃residues
2.6 不同萃取体系下的藻渣色素含量
不同萃取体系下藻渣中叶绿素a、叶绿素b和类胡萝卜素的含量变化如图5所示。由图5可知:A条件下的藻渣色素含量最多,达到17.51mg/g;其次为B、C和E,三者相差不大;D条件下最少,为5.59 mg/g。将该结果与2.1节结果对照可知,油脂萃取效果好的体系同样对色素有着良好的萃取作用,这主要是因为这3种色素都是脂溶性的,在油脂的萃取过程中溶于有机溶剂而使藻渣中的色素含量降低。有研究表明氯仿/甲醇体系利于叶绿素a的提取[21-22],本实验的结果也表明了这一点,并且还证明该体系同时还适用于另外2种色素的萃取(图5)。藻渣中色素含量的差异也说明不同萃取体系对微藻不同色素的作用力不同。
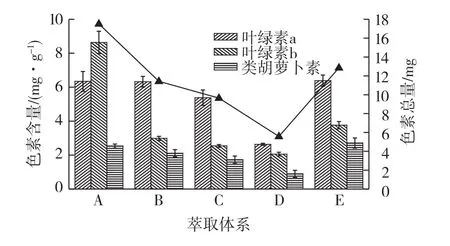
图5 萃取体系对藻渣的色素含量的影响Fig.5 Effects of extraction system s on pigment contents in algae⁃residues
2.7 萃取体系对藻渣的灰分含量的影响
不同萃取体系下的藻渣中灰分含量如图6所示。由图6可知:藻渣中的灰分含量较少;不同萃取体系下的藻渣灰分含量不同,以D条件下得到的灰分最多,占到藻渣干质量的3.36%。灰分主要是无机成分的残留物,本实验获取的藻渣是破壁后的小球藻经水和有机溶剂处理后的残余物,为藻细胞的结构成分(细胞器、细胞膜和细胞壁等),胞内游离无机盐易在处理过程中流失。而灰分含量的测定是以占干质量的百分比计算的,而由前面的分析可知,A条件下的油脂得率最低,藻渣中残留的油脂、蛋白质、碳水化合物的含量最高,使得灰分在总干质量中所占的比例降低;D条件则恰好相反。
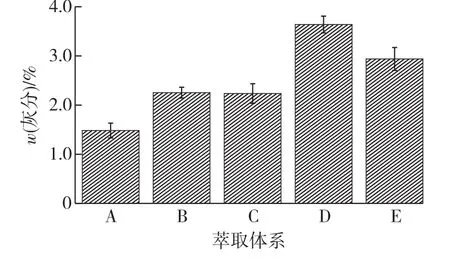
图6 萃取体系对藻渣的灰分含量的影响Fig.6 Effects of extraction system s on ash content in algae residues
2.8 萃取体系对藻渣中矿质元素含量的影响
分析了不同萃取体系下藻渣中的9种矿质元素(P、Ca、Na、K、Fe、Al、Zn、Cu和Mn),结果如表3所示。由表3可知:藻渣中含有丰富的P、Ca和Na,分别占到矿质元素总质量的50%、20%和15%左右,Al、Zn、Cu和Mn的含量则相对较少。9种元素中,P含量具有显著的优势,这是因为藻渣主要是残破的细胞结构,而P又是细胞核和细胞膜等细胞结构的重要组成元素。不同萃取体系下,藻渣矿质元素占藻渣干质量的含量(mg/g)由多到少依次为D(869.19)、E(656.98)、B(548.98)、C(483.78)、A(424.70),此趋势同藻渣灰分的含量趋势一致(图6),这是因为矿质元素是灰分的主要成分。
2.9 萃取体系的评价
综合以上实验结果,针对微藻生物柴油的生产和藻渣的可利用性,并参照美国能源部关于微藻生物炼制的概述[23],对油脂和藻渣成分各项指标分配权重。其中油脂的获得是主要目标,因此给以最高权重值为0.3,藻渣中的成分根据其经济价值分别赋予不同的权重(表4),并为各种萃取体系打分(相差不明显的计相同分)。在该评价方法下,E萃取体系得到的分数最高为4.0,其次为A(3.8)和D(3.2),得分最少的为B(2.8)和C(2.4)。因此在该评价方法下,E萃取体系(氯仿/乙醇)获得的油脂得率较高,且藻渣成分损失较少。

表3 萃取体系对藻渣中的矿质元素含量的影响Table 3 Effects of extraction system s on m ineral contents in algae⁃residues
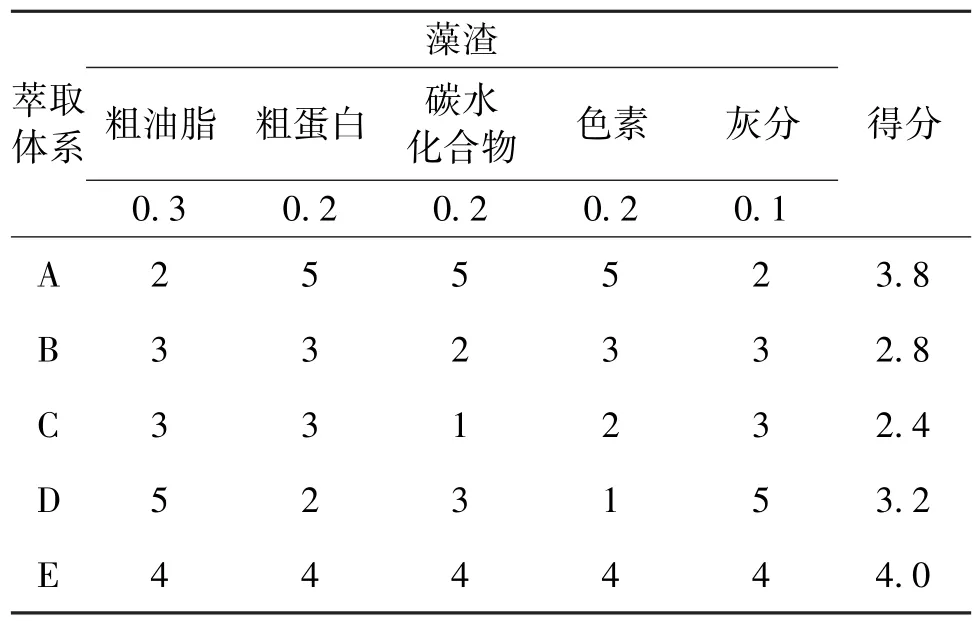
表4 萃取体系的评价Table 4 Evaluation of extraction systems
3 结 论
油脂萃取后的小球藻(Chlorella phyrenoidosa)藻渣中仍含有丰富的营养成分,具有进一步开发利用的潜力。单一非极性有机溶剂不利于油脂的萃取,但得到的藻渣营养成分损失最少;混合萃取体系由于其极性溶剂能破坏极性脂与膜的连接,因此更能充分提取细胞中的油脂成分,但同时也造成藻渣成分损失较多——一部分溶于水醇相中而流失,另一部分溶于非极性溶剂中,具体的组成及含量有待于进一步研究。不同的混合萃取体系由于极性的不同对油脂的提取效果和藻渣成分的影响也不同,氯仿/乙醇(体积比1∶1)体系相对是一种提油效果较好、藻渣营养成分损失较小的萃取体系,但由于氯仿的使用可能会限制藻渣的进一步利用,因此针对微藻及藻渣的利用方向可选择不同的萃取体系,另外开发一种有效的有机溶剂去除方法也可以拓宽藻渣的应用范围。
[1] Lang X,Dalai A K,Bakhshi N N,et al.Preparation and characterization of bio⁃diesels from various bio⁃oils[J].Bioresour Technol,2001,80(1):53⁃62.
[2] Wijffels R H,Barbosa M J.An outlook on microalgal biofuels[J].Science,2010,329:796⁃799.
[3] Li Y G,Xu L,Huang Y M,et al.Microalgal biodiesel in China:opportunities and challenges[J].Appl Energy,2011,88(10):3432⁃3437.
[4] Mercer P,Armenta R E.Developments in oil extraction from microalgae[J].Eur J Lipid Sci Technol,2011,113(5):539⁃547.
[5] Lee JY,Yoo C,Jun SY,etal.Comparison of severalmethods for effective lipid extraction from microalgae[J].Bioresour Technol,2010,101(1):S75⁃S77.
[6] Zheng H,Yin J,Gao Z,etal.Disruption of Chlorella vulgaris cells for the release of biodiesel⁃producing lipids:a comparison of grinding,ultrasonication,bead milling,enzymatic lysis,and microwaves[J].Appl Biochem Biotechnol,2011,164(7):1215⁃1224.
[7] Grima E M,Medina A R,Gim nez A G,et al.Comparison between extraction of lipids and fatty acids from microalgal biomass[J].JAm Oil Chem Soc,1994,71(9):955⁃959.
[8] Halim R,Danquah M K,Webley P A.Extraction of oil from microalgae for biodiesel production:a review[J].Biotechnol Adv,2012,30(3):709⁃732.
[9] Milledge J J.The challenge of algal fuel:economic processing of the entire algal biomass[J].Condensed Matter,2010,1(6):4⁃6.
[10] Vasudevan P T,Briggs M.Biodiesel production:current state of the art and challenges[J].J Ind Microbiol Biotechnol,2008,35(5):421⁃430.
[11] Halim R,Gladman B,Danquah M K,et al.Oil extraction from microalgae for biodiesel production[J].Bioresour Technol,2011,102(1):178⁃185.
[12] 卫生部.GB 5009.5—2010食品中蛋白质的测定[M].北京:中国标准出版社,2010.
[13] 史纯珍,张红漫,黄和,等.米根霉胞内氨基酸的高效液相色谱测定及其代谢途径分析[J].分析化学,2012,40(4):574⁃578.
[14] Morris D L.Quantitative determination of carbohydrates with Dreywood's anthrone reagent[J].Science,1948,107:254⁃255.
[15] Wellburn R.The spectral determination of chlorophylls a and b,as well as total carotenoids,using various solvents with spectrophotometers of different resolution[J].J Plant Physiol,1994,144(3):307⁃313.
[16] 卫生部.GB 5009.4—2010食品中灰分的测定[M].北京:中国标准出版,2010.
[17] Li X,Coles B J,Ramsey M H,et al.Sequential extraction of soils formultielementanalysis by ICP⁃AES[J].ChemiGeol,1995,124(1/2):109⁃123.
[18] Fajardo A R,Cerdán L E,Medina A R,et al.Lipid extraction from the microalga Phaeodactylum tricornutum[J].Eur J Lipid Sci Technol,2007,109(2):120⁃126.
[19] Murakami C,Takahashi J,Shimpo K,et al.Lipids and fatty acid compositions of Chlorella[J].JJpn Oil Chem Soc,1997,46:423⁃428.
[20] Liu J,Huang J,Sun Z,et al.Differential lipid and fatty acid profiles of photoautotrophic and heterotrophic Chlorella zofingiensis:assessment of algal oils for biodiesel production[J]. Bioresour Technol,2011,102(1):106⁃110.
[21] Wood LW.Chloroform⁃methanol extraction of chlorophyll a[J]. Can JFish Aquat Sci,1985,42(1):38⁃43.
[22] Lloyd SW,Tucker C S.Comparison of three solvent systems for extraction of chlorophyll a from fish pond phytoplankton communities[J].JWorld Aquacult Soc,2007,19(2):36⁃40.
[23] USDOE.National algal biofuels technology roadmap[EB/OL].[2012⁃10⁃08].http://www1.eere.energy.gov/bioenergy/pdfs/algal_biofuels_roadmap.pdf.
Effects of extraction system s on com positions of oil⁃extracted algae⁃residues from Chlorella phyrenoidosa
YIN Fengwei1,DUAN Jun1,GAO Zhen1,ZHENG Hongli1,ZHENG Yanping1,HUANG He1,2
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 211800,China;2.State key Laboratory of Materials⁃Oriented Chemical Engineering,Nanjing University of Technology,Nanjing 210009,China)
The effects of five kinds of extraction systems(A:n⁃hexane,B:n⁃hexane/alcohol,C:n⁃hexane/isopropyl,D:chloroform/methanol,E:chloroform/alcohol)on lipid extraction and nutrient compositions of algae⁃residues from Chlorella phyrenoidosa were studied.By different extraction systems,the lipid yield were:D(12.27%),E(8.87%),C(7.71%),B(6.80%),A(3.91%);the crude protein content of algae⁃residueswere:A(52.60%),E(46.23%),B(40.19%),C(39.52%),D(32.52%);the total carbohydrates of algae⁃residueswere:A(23.28%),E(16.15),B(13.24%),D(13.50),C(9.06%);the pigments contents of algae⁃residues were:A(1.75%)),E(1.29%),B(1.14%),C(0.96%),D(0.58%);the ash contents of algae⁃residueswere:D(3.36%),E(2.94%),C(2.23%),B(2.25%),A(1.48%).The extraction system V(chloroform)/V(alcohol)=1 was suitable for microalgae lipid extraction because of its higher lipid yield and much less influence on nutrient composition of algae⁃residues.
Chlorella phyrenoidosa;extraction;lipid;microalgae;nutrient composition
Q819
A
1672-3678(2013)06-0009-06
10.3969/j.issn.1672-3678.2013.06.002
2012-10-10
国家重点基础研究发展计划(973计划)(2011CB200906)
尹丰伟(1985—),男,山东青岛人,硕士研究生,研究方向:生物化工;高 振(联系人),副研究员,E⁃mail:gaozhen@njut.edu.cn
