使用BODIPY荧光染料快速测定微藻油脂含量方法
2013-07-07刘亚男姚长洪周建男孟迎迎王海涛曹旭鹏
刘亚男,姚长洪,2,周建男,孟迎迎,王海涛,2,曹旭鹏,薛 松
(1.中国科学院大连化学物理研究所,大连116023;2.中国科学院大学,北京100049;3.大连理工大学生命科学与技术学院,大连116024)
使用BODIPY荧光染料快速测定微藻油脂含量方法
刘亚男1,姚长洪1,2,周建男1,孟迎迎3,王海涛1,2,曹旭鹏1,薛 松1
(1.中国科学院大连化学物理研究所,大连116023;2.中国科学院大学,北京100049;3.大连理工大学生命科学与技术学院,大连116024)
使用BODIPY505/515荧光染料,通过荧光分光光度法测定藻细胞中的油脂含量。结果表明:BODIPY505/515的最佳染色条件为二甲基亚砜(DMSO)体积分数2%,BODIPY505/515最终质量浓度0.25μg/mL,染色时间30 min,染色温度35℃。在最佳染色条件下,微藻油脂含量与荧光强度呈线性相关(R2=0.976 4)。通过测定BODIPY505/515染色的不同种属微藻的荧光强度,应用该关系计算其油脂含量,与质量法测定的结果相比没有显著差异。该方法较为普适,比传统方法相比具有简便快捷,试样用量少的特点,与尼罗红荧光染料相比具有较窄的发射波谱范围,不会与微藻的自身荧光相互干扰,更适于过程监控及高含油藻株的筛选。
BODIPY;荧光;油脂;微藻
能源是经济可持续发展的动力,而石化燃料资源的日益枯竭却给全球经济的发展带来了危机[1]。微藻作为一种潜在的可再生能源的生产者,具有光合效率高、生长速率快、生长周期短、单细胞油脂含量高和不占用耕地等优点,在生物质能源生产领域受到了越来越广泛的重视[2]。
微藻藻种选育是生物柴油生产过程中关键环节之一,其中油脂含量是藻种筛选的重要指标,选育富油藻种是规模化培养的前提条件[3]。快速、准确、简便的油脂含量测定方法不仅对富油藻种的筛选和生物柴油的生产极其重要,对微藻生物学的研究也具有十分重要的意义[4]。
质量法是最为常用的微藻油脂测定方法,该方法准确度高,但存在所需试样量大、试样处理与提取过程耗时长、使用有毒的有机溶剂提取、环境友好度差且测量成本较高的缺点。近年来,文献[5-7]利用荧光染料特异性结合微藻中性脂油滴来分析油脂含量,以尼罗红荧光染色法最为常见。这种方法能快速、灵敏地实现微藻中性脂的检测,但是尼罗红的发射光在590~640 nm范围内,与很多藻的自身叶绿素荧光相互干扰,导致不能准确地进行检测。因此,需要找到一种更为广泛适用的能够避免藻类自身荧光干扰的荧光染料。
BODIPY是一类近红外的短波长荧光染料,常见的有BODIPY493/503、BODIPY500/510、BODIPY505/515、BODIPY530/550、BODIPY558/568,它们可以特异性地作用于中性脂组成的油滴,使得油滴可以被检测,且其发射波长可以避开大部分藻自身叶绿素荧光的干扰[8],目前,已有在流式细胞仪中使用BODIPY505/515进行产油微藻筛选的报道[9-10],但流式细胞仪操作复杂,价格昂贵,不宜推广。利用BODIPY染色可以在荧光显微镜下定性观察微藻油脂积累的情况[11],但还没有利用该染料的荧光强度定量检测微藻油脂含量的报道。
笔者以湛江等鞭金藻(Isochrysis zhangjiangensis)为实验对象,利用BODIPY505/515对其中性脂进行染色,使用荧光分光光度计进行荧光强度的测定,考察该染料的最佳染色条件,并通过与传统质量法的比较,建立荧光强度与油脂含量的关系,将应用到绿藻、硅藻等其他藻中,以实现荧光分光光度计快速检测微藻油脂含量,为藻类培养的过程监控及产油微藻的筛选奠定基础。
1 材料与方法
1.1 材料
1.1.1 藻种
海水藻:湛江等鞭金藻(Isochrysis zhangjiangen⁃sis)、亚心形四爿藻(Tetraselmis subcordiformis)、新月藻(Nitzschia closterium)、巴夫藻(Pavlova viridis)和牟氏角毛藻(Chaetocerosmuelleri),由辽宁海洋水产研究所提供。淡水藻:蛋白核小球藻(Chlorella pyrenoidosa),购自中国科学院典型培养物保藏委员会淡水藻种库(FACHB⁃Collection)。
1.1.2 培养基
海水藻培养基由来自大连附近海域的天然海水添加相应的营养盐组成,淡水藻培养基由去离子水添加相应的营养盐组成。
1)康维方营养盐(1 L) NaNO3100 mg,NaH2PO4·2H2O 20.0 mg,EDTA⁃Na245.0 mg,H3BO333.6 mg,MnCl2·4H2O 0.36 mg,FeCl3·6H2O 1.3 mg,ZnCl20.21 mg,CoCl2·6H2O 0.20 mg,(NH4)4Mo7O24· 4H2O 0.09 mg,CuSO4·5H2O 0.20 mg,KNO31 g,KH2PO40.05 g,Tris 0.81 g,CH3COOH 0.346 g,用于培养亚心形四爿藻。
2)f/2营养盐(1 L) NaNO375 mg,NaH2PO4· 2H2O 5 mg,VB120.5μg,生物素(Biotin)0.5μg,VB10.1 mg,FeCl3·6H2O 3.16 mg,Na2EDTA·2H2O 4.36 mg,CuSO4·5H2O 9.8μg,Na2MoO4·2H2O 6.3μg,ZnSO4·7H2O 22μg,CoCl2·6H2O 12μg,MnCl2· 4H2O 0.18 mg,用于培养湛江等鞭金藻和巴夫藻。
3)f/2+硅酸钠营养盐 上述f/2营养盐添加Na2SiO330 mg/L,用于培养新月藻和牟氏角毛藻。
4)SE培养基(1 L) NaNO30.25 g,K2HPO4· 3H2O 0.075 g,MgSO4·7H2O 0.075 g,CaCl2·2H2O 0.025 g,KH2PO40.175 g,NaCl 0.025 g,FeCl3· 6H2O 0.005 g,EDTA⁃Fe 0.005 g,H3BO32.86 mg,MnCl2·4H2O 1.86 mg,ZnSO4·7H2O 0.22 mg,Na2MoO4·2H2O 0.39 mg,CuSO4·5 H2O 0.08 mg,Co(NO3)2·6H2O 0.05 mg,胰蛋白胨1 g,用于培养蛋白核小球藻。
1.1.3 仪器和试剂
Cary Eclipse荧光分光光度计(安捷伦公司),二甲基亚砜(DMSO,Sigma公司),BODIPY 505/515(4,4⁃difluro⁃1,3,5,7⁃tetramethyl⁃4⁃bora⁃3a,4adiazas⁃indacene,Invitrogen公司)。其他试剂为国产分析纯。
1.2 方法
1.2.1 培养条件
6株藻的培养条件相同:温度(25±1)℃,光暗时间比14∶10,日光灯作光源。藻种培养于3 L锥形瓶中,光强为(50±5)μmol/(m2·s),培养至指数期接种使用。培养均在600 mL鼓泡式柱状反应器中完成,培养体积为500mL,光强(200±10)μmol/(m2·s),CO22%(体积分数),通气速率100 mL/min,接种初始密度2×106个/mL。
1.2.2 测定方法
1)油脂含量的测定 使用正己烷对干燥的藻粉进行油脂的提取,称取100 mg藻粉,加入2 mL正己烷进行总脂的提取,提取3遍,合并3次的提取液,N2吹扫至无溶剂后,烘干称质量即可测得油脂占干质量百分比。
2)荧光强度的测定[12]使用荧光分光光度计的孔板阅读模式进行测定,依次向96孔板中加入5 μL稀释后的藻液,3μL一定浓度的BODIPY505/515荧光染料,292μL一定浓度的DMSO水溶液,共300μL体系,使藻液的终浓度保持在OD680值0.15左右,一定温度下避光染色一定时间。选择470 nm作为激发波长,测定在发射波长515 nm的荧光强度。
1.2.3 统计分析
用SPSS 16.0单因素方差分析(ANOVA)中的LSD多重比较进行数据差异性分析。
2 结果与讨论
2.1 染料浓度对染色效果的影响
在不同的BODIPY最终质量浓度条件下对藻细胞进行染色,分别考察BODIPY浓度对荧光强度的影响,每个浓度下有8个重复,结果见图1。
由图1可知:当染料质量浓度小于0.187 5 μg/mL时,荧光强度保持在135,多重比较显示无显著性差异(p>0.05)。随着染料浓度增加,荧光强度逐渐增加,到0.25μg/mL时达到2 171,此后增加染料浓度到1μg/mL,荧光强度无显著增加(p> 0.05)。只有当染料浓度增加到1.25μg/mL时荧光强度迅速增加到6 857,同时考虑到染色的灵敏度和染料用量,选择最佳的染料终质量浓度为0.25 μg/mL。
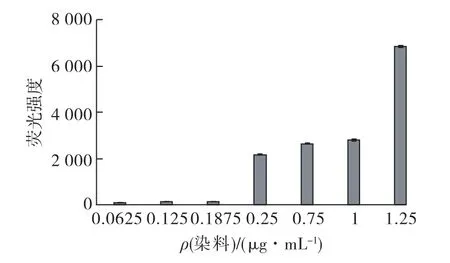
图1 染料浓度对染色效果的影响Fig.1 Effects of dye concentrations on fluorescence intensity
2.2 染色温度对染色效果的影响
在不同的温度下对藻细胞进行染色,分别考察染色温度对荧光强度的影响,染料终质量浓度为0.25μg/mL,每个温度下有8个重复,结果见图2。
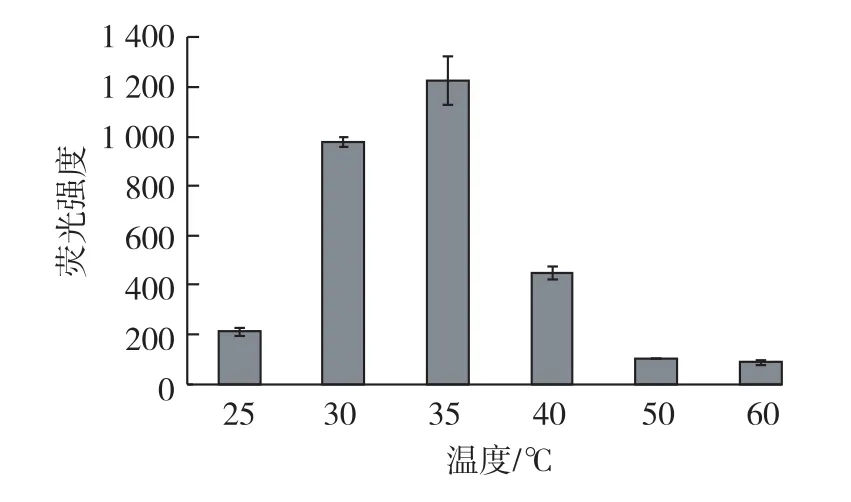
图2 染色温度对染色效果的影响Fig.2 Effects of staining tem peratures on fluorescence intensity
由图2可知:在25~35℃的范围内,随着染色温度的升高,荧光强度逐渐升高,到35℃达到最大,这可能是因为温度的升高有利于BODIPY进入细胞与油滴结合;之后荧光强度随着温度升高而迅速减小,可能是由于温度过高会使荧光染料淬灭[13]。因此,选择最佳染色温度为35℃。
2.3 染色时间对染色效果的影响
为了获得最优的染色时间,考察染色时间对荧光强度的影响,染料终质量浓度为0.25μg/mL,染色温度为35℃。每个染色时间下有8个重复,结果见图3。

图3 染色时间对染色效果的影响Fig.3 Effects of staining time on fluorescence intensity
由图3可知:染色效果随染色时间的延长而增强,染色60 min以后荧光强度几乎不变。在本实验中,为了缩短染色时间而又能达到较好的染色效果,选择30 min为后续的染色时间。
2.4 DMSO对荧光染料染色效果的影响
由于湛江等边金藻没有细胞壁,故使用其进行DMSO浓度对染色效果的促进实验就没有意义,本文在研究DMSO体积分数时仅选用了具有较厚细胞壁的绿藻——亚心形四爿藻。
在不同的DMSO的体积分数条件下对藻细胞进行染色,分别考察不同的DMSO浓度对藻细胞染色的荧光强度的影响,染料终质量浓度为0.25μg/mL,染色温度为35℃,染色30 min。每个体积分数下有8个重复,结果见图4。

图4 DMSO体积分数对染色效果的影响Fig.4 Effects of DMSO concentrations in BODIPY505/515 on fluorescence intensity
由图4可知:DMSO体积分数的增加,对扁藻的染色效果有所加强,随着DMSO浓度的增加,荧光强度也相应地增加,当DMSO的量从0.1%增加到2%时,相应的荧光强度从375增加到446,当DMSO体积分数增加到5%时,荧光强度更是增加到了474,比0.1%时增加了100。选择DMSO添加的最终体积分数为2%。
DMSO能够改变生物膜对电解质、药物和代谢产物的通透性,促进染料进入藻细胞[14]。Chen等[15]采用DMSO和微波辅助NR染色显著提高了采用普通的染色方法不易染色的普通小球藻(Chlorella vulgaris)、假绿球藻(Pseudochlorococcum sp.)、双形栅藻(Scenedesmus dimorphus)和若夫小球藻(Chlorella zofingiesis)的染色效果。
2.5 油脂含量与荧光强度的相关性
在以上优化的染色条件下,根据荧光强度与对应的油脂含量制定标准曲线,考察其线性相关性,结果见图5。

图5 油脂含量与荧光强度的相关性Fig.5 Correlation of lipid content and fluorescence intensity
由图5可知:在油脂含量11%~26%的范围内,油脂含量与荧光强度有较好的线性关系,R2=0.976 4,并得到油脂含量与荧光强度的回归方程y=0.035x+1.293 4(y为油脂含量,%;x为荧光强度),根据此标准曲线方程来计算微藻油脂含量。
在质量法中,正己烷由于其极性较弱,提取的主要是微藻的中性脂,如甘油三酯(TAG)、甘油二酯(DAG)、甘油一酯(MAG)和游离脂肪酸(FFA),而BODIPY荧光染料也主要是与中性脂组成的油滴结合才能在相应的波长下发荧光[16],因此用正己烷提取法测得的油脂含量与BODIPY荧光强度有较好的相关性。
2.6 荧光染料BODIPY505/515优化的染色方法在其他藻上的应用
对于不同的微藻,使用2.5中的回归方程,根据测得的荧光值计算得到油脂占干质量百分比,使用质量法获得的油脂含量进行比较,结果见图6。
由图6可知:除新月藻外,其余3株藻用荧光值计算的油脂含量与质量法测定的油脂含量没有显著差异(p>0.05)。因此,利用BODIPY荧光染料可以在较广的微藻范围(如硅藻、绿藻、金藻等多种藻类)内快速、准确测定油脂含量。同时,也可以应用于培养过程油脂代谢监控、藻种筛选等方面。
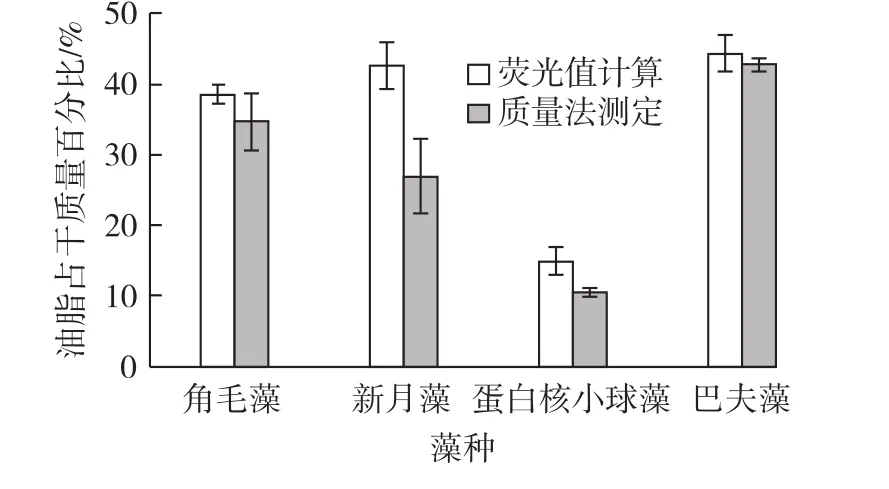
图6 使用荧光值计算油脂含量与质量法测定油脂含量比较Fig.6 Comparison of lipid contents in different algae species determ ined by fluorescencemethod and conventional gravimetric method(n=3)
3 结 论
探索了利用BODIPY505/515荧光染料,通过荧光分光光度法测定藻细胞中的油脂含量的方法,确定了最适的染色条件,即染料质量浓度为0.25 μg/mL,DMSO的体积分数为2%,在35℃下避光染色30 min。利用该方法可以较准确地测定不同种属的微藻细胞内中性脂的含量,且具有不与微藻自身荧光相互干扰、试样和荧光染料用量少、灵敏度高、操作简便、可定量动态观察细胞内油脂积累情况等优点,可应用于培养过程油脂代谢监控、藻种筛选等方面,将成为微藻油脂研究的有力工具。
[1] 蒋晓菲,周红茹,金青哲,等.微藻油脂提取技术的研究进展[J].中国油脂,2012,37(10):62⁃66.
[2] Amaro H M,Guedes A C,Malcata F X.Advances and perspectives in using microalgae to produce biodiesel[J].Appl Energy,2011,88(10):3402⁃3410.
[3] 杨忠华,李方芳,曹亚飞,等.微藻减排CO2制备生物柴油的研究进展[J].生物加工过程,2012,10(1):70⁃76.
[4] 梁英,石伟杰,田传远.微藻总脂含量测定方法概述[J].中国海洋大学学报:自然科学版,2012,42(5):35⁃40.
[5] 王金娜,严小军,周成旭,等.产油微藻的筛选及中性脂动态积累过程的检测[J].生物物理学报,2010,26(6):472⁃280.
[6] 张敬键,吕雪娟,李爱芬,等.微藻细胞油脂含量的快速检测方法[J].中国生物工程杂志,2012,32(1):64⁃72.
[7] 林义,钟添华,骆祝华,等.尼罗红染色法筛选产油酵母及定量检测细胞内油脂含量的研究[J].微生物学通报,2012,39(1):125⁃137.
[8] Haugland R P.Handbook of Fluorescent Probes and Reasearch Chemicals[M].6thed.Eugene:Molecular Probes Inc.,1996:13⁃19.
[9] Cooper M S,Hardin W R,Petersen TW,etal.Visualizing"green oil"in live algal cells[J].J Biosci Bioeng,2010,109(2):198⁃201.
[10] Pereira H,Barreira L,Mozes A,et al.Microplate⁃based high throughput screening procedure for the isolation of lipid⁃rich marinemicroalgae[J].Biotechnol Biofuels,2011,4(1):61.doi:10.1186/01754⁃6834⁃4⁃61.
[11] Ohsaki Y,Shinohara Y,Suzuki M,et al.A pitfall in using BODIPY dyes to label lipid droplets for fluorescencemicroscopy[J].Histochem Cell Biol,2010,133(4):477⁃480.
[12] 薛松.一种使用BODIPY类荧光染料测定微藻油脂含量的方法:中国,201210442558.6[P].2012⁃11⁃08.
[13] Chen W,Zhang C,Song L,et al.A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J].JMicrobiol Methods,2009,77(1):41⁃47.
[14] 王海英,符茹,黄宝祥.基于尼罗红荧光染色的小球藻脂质快速检测方法研究[J].中国油脂,2012,37(3):78⁃81.
[15] Chen W,Sommerfeld M,Hu Q.Microwave⁃assisted Nile red method for in vivo quantification of neutral lipids in microalgae[J].JMicrobiol Methods,2011,102(1):135⁃141.
[16] Elle IC,Olsen L C,Pultz D,et al.Something worth dyeing for:molecular tools for the dissection of lipid metabolism in Caenorhabditis elegans[J].FEBS Lett,2010,584(11):2183⁃2193.
Rapid method for lipid content quantifiction ofm icroalgae based on BODIPY fluorescence
LIU Yanan1,YAO Changhong1,2,ZHOU Jiannan1,MENG Yingying3,WANG Haitao1,2,CAO Xupeng1,XUE Song1
(1.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China)
A method formicroalgae oil contentmeasurement based on fluorescent dye BODIPY505/515 is introduced.The optimum dyeing conditions for BODIPY505/515 were:BODIPY505/515 final concentration 0.25 g/mL with 2%DMSO,and dyeing at35℃for 30 min.Under optimal conditions,the correlation between oil content and fluorescence was built with R2=0.976 4.Samples of four different species ofmicroalgae were tested by using the above optimal conditions,gravimetricmethod and Nile red fluorescence dye method.Compared with the gravimetric method,the advantages of the method were universal,simple,less sample required.Compared with the Nile red fluorescence dyes,BODIPY505/515 had narrow emission spectrum without the microalgal autofluorescence interference,more suitable foroleaginous algal strain screening and processmonitoring.
BODIPY;fluorescent;lipid;microalgae
Q949
A
1672-3678(2013)06-0068-05
10.3969/j.issn.1672-3678.2013.06.014
2013-01-31
国家重点基础研究发展计划(973计划)(2011CB200903);国家高技术研究发展计划(863计划)(2012AA052101);中国科学院百人计划(A1097);辽宁省自然科学基金(2012010263);中国科学院大连化学物理研究所知识创新项目(K2010A3);中国科学院知识创新工程领域前沿项目——大连化学物理研究所科研基金——青年基金
刘亚男(1982—),女,黑龙江双鸭山人,硕士,助理研究员,研究方向:微藻生物能源;薛 松(联系人),研究员,E⁃mail:xuesong@dicp.ac.cn
