慢性肾脏病3、4期患者脂代谢紊乱相关因素分析
2013-07-05朱昭章吴春霞
龙 凯,朱昭章,卢 岚,吴春霞
(桂林市人民医院,广西桂林541002)
慢性肾脏病(CKD)已成为我国常见病、多发病,其病因复杂,脂质代谢紊乱不但是CKD心血管合并症的一个独立危险因素,还能加快CKD病情的进展[1,2]。因此,脂质代谢紊乱是CKD预后不良的重要指标。2009年6月~2011年6月,我们观察了CKD 3、4期患者脂代谢水平,并分析其相关危险因素。现报告如下。
1 资料与方法
1.1 临床资料 选择桂林市人民医院首次住院的CKD患者126例(CKD组),诊断符合肾脏透析预后质量K/DOQI指南[3],排除肾脏病综合征、糖尿病肾病、已接受降脂药物或透析治疗者。其中男66例、女60例,年龄(58.4±15.6)岁;采用中国修订的MDRD公式计算估计肾小球率过滤(eGFR),CKD 3期(eGFR 30~59 mL/min)72例,CKD 4期(eGFR 15~29 mL/min)54例;原发疾病包括慢性肾炎62例,高血压肾病28例,慢性梗阻性肾病13例,其他23例(慢性间质性肾炎5例、慢性肾盂肾炎3例、痛风性肾病6例、狼疮性肾炎6例、多囊肾3例)。选取同期健康体检者100例作为对照组,其中男51例、女49例,年龄(58.0±15.2)岁。两组性别、年龄比较无统计学意义(P均>0.05)。
1.2 方法
1.2.1 资料收集 记录2组的性别比(F∶M,F为女性,M 为男性)、年龄(Age)、收缩压(SBP)、舒张压(DBP)、BMI。
1.2.2 指标检测 入院第2天抽取空腹静脉血,分离血清。采用日立7170A自动分析仪测定血脂(TC、TG、HDL、LDL)、肾功能(Scr、BUN、UA)、空腹血糖(FPG)、血清白蛋白(A)、血清白蛋白与球蛋白比值(A/G)、C反应蛋白(CRP)。采用免疫比浊法检测D-二聚体(DD),放射免疫法检测内皮素(ET)。留取晨尿,采用免疫比浊法检测尿白蛋白,碱性苦味酸法检测尿肌酐,并计算eGFR、尿白蛋白/肌酐比值(ACR)。高脂血症或脂代谢紊乱满足以下1项即可确诊[4]:TG≥1.7 mmol/L、TC≥5.2 mmol/L、LDL-C≥3.12 mmol/L、HDL-C≤1.04 mmol/L。
1.2.3 统计学方法 采用SPSS13.0统计软件。计量资料以¯x±s表示,组间比较采用t检验、单因素方差分析,多重比较采用LSD法;研究影响因素时,采用多因素Logistic回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 两组血脂相关指标比较 见表1。
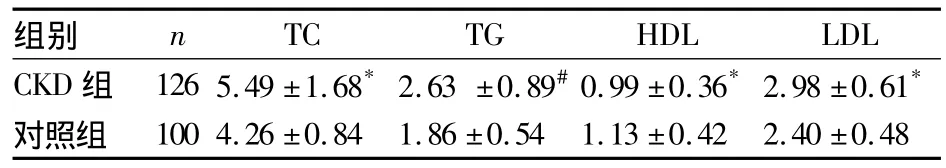
表1 两组血脂相关指标比较(mmoL/L,¯x±s)
2.2 CKD组3期和4期血脂相关指标比较 见表2。

表2 CKD组3期、4期血脂相关指标比较(mmoL/L,¯x±s)
2.3 CKD组血脂与危险因素的相关性分析结果TC 与 A、UA、DD、CRP、ACR 均呈正相关(r=0.322、0.392、0.433、0.467、0.472),与 eGFR 呈负相关(r= -0.462),P 均 <0.05;TG 与 F∶M、Age、A、FPG、UA、DD、CRP、ACR 均呈正相关(r=0.320、0.343、0.374、0.397、0.421、0.443、0.467、0.489),与 eGFR呈负相关(r= -0.438),P 均 <0.05;HDL-C 与Age、A、UA 均呈正相关(r=0.348、0.392、0.403),与 eGFR、CRP 均呈负相关(r= -0.485、-0.488),P 均 <0.05;LDL与 A、UA、DD、ACR、CRP均呈正相关(r=0.329、0.392、0.397、0.407、0.428),与 eGFR呈负相关(r= -0.416),P 均 <0.05。
2.4 多因素 Logistic回归分析结果 eGFR、CRP(OR=1.521、2.133)为 TC升高的独立危险因素;ACR、A、eGFR、DD、CRP(OR=1.420、1.840、2.125、2.717、2.788)为 TG 升高的独立危险因素;Age、eGFR(OR=1.187、1.552)为 HDL 降低的独立危险因素;ACR、CRP(OR=1.915、2.414)为 LDL 升高的独立危险因素,P 均 <0.05。
3 讨论
全美胆固醇教育计划指南指出,CKD患者是脂代谢紊乱的高危人群,以高TG血症和 (或 )低HDL-C血症最为常见[5]。本研究发现,CKD组TC、TG、LDL均较对照组增高,HDL较对照组降低,与该指南和国内何莲等[6]的研究结论相似。相关性分析表明,eGFR是TC和TG升高、HDL下降的危险因素,说明肾功能恶化可能导致了脂代谢紊乱;A、ACR与血脂指标均有相关性,与王伟铭等[7]的研究有相似之处。本研究剔除了表现为肾病综合征的患者,结果仍显示A为TG升高的独立危险因素,考虑为CKD患者由于营养不良,多数合并有低蛋白血症,在尿量未减少时尿蛋白的排泄可加重脂代谢紊乱。
Zebrack等[8]研究发现,CRP 在 GFR 30~60 mL/min组和<30 mL/min组较GFR>60 mL/min组明显升高,且随着GFR的降低而升高。李俊等[9]研究发现,透析组、非透析组、氮质血症组CRP水平均高于肾功能正常组,且随肾功能的恶化而升高,提示微炎症反应贯穿了CKD的全过程,且随着肾功能恶化,微炎症状态加重,这可能与微炎症反应导致了脂蛋白结构的异常有关。钟春梅等[10]报道,高脂血症组CRP水平显著高于血脂正常组,但各亚组间CRP水平无显著差异,提示高TC、高TG独立或联合与微炎症状态的发生有关。肾功能衰竭期高脂血症发生率高,脂代谢异常参与了微炎症的发生,可能为慢性肾功能不全患者微炎症状态的原因之一。本研究发现,CRP是TC、TG、LDL升高的危险因素,说明CKD病程中的微炎症反应和脂代谢紊乱可能互相影响。
DD是交联纤维蛋白经纤溶酶水解产生的一种特异性降解产物,是证实体内存在高凝和继发纤溶的特异指标。本研究单因素分析示,DD与TC、TG、LDL均有相关性,与刘志军等[11]的研究类似,提示CKD脂代谢紊乱与DD相关。Logistic分析示,DD是TG升高的独立危险因素,说明DD与TG关系更为密切,这可能与高脂血症导致内皮细胞损伤,继而微血栓形成,继发性纤溶亢进有关。此外,CKD患者普遍存在微炎症状态,炎症可通过抑制内源性纤溶系统促进血栓形成,又可导致内皮细胞受损、内皮功能紊乱引起血管痉挛,诱发血液淤滞使血管内纤维蛋白原转为纤维蛋白,进一步促进血栓形成。
ET是主要由血管内皮产生的一组内皮源性血管收缩因子,具有强大的收缩肾脏血管的作用,与CKD的发生、发展紧密联系[12~14]。ET主要与氧化低密度脂蛋白(ox-LDL)相关性较大[15],而本研究中LDL多正常,因此未发现血脂指标与ET的相关性。
研究显示,TC、TG、HDL、LDL 还与 Age、女性、UA、FPG等传统危险因素相关,提示传统的危险因素在CKD患者中仍然存在[16]。总之,CKD患者合并高脂血症者明显多于普通人群,影响血脂的多数因素同样存在于CKD患者中,而CKD的肾功能水平及炎症因素等也影响着血脂。血脂紊乱能加速慢性肾脏病本身的进展,而肾功能恶化又会加重血脂紊乱,后者进一步加重肾脏损伤。因此在肾脏病的治疗过程中,要注意控制血脂的紊乱,防止或延缓肾脏疾病的进展。
[1]Abrass CK.Cellular lipid metabolism and the role of lipids in progressive renal disease[J].Am JNephrol,2004,24(1):46-53.
[2]Trevisan R,Dodesini AR,Lepore G.Lipids and renal disease[J].Jam Soc Nephrol,2006,17(4 Suppl 2):145-147.
[3]美国NKF-K/DOQI工作组.慢性肾脏病及透析临床实践指南[M].北京:人民卫生出版社,2002:4-75.
[4]叶任高,陆再英.内科学[M].6版.北京:人民卫生出版社,2005:821-831.
[5] Expert Panel on Detection,Evaluation,and Treatment of High Blood Cholesterol in Adults.Executive Summary of The Third Report of The National Cholesterol Education Program(NCEP)Expert Panel on Detection,Evaluation,And Treatment of High Blood Cholesterol In Adults(Adult Treatment PanelⅢ)[J].JAMA,2001,285(19):2486-2497.
[6]何莲,陈邵燕,唐雯,等.慢性肾脏病与高脂血症关系的研究[J].中国实用内科杂志,2008,28(5):355-357.
[7]王伟铭,陈楠,王朝晖.肾脏疾病中的脂质异常及其危险因素分析[J].上海第二医科大学学报,2005,25(6):588-591.
[8]ZebraekJS,AndersonJL,BeddhuS,et al.Do assoeiations with C-reaetive protein and extent of cronary artery diseasea account for the increased cardiovacular risk of renal insufficiency[J].J Am Coll Cardiol,2003,42(1):57-63.
[9]李俊,白云凯.慢性肾脏疾病患者脂蛋白(a)水平及与微炎症状态相关性研究[J].昆明医学院学报,2007(S1):48-51.
[10]钟春梅,陈明.慢性肾衰竭肾功能衰竭期患者微炎症状态与血脂关系的探讨[J].沪州医学院学报,2005,28(4):354-355.
[11]刘志军,赵淑清,任新明.冠心病患者D-二聚体的变化及其与血脂异常的相关研究[J].心血管康复医学杂志,2002,11(3):321-324.
[12]Dhaun N,Goddard J,Webb DJ.The endothelin system and its antagonism in chronic kidney disease[J].JAm Soc Nephrol,2006,17(4):943-955.
[13]Lehrke I,Waldherr R,Ritz E,et al.Renal endothelin-1 and endothelin receptor type B expression in glomerular diseases with proteinuria[J].J Am Soc Nephrol,2001,12(11):2321-2329.
[14]Goddard J,Johnston NR,Cumming AD,et al.Fractional urinary excretion of endothelin-1 is reduced by acute ETB receptor blockade[J].Am JPhysiol Renal Physiol,2007,293(5):1433-1438.
[15]王玉芳.同型半胱氨酸致动脉粥样硬化的机制[J].中国动脉硬化杂志,1998,6(3):259-263.
[16]赵冬.中国人群的血脂流行病学研究[J].临床荟萃,2006,21(8):533-538.
