密码子优化的鸭坦布苏病毒E基因在昆虫细胞中的表达
2013-07-04肖亚莉刘建龙李雪松余磊滕巧泱闫丽萍李国新李泽君
肖亚莉,刘建龙,李雪松,余磊,滕巧泱,闫丽萍,李国新,李泽君
(中国农业科学院上海兽医研究所,上海,200241)
鸭坦布苏病毒病是由鸭坦布苏病毒(Duck tembusu virus, DTMUV)引起的一种传染病,该病于2010年春季首先在我国的上海市、浙江省、江苏省等地发生,继而传播到全国大多数养鸭地区[1,2]。病鸭主要表现为高热、运动障碍、食欲下降甚至废绝,产蛋鸭产蛋下降甚至停止,严重可导致死亡,死亡率可达5%~10%[1,2]。该病传播迅速、传播范围广,给我国养鸭产业造成了巨大的经济损失。目前,还没有商品化的疫苗来预防鸭坦布苏病毒病。
DTMUV属于黄病毒科(Flaviviridae),黄病毒属(flavivirus),恩塔亚病毒群[1,2]。黄病毒的E蛋白包含许多与宿主嗜性、宿主细胞膜融合及宿主细胞表面受体结合相关的抗原位点[3-5]。对该蛋白结构与功能的研究对于理解该病毒的宿主适应性、病毒的致病机制、亚单位疫苗的研发以及血清学诊断方法的建立等具有重要意义。
不同物种细胞在蛋白翻译过程中与病毒基因所编码的蛋白氨基酸密码子的使用频率之间存在差异,研究表明密码子优化能显著提高蛋白的表达水平[6]。本研究将DTMUV病毒E基因按照昆虫细胞偏嗜性密码子进行了优化,利用杆状病毒-昆虫细胞表达系统,构建了含有DTMUVE基因的重组杆状病毒,在昆虫细胞中表达了E蛋白,为进一步研究鸭坦布苏病毒E蛋白的相关功能奠定了基础。
1 材料和方法
1.1 材料
1.1.1 毒株、细胞与菌株E.coliDH5α 感受态细胞由本实验室制备;E.coliDH10BAC感受态细胞购自美国Invitrogen公司;草地贪夜蛾卵巢细胞Sf9(spodoptera frugiperda)由上海兽医研究所禽病实验室保存。
1.1.2 载体与质粒 pFastBacHT 载体购自 Invitrogen公司。
1.1.3 主要试剂 限制性内切酶、T4 DNA Polymerase、T4 DNA ligase、LATaq、dNTP 购自 TaKaRa宝生物工程(大连)公司;质粒提取试剂盒购自QIAGEN公司;柱式胶回收试剂盒购自上海华舜公司;SF-900Ⅱ昆虫细胞培养基、Grace's 培养基、转染试剂Cellfectin Reagent 购自 Invitrogen 公司;胎牛血清购自 Gibco;SuperSignal West Pico 化学发光底物购自Pierce公司。
1.1.4 检测试验所用抗体 具有中和活性的抗DTMUV E蛋白的单克隆抗体和抗DTMUV的鸭阳性血清由上海兽医研究所禽病实验室制备并保存[7];抗His单克隆抗体、辣根过氧化物酶标记的羊抗鼠IgG和荧光素(FITC)标记的羊抗鼠IgG购自北京中杉金桥公司;辣根过氧化物酶标记的羊抗鸭IgG购自KPL公司。
1.2 方法
1.2.1 DTMUVE基因的优化与合成 将DTMUV的E基因全部的密码子按照昆虫细胞所偏嗜的密码子进行优化,并将该基因两端引入BamH I和Hind III两个酶切位点。优化后的基因由上海英骏生物技术有限公司合成,命名为optiE。
1.2.2 含有目的基因的重组供体质粒的构建与鉴定 将含有优化基因optiE的质粒用限制性内切酶BamH I和Hind III进行消化,与经相同酶消化的pFastBacHT载体连接,转化DH5α感受态细胞,挑取单克隆,提取的质粒用BamH I和Hind III进行双酶切鉴定。将筛选到的阳性质粒进行测序验证序列的正确性,阳性质粒命名为pFastBac-optiE。
1.2.3 含有目的基因的重组杆粒的构建与鉴定 将供体质粒pFastBac-optiE转化到含有Bacmid和helper质粒的大肠杆菌DH10Bac感受态细胞中,经抗性和蓝白斑筛选,挑取白色单个克隆,再次划线于新鲜LB平板,37℃过夜培养后,挑取白色单个克隆,扩大培养后,提取DNA,命名为rBacmid-optiE,使用优化的E基因的特异性引物(上游引物F:5'-CTCGGATCCTGTTCAGCTG-3';下游引物R:5'-AGCAAGCTTTTACACGTTCA-3') 进 行 PCR 鉴定,退火温度为55℃,延伸2 min,同时使用M13引物进行PCR鉴定。
1.2.4 重组杆状病毒的获得 按照Invitrogen公司Bacto-Bac Baculovirus Expression System 技术手册使用Cellfectin reagent将rBacmid-optiE转染对数生长期的 Sf9昆虫细胞,27℃培养 4~5 d,直到 70%~80%的细胞出现病变后,收获培养上清和细胞,300×g离心 15 min,上清即为原代毒种 ( P1 代 ) ,4℃避光保存备用。将 P1 代毒种在Sf 9昆虫细胞上扩大培养1次后即为 P2 代毒种,滴定病毒滴度,并将病毒分装后,保存于4℃或-80℃备用。
1.2.5 重组杆状病毒滴度的测定 将培养的Sf9细胞进行细胞计数,铺于六孔细胞培养板,每孔106个细胞,27℃孵育1 h,弃去培养液。将P2代重组杆状病毒用新鲜的SF-900 ⅡSFM 培养液进行10倍比稀释后,接种于处理过的六孔细胞培养板,于27℃孵育1 h,弃去培养液,加入2 mL含有1%低熔点琼脂的SF-900(1.3×)的斑点培养基覆盖Sf9细胞,室温放置20 min,凝固后移入培养箱,7 d 后用 1 mg/mL 的中性红溶液覆盖,室温孵育2 h,移去多余液体,观察蚀斑,计算病毒滴度。
1.2.6 间接免疫荧光鉴定目的蛋白的表达 将Sf9细胞铺于六孔细胞板,待细胞生长至对数生长期时,将获得P2代重组杆状病毒接种于细胞,27℃培养48 h,用预冷的PBS(PH=7.4)洗涤3次,然后用4℃预冷的丙酮-甲醛(1:1)固定液于-20℃固定5 min,PBS洗涤3次,自然干燥;加入1000倍稀释的抗DTMUV E 蛋白的单克隆抗体,37℃作用 1 h;用PBS洗涤3次后,加入100倍稀释的FITC标记的羊抗鼠二抗,37℃作用1 h;用PBS洗涤5次,自然干燥;荧光显微镜下观察结果,同时用未感染的Sf9昆虫细胞作为阴性对照。
1.2.7 Western blot 鉴定目的蛋白的表达 在Sf9昆虫细胞生长至80%~90%时,接种P2代重组杆状病毒,27℃ 培养 72 h 后收获细胞,离心去上清。将收获的样品用样品缓冲液重悬后,煮沸5 min, 用12%SDS-PAGE电泳后,转印硝酸纤维素膜,用5%的脱脂乳室温封闭2 h。然后,相同样品分三组,第1组加入1000倍稀释的抗His标签的单克隆抗体,第2组加入1000倍稀释的抗DTMUV E蛋白的单克隆抗体,第3组加入400倍稀释的抗DTMUV的鸭阳性血清,室温孵育2 h。用TBST洗涤3次,分别加入5000倍稀释的羊抗鼠IgG和1000倍稀释的羊抗鸭IgG,室温孵育1h,用TBST洗涤3次,用化学发光底物进行曝光显色。
2 结果
2.1 重组质粒pFastBac-optiE的鉴定获得的重组质粒pFastBac-optiE用BamH I和Hind III进行消化后,得到与预期大小相符的片段(图1)。测序结果也表明,该质粒中含有的目的基因片段与优化后的序列完全一致,上述结果表明,本研究所构建的载体是正确的,可用于随后的试验。
2.2 重组质粒rBacmid-optiE的鉴定以提取的重组质粒DNA为模板,用优化的E基因的特异性引物和M13引物分别进行PCR。结果显示,以优化的E基因的特异性引物进行扩增时,在1000~2000 bp之间有一条特异性的条带,以M13引物进行扩增时,在2500~5000 bp之间有一条特异性的条带,都与预期结果一致(图2)。
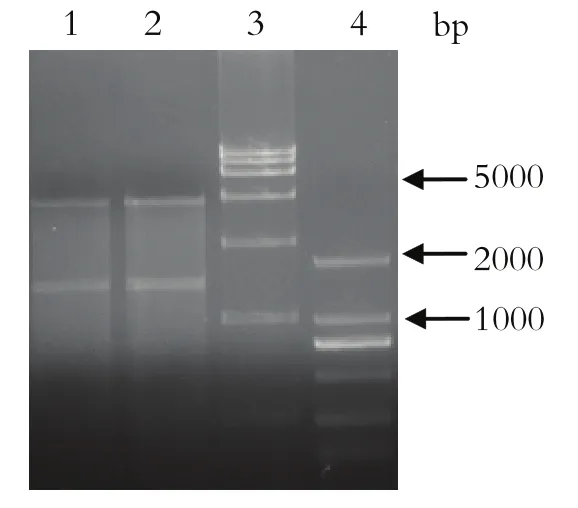
图1 pFastBac-optiE质粒的酶切鉴定Fig.1 Restrictive endonucleas analysis of pFastBac-optiE
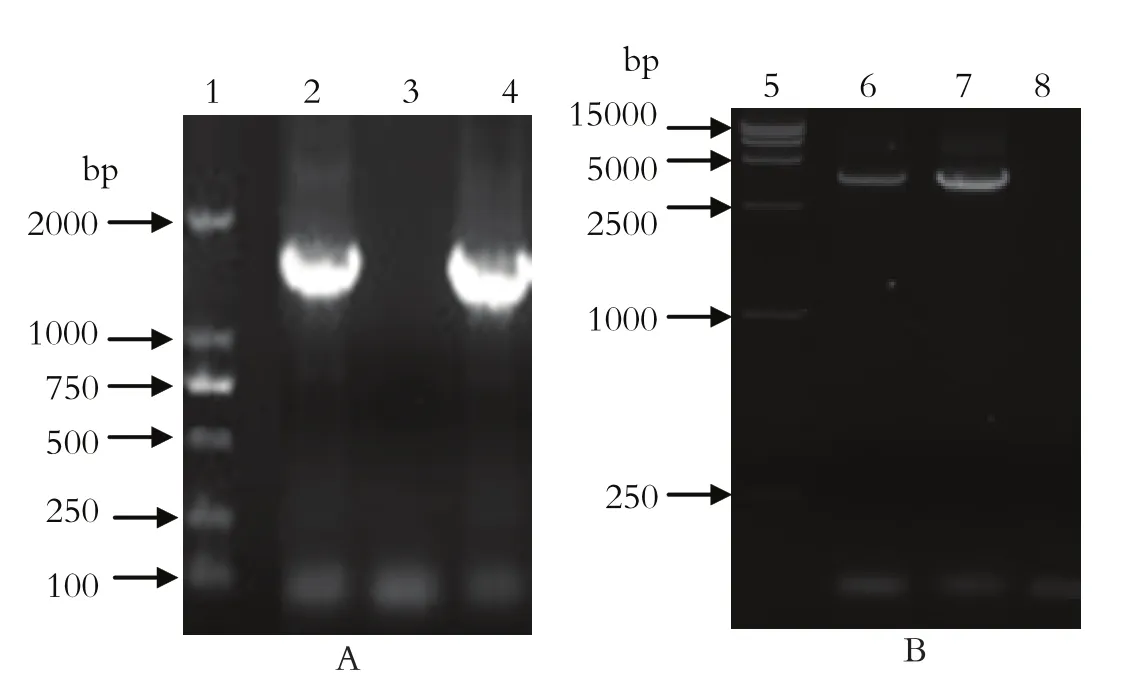
图2 重组质粒rBacmid-optiE的PCR鉴定Fig.2 PCR analysis of rBacmid-optiE
2.3 间接免疫荧光检测目的蛋白的表达将获得的P2代重组杆状病毒感染Sf9细胞,用抗DTMUV E蛋白的单克隆抗体进行间接免疫荧光检测,结果显示,P2代病毒感染细胞呈现比较强的荧光,而未感染病毒的细胞没有荧光信号,表明DTMUVE基因编码蛋白在Sf9细胞中得到了表达(图3)。
图3 间接免疫荧光试验检测目的蛋白的表达Fig.3 Identifi cation of E protein expression in Sf9 cells by indirect immunofl uorescence assay
2.4 Western blot检测目的蛋白的表达将重组杆状病毒感染昆虫细胞,感染后72 h收集细胞,分别用抗His标签的单克隆抗体、抗DTMUV E蛋白的单克隆抗体和抗DTMUV的鸭阳性血清进行Western blot分析。结果显示,在55~70 kDa之间,3种抗体都检测到了特异性条带,与预期的大小基本一致(图4),而正常细胞对照组,3种抗体都检测不到此特异性条带(结果未显示),上述结果表明,鸭坦布苏病毒E蛋白在昆虫细胞中得到了表达。
图4 Western blot检测重组蛋白在昆虫细胞中的表达Fig.4 Western blot analysis of E protein in insect cells
3 讨论
杆状病毒-昆虫细胞表达系统是一种高效的真核表达系统,对所表达的基因能够进行蛋白质的翻译后加工,其表达产物的生物学活性与天然蛋白十分接近,因此,该系统被广泛用于多种功能蛋白的表达[8]。密码子对于宿主具有偏嗜性,不同宿主密码子的使用频率不同,经常会影响异源基因在该宿主中的表达[6]。本研究在不改变鸭坦布苏病毒E蛋白氨基酸序列的基础上对E基因的密码子进行了优化,使其能在昆虫细胞中更为高效的表达。本研究中,间接免疫荧光试验和Western blot试验均证实E蛋白在昆虫细胞中得到了表达。本研究没有设未优化密码子的E基因的对照,尚不能证实密码子优化提高了E蛋白的表达量,但既然目的蛋白已经得到了表达,这个问题并不显得那么重要。
2010年以来,鸭坦布苏病毒病给我国养鸭产业造成了巨大的经济损失。目前,尚无有效的措施来控制鸭坦布苏病毒病的发生,预防该病的活疫苗和灭活疫苗正在研制中。对于鸭坦布苏病毒病的诊断,已经建立了几种有效的检测鸭坦布苏病毒核酸的检测方法,如PCR方法[9]、荧光定量PCR方法[10]和RT-LAMP方法[11]等。另外,几种检测鸭坦布苏病毒病的血清学方法,如全病毒间接ELISA[12]和利用单克隆抗体建立的阻断ELISA等也被建立[7]。本研究利用杆状病毒-昆虫细胞系统表达了鸭坦布苏病毒E蛋白,为进一步研究E蛋白的结构与功能奠定了基础,也为建立鸭坦布苏病毒病血清学诊断方法提供了很好的物质材料。
[1]滕巧泱, 颜丕熙, 张旭, 等.一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报, 2010, 18(6):1-4.
[2]Yan P, Zhao Y, Zhang X,et al.An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China [J].Virology, 2011, 417(1): 1-8.
[3]Modis Y, Ogata S, Clements D, Harrison SC.Structure of the dengue virus envelope protein after membrane fusion[J].Nature, 2004, 427(6972): 313-319.
[4]Rey F A.Dengue virus envelope glycoprotein structure:new insight into its interactions during viral entry [J].Proc Natl Acad Sci USA, 2003, 100(12): 6899-6901.
[5]Rey F A, Heinz F X, Mandl C,et al.The envelope glycoprotein from tick-borne encephalitis virus at 2 A resolution[J].Nature,1995, 375(6529): 291-298.
[6]Gustafsson C, Govindarajan S, Minshull J.Codon bias and heterologous protein expression[J].Trends Biotechnol, 2004, 22(7): 346-353.
[7]Li X, Li G, Teng Q,et al.Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck Tembusu virus[J].PLoS One, 2012, 7(12): e53026.
[8]高炳淼, 李宝珠, 于津鹏, 等.外源基因在昆虫杆状病毒表达系统中的表达[J].中国生物工程杂志, 2011, 31(11):123-129.
[9]颜丕熙, 李国新, 吴晓刚, 等.应用套式RT-PCR快速检测鸭坦布苏病毒[J].中国动物传染病学报, 2011,19(3): 34-37.
[10]Yan L, Yan P, Zhou J,et al.Establishing a TaqMan-Based Real-Time PCR Assay for the rapid detection and quantification of the newly emerged duck tembusu virus[J].Virol J, 2011, 8: 464.
[11]Yan L, Peng S, Yan P,et al.Comparison of realtime reverse transcription loop-mediated isothermal amplification and real-time reverse transcription polymerase chain reaction for Duck tembusu virus [J].J Virol Methods, 2012, 182(1-2): 50-55.
[12]姬希文, 闫丽萍, 颜丕熙, 等.鸭坦布苏病毒抗体间接ELISA检测方法的建立[J].中国预防兽医学报, 2011, 8:630-634.
