靛玉红甲肟对肝癌HepG2细胞周期和凋亡的影响
2013-07-02陈雅婷谭宇蕙吴映雅丘鹏翔杜标炎赵
陈雅婷谭宇蕙* 吴映雅丘鹏翔杜标炎赵 青
(1 广州中医药大学生物化学教研室,广东 广州 510006;2 广州中医药大学病理学教研室,广东 广州 510006)
靛玉红甲肟对肝癌HepG2细胞周期和凋亡的影响
陈雅婷1谭宇蕙1* 吴映雅1丘鹏翔1杜标炎2赵 青1
(1 广州中医药大学生物化学教研室,广东 广州 510006;2 广州中医药大学病理学教研室,广东 广州 510006)
目的 探讨靛玉红甲肟对肝癌HepG2细胞增值和凋亡的影响。方法 分别用0、10、20、40µmol/L靛玉红甲肟作用于HepG2细胞24、48、72h,采用MTT法检测细胞抑制率;用0、10、20、40µmol/L靛玉红甲肟作用于HepG2细胞24h后收集样品,采用流式细胞术法检测细胞周期及其凋亡率。结果 MTT法测定靛玉红甲肟对肝癌HepG2细胞的增殖具有抑制作用,且表现出剂量和时间的依赖性,随着浓度升高时间加长,抑制明显(P<0.01)。流式细胞术测定也表明靛玉红甲肟对肝癌HepG2细胞有诱导凋亡的作用,凋亡随着靛玉红甲肟浓度的增大不断地增加。细胞形态学方面也可观察出细胞随着靛玉红甲肟剂量和时间的增大而逐渐出现越来越多的凋亡,细胞核染色质深染,聚集于核膜下呈新月形,细胞膜突起呈小泡样,小泡脱落形成含核小体片段的凋亡小体。结论 靛玉红甲肟确实可以诱导HepG2细胞凋亡,但靛玉红甲肟对肝癌细胞作用机制还不明确,需要作进一步的深入研究。
靛玉红甲肟;HepG2;增值和凋亡
根据最新统计,全世界每年新发肝癌患者约六十万,居恶性肿瘤的第五位。HepG2细胞,来源于人的肝癌组织。该细胞乙肝表面抗原阴性,对G418有抗性,对人生长激素有刺激反应。靛玉红多年前就被中国医科科学院文献报道动物和临床均具有治疗慢性中幼粒细胞白血病的作用[1]。靛玉红甲肟是靛玉红衍生物之一,也被报道可抑制体外多种肿瘤细胞增殖[2]。本文主要观察靛玉红甲肟对肝癌HepG2细胞增值和凋亡是否也存在一定的影响。
1 材料与方法
1.1 试剂、药品和材料
RPMI1640(Gibco公司),小牛血清(PAA公司),PBS(SOJUBIO公司),靛玉红甲肟(Sigma公司),MTT(Sigma公司),DMSO(Sigma公司),HepG2细胞(广州中医药大学生化病理教研室)
1.2 方法
1.2.1 细胞培养
HepG2细胞用含体积分数10%小牛血清的RPMI1640培养液(含青霉素、链霉素各100u/mL),在37℃、体积分数5%CO2及饱和湿度条件下培养,取对数生长期细胞用于实验。
1.2.2 药品配制
靛玉红甲肟(IRO)分别配制成10,20,40µmol/L备用。
1.2.3 MTT法测定细胞抑制率
用2.5g/L的胰酶消化收集HepG2细胞,计数并重悬于含积分数10%小牛血清的RPMI1640培养液,调整细胞浓度为3×104个/mL,按100µL/孔细胞悬液接种于96孔培养板。置37℃、体积分数5% CO2及饱和湿度条件下培养箱培养24h,细胞贴壁后弃去上清,分别加入含靛玉红甲肟10,20,40µmol/L的药液继续培养,同时设置对应的空白对照孔以及正常对照孔,每组设置4个复孔。分别培养24、48、72h后,吸走药液,加入不含小牛血清的RPMI1640培养液100µL,再每孔加入10µL MTT溶液(5mg/mL)继续放进培养箱培养4h。用注射器小心吸走上清,留下蓝紫色结晶,加入DMSO 150µL/孔震荡均匀,在自动酶标仪上以490nm波长测定每孔吸光度值,计算细胞抑制率。抑制率=[1-(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)]×100%
1.2.4 流式细胞仪检测细胞周期和凋亡
用2.5g/L的胰酶消化收集HepG2细胞,计数并重悬于含积分数10%小牛血清的RPMI1640培养液,按2×106个/孔接种于6孔培养板,置37℃、体积分数5% CO2及饱和湿度条件下培养箱培养24h,细胞贴壁后弃去上清,分别加入含靛玉红甲肟10,20,40µmol/L的药液继续培养,同时设置对应的空白对照孔以及正常对照孔,每组设置1个复孔。培养24h候,吸走药液,用2.5g/L的胰酶消化收集每孔细胞,吹打制备单细胞悬液,移入新的5mL离心管中,4℃,1000g,离心5min,取出弃去上清,用4℃PBS洗涤细胞3次,再离心弃去PBS,加入4℃、75%乙醇放4℃冰箱固定细胞过夜。上流式细胞仪PI单染检测细胞周期及其凋亡。
1.2.5 细胞形态观察
分别用DAPI和PI染色剂(含破壁渗透剂)对经靛玉红甲肟10,20,40µmol/L处理过24,48,72h的细胞进行染色,荧光显微镜下观察细胞形态。
1.3 统计学分析
2 结 果
2.1 靛玉红甲肟对HepG2细胞增值抑制作用
MTT结果如表1和图1所示,其中可以看出,随着靛玉红甲肟浓度的增大和作用时间的延长,HepG2细胞的抑制率也逐渐增加,呈剂量和时间依赖性。

表1 各组HepG2 MTT测定结果的细胞抑制率(n=4)
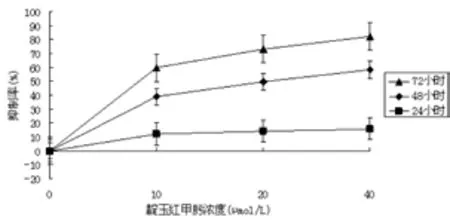
图1 靛玉红甲肟对HepG2细胞增值的影响
2.2 流式细胞仪分析细胞凋亡率
HepG2细胞经0、10、20、40µmol/L浓度的靛玉红甲肟作用24h后,G0/G1期细胞比例逐渐下降,S期细胞无明显变化,G2/M期细胞比例逐渐上升。凋亡率不断上升,分别为2.71%,12.36%,19.43%,29.53%。见表2和图2。

表2 各组HepG2 流式细胞术24h测定结果的细胞抑制率(n=2)

图2
2.3 细胞形态变化
正常情况下,HepG2细胞贴壁生长细胞饱满均匀,而在靛玉红甲肟的作用下,贴壁细胞不断减少,细胞核染色质深染,聚集于核膜下呈新月形,细胞膜突起呈小泡样,小泡脱落形成含核小体片段的凋亡小体。如图3所示。

图3 HepG2细胞经靛玉红甲肟各浓度作用48h后DAPI和PI染色形态图
3 讨 论
中国的中医多年前就已经使用当归芦荟丸来治疗慢性粒细胞白血病,而其中青黛中含有的靛玉红成分被证明是起主要治疗作用的成分。多年来,人们对靛玉红进了各方面的研究,但因其水溶性与脂溶性均不良好,且出现胃肠道不良反应较多,因此研究者对其进行结构的改造,发现靛玉红甲肟就是一种水溶性较好易于吸收且不良反应较小的一种靛玉红的衍生物[3]。靛玉红甲肟经本实验也发现对肝癌HepG2细胞体外是存在着明显的抑制作用,而且呈现出时间和浓度的依赖性。有报道指出靛玉红甲肟是一种具有选择性的细胞周期蛋白依赖性激酶抑制剂(CDK抑制剂)[4]。细胞周期运行中有两个检查点,分别是G1/S期检查点和G2/M期检查点,细胞周期中细胞时间的发生和顺序都被检查点监控,以保证细胞的正常复制。当细胞DNA受损时,细胞周期就不能正常运行,被阻滞于检查点,而当损伤超过细胞的修复能力时,则会诱导细胞发生凋亡。有研究证明靛玉红甲肟具有诱导细胞凋亡的作用,主要是将细胞阻滞在G2/M期[5]。本实验流式细胞术观察到了靛玉红甲肟作用后HepG2细胞凋亡的影响:用药组的凋亡率高于对照组,呈浓度依赖性,表明靛玉红甲肟确实可以诱导HepG2细胞凋亡。其细胞周期G0/G1期细胞比例逐渐下降,S期细胞无明显变化,G2/M期细胞比例上升,对其G2/M期有一定阻滞作用。细胞凋亡首先是细胞收缩变圆,然后与邻近的细胞脱离。细胞的铁壁能力会逐渐减弱,胞浆会浓缩,质地致密的染色体会聚集,而后断裂成许多凋亡小体。本实验也可观察到经过靛玉红处理的HepG2细胞出现这种凋亡的过程。然而目前靛玉红甲肟对肝癌细胞作用机制还不明确,需要作进一步的深入研究。
[1] 中国医学科学院血液学研究所,分院附属医院,基础医学研究所.靛玉红治疗慢性粒细胞白血病的临床和实验研究[J].中华内科杂志,1979,18(2):83-88.
[2] Frank G.E,Perabo,Frossler C,et al.Indirubin-3’-monoxime,a CDK inhibitor induces growth inhibition and apoptosisindependent up-regulation of surviving in transitional cell cancer[J].Anticancer Res,2006,26(3A):2129-2136.
[3] Moon MJ,Lee SK,Lee JW,et al.Synthesis and structure activity relationships of novel indirubin derivatives as potent antiproliferative agents with CDK2 inhibitory activities[J].BioorgMe dChem,2006,14(1):237-246.
[4] Hoessel R,Leclerct S,Tang WC,et al.Indirubin,the active constituent of a Chinese antileukaemia medicine,inhibits cyclindepengdent kinases[J].Nature Cell Biology,1999,(1):60-67.
[5] Marko D,Schätzle S,Friedel A,et al.Inhibition of cyclindependent kinase 1 (CDK1) by indirubin derivatives in human tumor cells[J].Br J Cancer,2001,84(2),283-289.
Effect of Indirubin-3’-monoxime on Proliferation and Apoptosis of HepG2 cells
CHEN Ya-ting1, TAN Yu-hui1*, WU Ying-ya1, QIU Peng-xiang1, DU Biao-yao2, ZHAO Qing1
(Department of Biochemistry, Guangzhou University of Chinese Medicine, Guangzhou 510006; 2 Department of Pathology, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
Objective To discuss the effect of indirubin-3’-monoxime on proliferation and apoptosis of HepG2 cells. Method HepG2 cells were treated with 0, 10, 20, 40µmol/L indirubin-3’-monoxime for 24、48、72hours, then the apoptosis rate was measured by methabenzthiazuron (MTT) assay, also, it was measured by flow cytometry. Use the coloring agent DAPI and PI to dye the HepG2 cells which had been treated, then observe the cell morphology under the fluorescence microscope. Results Indirubin-3’-monoxime inhibited growth of HepG2 cells in a dose-dependent and time-dependent. The apoptosis rate increased after the treatment by indurubin-3’-monoxime at 24 hours, this apoptosis are differences between different dose group. In cell morphology, we can observe that more and more cells apoptosis along with the increasing of a dose and time of indurubin-3’-monoxime.Chromatin of cell nucleus concentrating and anachromasis, gathering in nuclear membranes as crescent-shaped. Cell membranes raised as bubble. The bubble will fall off and formed apoptotic body which contain fragment of nucleosome. Conclusion Indirubin oxime can indeed induce apoptosis in HepG2 cells, but Indirubin oxime on hepatoma cell mechanism is not clear, the need for further in-depth study.
Indurubin-3’-monoxime; HepG2; Proliferation and apoptosis
R735.7
B
1671-8194(2013)22-0003-02
国家自然科学基金面上项目(编号:30973811)
*通讯作者:E-mail: tyhui@gzhtcm.edu.cn
