不同剂量活性维生素D对大鼠细胞自噬的影响
2013-07-01冷婧邱龄*
冷 婧 邱 龄*
(山西医科大学第二临床医学院心内科,太原 030001)
不同剂量活性维生素D对大鼠细胞自噬的影响
冷 婧 邱 龄*
(山西医科大学第二临床医学院心内科,太原 030001)
目的 探讨在生理状况下不同剂量活性维生素D3(VD3)干预下老年大鼠是否发生细胞自噬,以及发生自噬的情况。方法 18月龄SD大鼠32只按体质量随机分为4组:A组:对照组;B组:低剂量活性VD3组[(0.01μg/kg)/d];C组:中剂量活性VD3组[(0.1μg/kg)/d];D组:高剂量活性VD3组[(0.4μg/kg)/d]。经过5个月灌胃不同剂量活性VD3干预后处死,取1mm3肝脏组织4℃保存,取其余肝组织,生理盐水冲洗,锡纸包裹-80℃保存。透射电镜观察大鼠肝脏细胞自噬情况。通过western-blot的方法测定自噬小体标志物LC3对细胞的自噬活性进行半定量分析。结果 在生理状况下不同剂量活性维生素D的干预导致大鼠细胞自噬泡与胞浆的比值:A、B、C、D四组大鼠自噬泡与胞浆比值之间差异有统计学意义(P<0.05)。两两比较结果,A组与B、C、D组差异都有统计学意义(P<0.05),B组和C组之间差异没有统计学意义(P>0.05),B组和C组都与D组差异有统计学意义(P<0.05)。LC3II/LC3I结果与大鼠细胞自噬泡与胞浆的比值相同。结论 在生理状况下长期大剂量给予不同剂量活性维生素D可对老年大鼠细胞自噬产生不同影响。
细胞自噬;活性维生素D;LC3
自噬是一种在进化上高度保守的溶酶体自我消化的过程,对细胞内动态平衡,分化和存活有着至关重要的意义。作为一种适应性反应,研究人员发现,适度的激活细胞自体吞噬能够净化自身衰老或者受损的蛋白质和细胞器从而达到延缓衰老的功效,还能够控制和治疗与衰老有关的慢性疾病如心脑血管疾病、糖尿病和癌症等[3],如何通过激活细胞自噬而达到抗衰老,预防疾病,延长寿命的目的已经成为了国内外研究者的热门课题。
维生素D是一种脂溶性、活性、激素样维生素,1,25(OH)2VD3是它的活性形式。在最近的二十年来随着分子生物学,细胞生物学的不断进步,研究人员发现维生素D在人体的不同细胞调控着不同基因的表达控制他们的增殖、分化和存活[4-8]。近几年来,VD3由于其在抵抗衰老和影响基因表达方面的作用而被人们从新认知。他们认为细胞自噬在维生素D的影响下对健康发挥着更加重要的作用[3]。在关于癌症和结核分离杆菌感染的治疗的研究中表明大剂量的活性维生素D可以引起细胞内自噬溶酶体发生作用,从而引起细胞自噬[10-11]。但在生理情况下,大剂量活性维生素D是否引起细胞自噬并不确定。
本研究拟通过添加不同剂量活性VD3拟诱导构建活性VD3诱导老龄大鼠细胞自噬模型。以透射电子显微镜观察细胞自噬现象,用western-blot方法检测实验大鼠肝脏组织LC3表达,通过比较不同组别间实验大鼠C3II/LC3I的比值,明确不同组别大鼠发生细胞自噬的程度和差异,以期明确在生理状况下活性VD3对于细胞自噬的作用。
1 材料与方法
1.1 仪器与试剂
透射式电镜(日本日立H I-TACH I公司H-600);超薄切片机(瑞典LKB公司LKB-V);超声波粉碎仪(美国sonics公司CPX130);脱色摇床(中国其林贝尔公司9550);酶标仪(美国MD公司spectra Maxplus384);紫外凝胶成像系统(美国protein simple公司Alpha Fluor chemHD2);恒温水浴锅(中国HHS-11-4);高速冷冻离心机(美国索福ST16R);电泳仪(美国伯乐041BR);蛋白电泳半干转仪(美国伯乐221BR);精密电子天平(瑞士梅特勒公司PL402-L)漩涡混匀器VEKTEX-5:(其林贝尔仪器制造有限公司)。
活性VD购自sigma公司纯度为99%,LC3抗体购自sigma公司,14月龄SD雄性大鼠,体质量320~470g以及饲料(山西医科大学动物实验中心)。
1.2 方法
1.2.1 大鼠分组及取材
大鼠32只自由饮食洗脱2周,饲料为全价颗粒料(主要营养成分:粗蛋白19.31%、粗脂肪2.9%、粗纤维3.1%、水分8.7%、钙0.5%、磷0.5%),2周饮食洗脱后后按体质量随机分为:A组:不添加维生素D组;B组:低剂量活性维生素D组[(0.01μg/kg)/d];C组:中剂量活性维生素D组[(0.1μg/kg)/d];D组:高剂量活性维生素D组[(0.4μg/kg)/d]。普通环境饲养,灌胃所用活性维生素D温度20~24℃,湿度55%~80%,自然光照,饮用自来水,每周换垫料2次。大鼠以及饲料均由山西医科大学动物中心提供。观察并记录各组大鼠的一般情况(进食、饮水、活动等)及,每周检测体质量并记录,以便评估其健康状态及营养状况。
饲养5个月后,A、B、C、D四组大鼠均应禁食24h后次日清晨开始采集标本。用3%的戊巴比妥钠麻醉大鼠后切开皮肤及皮下组织暴露肝脏,快速剪下一小块肝脏组织在预冷的固定液30s内切成1mm3大小的组织块,置于2%的戊二醛固定液2h后缓冲液冲洗后浸泡,4℃保存备用。切取大鼠剩余部分肝脏,用预冷生理盐水冲洗后,切成均匀的小块包入锡纸中,放入-80℃冰箱备用。
1.2.2 透射电镜观察肝细胞自噬泡
经过常规取材、双重固定、脱水、浸透、包埋、切片(厚度为50nm)、醋酸双氧铀和枸橼酸铅双重染色后,透射电镜观察、拍照、记录。
1.2.3 用western-blot的方法半定量检测自噬小体标志物LC3
1.2.3.1 western-blot系统储备液体的配置
丙烯酰胺储备液:1g的甲叉丙烯酰胺,29g的丙烯酰胺溶于60mL三蒸水中加热溶解定溶到100mL后过滤,放4℃保存。5×电泳缓冲液:15.1gtris碱、94g甘氨酸、50mL10%的SDS加三蒸水后用HCl调节pH至8.3,定溶于1000mL放4℃保存。凝胶缓冲液:tris-HCL8.8,1.5M tris-base溶于三蒸水中,HCL调pH至8.8定溶于1000mL放4℃保存。tris-HCL6.8,1M tris-base溶于三蒸水中,HCL调pH至6.8定溶于1000mL放4℃保存。10gSDS定溶于100mL水中配置成10%的SDS溶液室温保存。0.1gAPS溶于1mL三蒸水中避光4℃保存,一周内使用。转膜缓冲液:200mL甲醇、14.4g甘氨酸、3gtris-base溶于三蒸水后调pH至8.3定容于1L水中4℃保存。
1.2.3.2 蛋白样品的提取
将标本解冻后取50mg组织块用预冷干净的刀片尽量切碎,按说明加入500uL的RIPA裂解并加入PMSF液置于超声细胞破碎仪中超声低温匀浆,直至组织碎块完全匀浆,放入4℃冰箱充分裂解1~3h后低温离心收集取上清。整个过程,于冰上操作。用BCA蛋白测定分析盒测定各组蛋白浓度,并用裂解液调节各组总蛋白浓度相等,并计算蛋白上样量。
1.2.3.3 SDS-PAGE电泳、半干转膜、免疫印迹等实验步骤详细参考分子克隆实验指南以及本校中心实验室的操作,并根据实验结果优化选择。制备好干净的玻璃板,灌入预先配置好的15%的分离胶5mL,加正丁醇压平,凝固后加入5%浓缩胶并迅速插入梳子。将样本1∶1混合2×的上样缓冲液,煮沸5min后迅速放入冰中,使其快速冷却。等浓缩胶凝固后,把梳子拔出,在第一个齿孔位置加入预染marker然后依次进行上样。上样之后进行电泳,在浓缩胶上加电压为80v,至分离胶后,转换电压为120v,直至溴酚蓝跑到底部。将跑好的胶切分后,把有条带的部分进行半干转。半干转后洗膜3次,每次5min,之后用用TBST配置成的5%富含V成分的牛血清白蛋白封闭液在室温下摇床封闭2h,再洗3次膜,每次5min。根据预染maker的位置大概判断?-actin和目的条带的位置将膜剪切后加入分别加入?-actin抗体和LC3抗体过夜。隔日洗膜三次每次5min,加入分别加入?-actin和LC3抗体的二抗,室温摇床孵育2h,之后洗膜3次,每次5min,进行曝光。
1.2.4 统计学分析
结果采用SPSS16. 0软件包建立数据库,并进行统计分析。数据资料以表示。各组细胞自噬小体与胞浆的比值因方差不齐所以用秩和检验(Kruskal-Wallis H test),两组之间的进一步比较采用LSD-t多重比较,检验水准α=0.05。各组细胞自噬小体LC3II/LC3I的结果比较用单因素方差分析,检验水准α=0.05,两组之间的进一步比较采用扩展的t检验法,检验水准α=0.05。
2 结 果
2.1 透射电镜观察肝细胞自噬泡?
A组:不添加活性维生素D组肝脏,细胞核内染色质分布均匀,核仁明显;脂滴较多,线粒体嵴结构清晰,核糖体较多,粗面内质网分布在细胞质,自噬溶酶体少见。B组和C组:肝脏细胞核内染色体轻度凝集、边聚,核仁可见,细胞质内线粒体丰富,肿胀明显,内质网轻度扩张,自噬溶酶体数量较多。D组:肝脏细胞核圆形,核内染色质轻度边聚,线粒体丰富,线粒体轻度肿胀,内质网轻度扩张,自噬溶酶体较多。自噬泡为单层或双层膜包裹着的处于不同降解阶段的胞质成分或废弃的细胞器经消化降解后形成的板层样结构。见图1和表1。
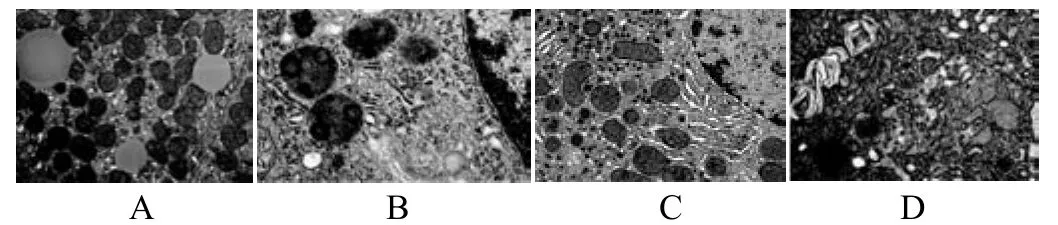
图1 所示:A组为不添加VD组,B组为低剂量VD组,C组为中剂量,D组高剂量VD组
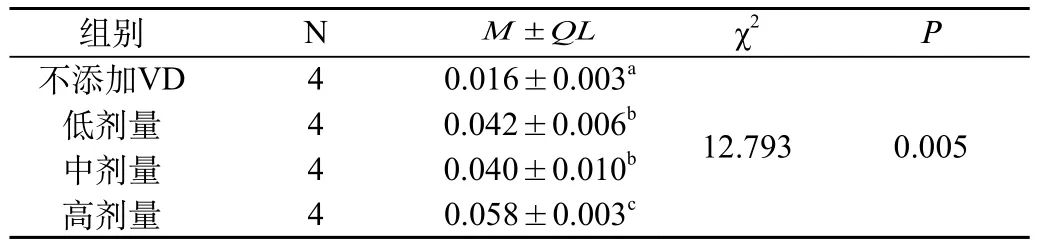
表1 自噬泡与胞浆面积的比值
因为四组自噬泡与胞浆的比值因方差不齐,所以采用了秩和检验(Kruskal-Wallis H test)。χ2=12.793,P<0.05,P=0.005。总的来讲四组之间差异有统计学意义。各组细胞自噬泡与胞浆比值在两组之间的进一步比较采用扩展的t检验法,两两比较结果,A组与BCD组差异都有统计学意义,B组和C组差异没有统计学意义,二者都与D组差异有统计学意义。
2.2 用western-blot检测自噬小体标志物LC3II/LC3I的比值
见表2。

表2 细胞自噬小体LC3II/LC3I的比值
多组之间的比较用单因素方差分析,F=8.711,P<0.0001。总的来讲四组之间差异有统计学意义。进一步采用LSD-t进行多组之间的两两比较。结果:不添加VD3组与每个组差异都有统计学意义,低剂量VD3组和中剂量VD3组差异没有统计学意义,二者都与高剂量VD3差异有统计学意义。见图2。
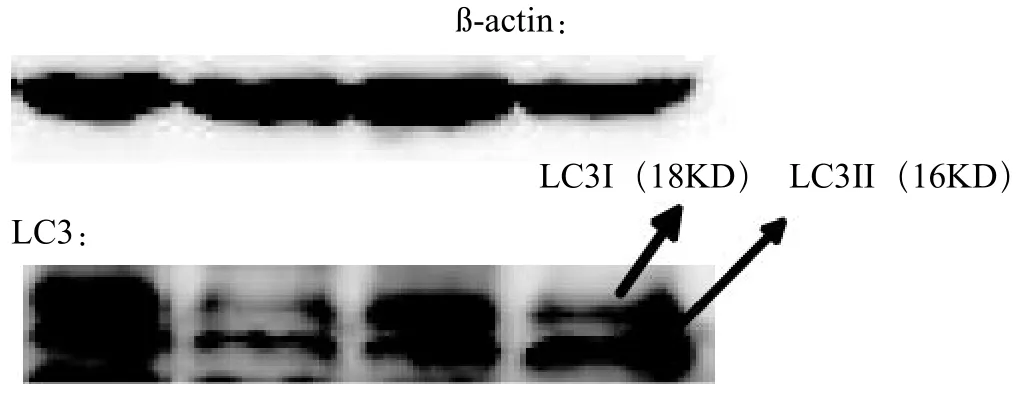
图2
不同组别LC3II/LC3I比值,见图3。

图3
3 讨 论
细胞自噬是一种在进化上高度保守的降解过程,是通过降解受损蛋白、细胞器以及有潜在危险病原体的细胞来保护机体的一种机制[2,12]。细胞自噬贯穿于正常细胞生长发育和生理病理过程中,能清除细胞内过量的或受损的细胞器和蛋白质,对维持蛋白质代谢平衡和细胞内环境稳定起重要作用,它对防止老化、延长寿命有积极作用[13]。研究表明细胞自噬与衰老及抗衰老密切相关,随着年龄的增加自噬功能下降,长期抑制细胞自噬加速了衰老,有研究证明在大鼠长期刺激自噬可延缓衰老的过程[9]。
随着分子生物学,细胞生物学的不断进步,VD3由于其在抵抗衰老和影响基因表达方面的作用而被人们从新认知。研究人员发现VD3在人体的不同细胞调控着不同基因的表达,通过大量的研究确定VD3直接影响着人类229个基因的活性[14],增强和减弱大约900多种不同基因的表达[15]。它对除了已经成为老生常谈的抗佝偻病作用之外还与大部分老年慢性疾病,如心脏病、糖尿病、高血压、癌症等发生发展都有着密切的关联[16],更有研究发现VD3可以部分逆转老年大鼠眼底的黄斑变性[17]。第一次关于维生素D化合物激活自噬的研究来自由维生素D衍生物1,25(OH)2VD3和EB1089对癌症细胞引起的特殊的细胞毒作用[18]。用1,25(OH)2VD3和EB1089治疗乳腺癌引起的是一种非典型的细胞死亡独立于凋亡蛋白半胱氨酸天冬氨酸蛋白酶引起的凋亡[19]即细胞自噬。在近几年的研究中发现,在对一些癌症和感染的病理治疗中发现,大剂量活性维生素D3可以诱发细胞自噬。他可能的机制是通过增加胞浆内游离钙浓度,激活CAMKK-?,再激活AMPK[20-21],磷酸化TSC1/TSC2,阻止了PHEB的表达,减少了对mTOR的正反馈,导致ATG蛋白合成,细胞自噬发生。在单核细胞中VD引起的细胞自噬可能通过的旁路途径:通过维生素D3受体上调蛋白hCAP-18衍生出来的LL-37缩氨肽,不仅可以参与构建自噬泡结构,而且通过上调Atg-5,Atg-6,Beclin-1促进自噬泡和溶酶体融合[21]。以上研究是在癌症和感染时大剂量活性VD3衍生物在动物体内发生的促进细胞自噬的作用,但是在生理状况下使用大剂量维生素D3诱发细胞自噬的研究还没有。
在以往对于诱导细胞自噬的研究中发现,有很多能诱导细胞自噬的有多种形式,比如饥饿、缺氧、感染以及使用一些用于治疗癌症的药物等[8]本实验通过在生理状况下使用不同剂量活性维生素D3干预不同组别大鼠,经过一段时间干预后,取大鼠肝脏组织,检测通过透射电镜观察各组大鼠肝脏细胞自噬的情况,经过计算显示:三个不同剂量维生素D3干预组自噬泡占胞质总面积的比值明显大于对照组自噬泡占胞质总面积的比值,差异有统计学意义。低剂量和中剂量活性VD3干预组大鼠细胞自噬泡占胞质总面积的比值,差异没有统计学意义。高剂量活性VD3组与低剂量和中剂量活性VD3组大鼠细胞自噬泡占胞质总面积的比值差异有统计学意义。使用western-blot的方法检测自噬小体标志物LC3,通过灰度分析和统计看大鼠细胞自噬程度。对照组大鼠和其余三组维生素D干预组大鼠LC3II/LC3I差异有统计学意义,低剂量和中剂量组LC3II/LC3I没有统计学意义。两组都与高剂量组LC3II/LC3I差异有统计学意义。两种分析结果一致。由此可见,在生理状态下,大剂量活性VD3可以诱导老年大鼠细胞自噬的发生,且与剂量有关。活性VD3是否与维生素D受体结合并通过基因表达产生抑制mTOR激酶的蛋白表达,激活了mTOR信号途径进而增强了细胞发生自体吞噬及其相应的细胞机制对细胞自噬的影响等将有待于进一步研究。我们推测将在应用临床药物控制疾病的同时通过给予合适剂量活性VD3来调控细胞自噬,对健康产生重要影响,将是细胞自噬在临床应用中的一个方向,对一些老年病,如心脑血管疾病的治疗,在药物控制疾病的基础上开创新的辅助手段。
[1] Hemmingsen C,Staun M,Lewin E,et al.Effect of Vitamin D Metabolites and Analogs on Renal and Intestinal Calbindin-D in the Rat[J].Calcif Tissue Int,1996,59(5):371-376.
[2] Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J]. Cell,2008,132(1): 27-42.
[3] HΦyer-Hansen M,Pauline S,Nordbrandt S.Autophagy as a basis for the health-promoting effects of vitamin D[J].Trends Mol Med, 2010,16(7):295-302.
[4] Jones G.Expanding role for vitamin D in chronic kidney disease: importance of blood 25-OH-D levels and extra-renal 1alphahydroxylase in the classical and nonclassical actions of 1alpha,25-dihydroxyvitamin D(3)[J].Semin Dial,2007,20(4):316-324.
[5] Norman AW.From vitamin D to hormone D:fundamentals of the vitamin D endocrine system essential for good health[J].Am J Clin Nutr,2008,88(2):491S-499S.
[6] White JH.Vitamin D signaling,infectious diseases,and regulation of innate immunity[J].Infect Immun,2008,76(9):3837-3843.
[7] Zittermann A,Schleithoff SS,Frisch S,et al.Circulating calcitriol concentrations andtotal mortality[J].Clin Chem,2009,55(6):1163-1170.
[8] Bikle DD.Vitamin D:newly discovered actions require reconsideration of physiologic requirements[J].Trends Endocrinol Metab, 2010,21(6):375-384.
[9] Bergamini E,Cavallini G,Donati A,et al.The Role of Autophagy in Aging[J].Ann N.Y Acad Sci,2007,1114(1):69-78.
[10] Mathiasen IS.EB1089,a novel vitamin D analogue,has strong antiproliferative and differentation inducing effects on cancer cells[J].Steroid Biochem Mol Biol,1993,46(3):365-371.
[11] Mathiasen IS,Lademann U,J??ttel? M.Apoptosis induced by vitamin D compounds in breast cancer cells is inhibited by Bcl-2 but does not involve known caspases or p53[J].Cancer Res, 1999,59(19):4848-4856.
[12] Hyer-Hansen M,Pauline S,Nordbrandt S.Autophagy as a basis for the health-promoting effects of vitamin D[J].Trends Mol Med, 2010,16(7):295-302.
[13] Bergamini E,Cavallini G,Donati A,et al.The role of m acroautophagy in the ageing process,ant-ageing intervention and ageassociated diseases[J].Int J Biochem Cell Biol,2004,36(12):2392-2404.
[14] Agmon-Levin N,Theodor E,Segal RM,et al.Vitamin D in Systemic and Organ-Specific Autoimmune Diseases[J].Clinic Rev Allerg Immunol,2012[Epub ahead of print].
[15] Kamen DL,Tangpricha V.Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity[J]. J Mol Med,2010,88(5):441-450.
[16] Hoyer-Hansen M,Bastholm L,Szyniarowski P,et al.Control of macroautophagy by calcium,calmodulin-dependent kinase kinasebeta,and Bcl-2[J].Mol.Cell,2007,25(26):193-205.
[17] Lee V,Rekhi E,Kam JH,et al.Vitamin D rejuvenates aging eyes by reducing inflammation, clearing amyloid beta and improving visual function[J].Neurobiol Aging,2012,33(10):2382-2389.
[18] Mathiasen IS.EB1089,a novel vitamin D analogue,has strong antiproliferative and differentation inducing effects on cancer cells[J].Steroid Biochem Mol Biol,1993,46(3):365-371.
[19] Mathiasen IS,Lademann U,J??ttel? M.Apoptosis induced by vitamin D compounds in breast cancer cells is inhibited by Bcl-2 but does not involve known caspases or p53[J].Cancer Res,1999, 59(19):4848-4856.
[20] Hoyer-Hansen M,Bastholm L,Szyniarowski P,et al.Control of macroautophagy by calcium,calmodulin-dependent kinase kinasebeta,and Bcl-2[J].Mol Cell,2007,25(26):193-205.
[21] Yuk JM,Shin DM,Lee HM,et al.Vitamin D3 induces autophagy in human monocytes/macrophages via cathelicidin[J].Cell Host Microbe,2009,6(3):231-243.
The Effect of Different Dosage of 1-25(OH)2VD3to Rat Autophagy
LENG Jing, QIU Ling
(Department of Cardiology, Second Clinical Medical College, Shanxi Medical University, Taiyuan 030001, China)
Objective To explore whether under the physiological condition given different dosage of 1-25(OH)2VD3in aged rats could lead different autophagy. Method Thirty-two male 18-month-old SD rats were randomly divided into 4 groups: A: control group, B: Low dosage of 1-25(OH)2VD3, [0.01 μg/kg×d]; C: middle dosage of 1-25(OH)2VD3[0.1μg/kg × d]; D: high dosage of 1-25(OH)2VD3[0.4, μg/kg × d]. Given the rats with different dosages of 1-25(OH)2VD3. Take the samples after five months. Autophagsomes were observed with Transmission Electron Microscopy, Western-blot detect the expression of LC3 which is the marker proteins for autophagy. And then comparing different of rats LC3 expression occurrence autophagy and degree of difference in different groups. Result Under physiological conditions given different dosage of 1-25(OH)2VD3in four groups lead the proportions of autophagosome to the total area of cytoplasm have significant difference(P<0.05).Pairwise comparison results The proportions of autophagosome to the total area of cytoplasm in group A was significantly lower than any other groups(P<0.05).There have no statistical different between group B and group C(P>0.05).There have significant difference between group B and group D,group C and group D(P<0.05).The result of LC3II/LC3I were as same as the result of proportions of autophagosome to the total area. Conclusion To old rats under physiological condition long-term given different large dosage of VD3can lead different autophagy degree in different groups.
Autophagy; 1-25(OH)2VD3; LC3
R54;R329.2+5
B
1671-8194(2013)27-0001-04
山西省自然科学基金(项目编号:2010011054-2)
*通讯作者
