紫杉醇衍生物GT对人喉癌细胞系Hep-2的临床价值分析
2013-07-01陈静
陈 静
(广州市第一人民医院,广东 广州 510180)
紫杉醇衍生物GT对人喉癌细胞系Hep-2的临床价值分析
陈 静
(广州市第一人民医院,广东 广州 510180)
目的探讨紫杉醇衍生物GT对人喉癌细胞系Hep-2的临床价值。方法GT对Hep-2细胞的增殖抑制作用应用MTT法进行测定,通过流式细胞术及细胞形态学考察GT对Hep-2细胞诱导凋亡的作用。结果在光镜下,GT作用细胞之后能观察到较为典型的细胞凋亡的形态学变化,如染色质断片化、细胞核固缩、核碎裂、染色质凝集成新月型紧贴于核膜周边、凋亡小体形成等。明显增加G2/M期的细胞比例,典型的亚二倍体“凋亡小峰”出现。结论紫杉醇衍生物GT能够明显抑制Hep-2细胞的生长,使细胞分裂阻滞于G2/M期,对肿瘤细胞凋亡有诱导作用,值得临床进一步对其进行研究开发。
紫杉醇衍生物;GT;人喉癌细胞;Hep-2;价值;阻滞;抑制
紫杉醇是一种抗癌新药,它从太平洋紫衫属短叶紫衫茎皮中提取而得,在多种恶性肿瘤的临床治疗中已经得到了应用。但是,在实际临床应用中,由于其非常差的水溶性,大大限制了应用程度。所以,为了提高紫杉醇的水溶性,对其进行修饰,已经成为目前紫杉醇研究的热点。探讨紫杉醇衍生物GT对人喉癌细胞系Hep-2的临床价值,为今后的紫杉醇临床研究提供参考。
1 资料与方法
1.1 临床资料
紫杉醇(北京四环制药厂批号∶ H20057878),本院提供紫杉醇GT,DMEM(宜兴市塞尔生物化学工厂批号:960819、960820、970320),噻唑蓝(MTT)(Amresco公司批号:0793),新生牛血清(杭州四季青生物工程材料研究所提供)。
1.2 细胞培养
本院提供人喉癌细胞系Hep-2,10%新生牛血清为培养液,100μg/mL链霉素、100U/mL青霉素,2mmol/LL-谷氨酰胺的DMEM溶液,于5%CO2、37℃条件下培养。
1.3 药液配制
称取适量紫杉醇粉末和GT,DMSO溶解,然后进行过滤以除菌,应用DMEM进行稀释处理,浓度以所需浓度为准,培养液中不超过0.5%的DMSO终浓度。
1.4 形态学观察
6×105个Hep-2细胞接种于10mL培养瓶中,给予24h的5%CO2、37℃培养箱中进行培养,然后更换为含有800nmol/L和80nmol/L的GT的培养液,应用显微镜分别观察作用24h、48h、72h后的细胞变化情况,用Giemsa于各时间点进行染色,并在显微镜下对细胞形态进行观察。
1.5 细胞增殖抑制实验
按照4×103/mL密度,于96孔板中接种Hep-2细胞,放置在37℃条件下,每孔200μL,进行24h培养之后,加入20μL不同浓度GT药液,分别达到1600nmol/L、800nmol/L、160nmol/L、64nmol/L、32nmol/L、6.4nmol/L、3.2nmol/L的终浓度,每种浓度平行4孔,同时设阳性对照组和阴性对照组,阳性对照组即紫杉醇组,阴性对照组含0.5%DMSO的DMEM。分别加入20μL MTT(5mg/mL)于加入药液24h、48h及72h后,继续进行4h的37℃培养,弃上清,紫色结晶加100μL酸化异丙醇(0.04%HCL)溶解。D值在酶标仪上进行测定,参考波长为630nm,测定波长为570nm。
1.6 流式细胞仪分析
6×105个Hep-2细胞接种于10mL培养瓶中,进行24h的5%CO2、37℃培养箱培养之后,更换为含有6.4nmol/L、80nmol/L、和800nmol/L的紫杉醇或GT培养液,分别给予48h作用之后,用胰酶消化并收集细胞,0.7mL无水乙醇加入含5%~10%小牛血清0.3mL的PBS悬浮,进行24h以上的-20℃固定细胞。进行30s的3000r/min离心之后,弃上清,2次PBS洗之后,进行30min 37℃温育,沉淀用100μLRNAase(1mg/mL)悬浮,加碘化丙啶400μL(PI,50μg/mL),放置到暗处,10min后上机检测。
2 结 果
2.1 细胞形态观察
进行24h的GT处理之后,细胞折光性增强,并开始变圆。漂浮细胞的比例随时间延长而增加,部分细胞漂浮、皱缩于48h后出现。低浓度作用的细胞在72h之后还有少数贴壁,而72h后高浓度药物作用的细胞全部漂浮。光镜下观察发现,Giemsa染色后药物作用组细胞发生凋亡,其特征主要表现为细胞染色质浓缩,核碎裂,断裂的染色质弥散于胞浆内,形成粗细不匀的颗粒,细胞膜出泡,碎裂核被部分细胞膜包裹形成凋亡小体(图1)。
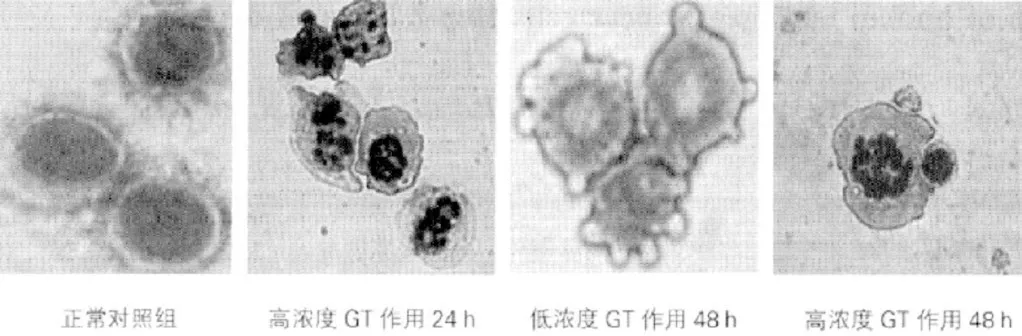
图1 GT作用后Hep-2细胞形态的变化
2.2 GT对Hep-2细胞的增殖抑制作用
对Hep-2细胞,GT和紫杉醇均具有明显的生长抑制作用,其抑制率在相同浓度条件下随作用时间的延长而增加;抑制率在相同作用时间下随药物浓度的升高而增加,其关系呈现为剂量依赖和时间依赖。各个时间点相比较,GT和紫杉醇的抑制率都没有显著性差异(P>0.05),表明二者具有相当的细胞毒性。
3 讨 论
紫杉醇是一种具有独特抗癌活性的天然药物,在当今抗癌药物研究中已经成为热点[1]。但是,紫杉醇的特点是毒性大、水溶性差,从而限制了其使用范围,导致了紫杉醇注射制剂存在许多不足。紫杉醇水溶性能够通过化学修饰而改善,从而达到增强临床治疗效果、降低毒副作用的目的。
本组研究中,引入了极性很大的胍丁胺基团,大大提高了紫杉醇衍生物GT水溶性。在对Hep-2细胞的增殖抑制实验中,细胞毒性GT和紫杉醇相当,这表明在胞内2'-羟基酯键可断裂,将原药紫杉醇释放出来,对其细胞毒性基本不造成影响。在光镜下经Giemsa染色发现,GT作用组细胞出现凋亡特征:断裂的染色质弥散于胞浆内,形成组粗不均匀的颗粒,核碎裂,细胞染色质浓缩,细胞膜出泡,碎裂的核被部分细胞膜包裹而形成凋亡小体;在诱导细胞凋亡实验中,发现低浓度GT比高浓度GT更容易,其主要原因可能是过高的药物浓度,逐渐增多了坏死细胞。诱导细胞凋亡从凋亡角度看,应选择合适的作用时间和药物浓度,才可以启动癌细胞的“自杀”程序,同时又避免了正常细胞因超长作用时间和药物过大剂量而受损。通过本组研究,表明胍丁胺基团在化学修饰紫杉醇的过程中,增强了其水溶性,且对其抗肿瘤活性也并未改变,值得临床作进一步的研究开发[2-5]。
[1] 刁志花,龚伟,尤勇,等.紫杉醇衍生物对人喉癌细胞系Hep-2的抑制作用[J].军事医学科学院院刊,2009,30(4)∶337-339.
[2] 王江华,司徒镇强,吴军正,等.紫杉醇对人粘液表皮样癌细胞系的细胞毒研究[J].实用口腔医学杂志,2009,17(1)∶112-114.
[3] 赵世义,马力,王祥.紫杉醇诱导肝癌细胞SMMC-7721凋亡的实验研究[J].肿瘤防治杂志,2009,9(3)∶257-259.
[4] 杜文婷,胡永洲.紫杉醇水溶性衍生物的研究进展[J].中国现代应用医学,2009,2(1)∶304-305.
[5] 吕卫兵,陈小义,徐瑞成,等.水溶性紫杉醇衍生物PLT抗肿瘤活性的实验研究[J].天津医药,2009,37(3)∶294-295.
Clinical Value of Taxol Derivative GT on Human Laryngeal Carcinoma Cell line Hep-2
CHEN Jing
(Guangzhou First People’s Hospital, Guangzhou 510180, China)
ObjectiveTo investigate the clinical value of taxol derivative GT on human laryngeal carcinoma cell line Hep-2.MethodsGT inhibited the proliferation of Hep-2 cell by MTT method were determined by morphology, flow cytometry and the effects of GT on apoptosis of Hep-2 cells induced by.ResultsUnder light microscope, GT cells can be observed in the typical morphological changes of apoptosis, such as chromatin fragment, cell shrinkage, nuclear fragmentation, chromatin condensation integrated crescent clings to the nuclear periphery, the formation of apoptotic bodies. Increased G2/M phase cells proportion, " typical hypodiploid apoptosis peak appeared small ".ConclusionTaxol derivative GT can obviously inhibit the growth of Hep-2 cells, the cell division arrest in G2/M phase, in inducing the apoptosis of tumor cells, which is worthy of further research and development of the.
Taxol derivatives; GT; Laryngeal squamous cell carcinoma; Hep-2; Value; Block; Inhibition
R739.65
B
1671-8194(2013)13-0027-02
