经颈静脉肝内门体分流术联合胃冠状静脉栓塞术治疗门脉高压上消化道出血的临床疗效
2013-06-23毕光荣张勇陈旭昇
毕光荣,张勇,陈旭昇
上消化道出血是肝硬化门静脉高压患者致死的最主要原因。目前,经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic stent,TIPS)已成为缺乏外科手术指征且内镜治疗不能控制的门静脉高压症上消化道出血患者的重要、甚至唯一的治疗选择[1]。TIPS术联合食管胃静脉曲张栓塞术(gastric coronary vein embolization,GCVE)能同时起到分流和断流的双重效果,能有效控制食管静脉曲张破裂出血、消除腹水和纠正脾功能亢进,提高患者的生活质量并改善其生存率。本研究对54例行TIPS联合GCVE治疗肝硬化上消化道出血患者进行术后随访分析,并探讨其临床价值。
1 材料与方法
1.1 临床资料
收集我科2005年1月至2012年6月收治的肝硬化门静脉高压所致上消化道出血,采用TIPS术联合GCVE术治疗患者54例资料,其中,男35例,女19例;年龄为44~75岁,平均58岁。术前CT和胃镜检查诊断为食管胃底静脉曲张,其中42例有乙型肝炎病史,6例为血吸虫性肝硬化,8例为酒精性肝硬化;6例曾行外科分流或断流术;25例有腹水,8例为轻度,17例为中~重度。术前Child-Pugh评分:A级16例,B级28例,C级10例。39例为择期手术,15例为急性出血,经常规或内镜下治疗出血未得到有效控制而行急症TIPS联合GCVE术治疗。
1.2 方法
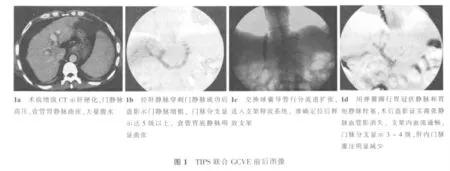
1.2.1 手术方法采用通用电气(GE)Advantx数字减影血管造影系统,主要介入器材为Cook RUPS-100穿刺套件,Bard Flunency Plus镍钛合金覆膜支架。患者仰卧于手术台,常规消毒铺巾,局麻下行右侧颈内静脉穿刺,成功后送入导丝,将RUPS 100穿刺套件送至肝静脉,结合肝静脉造影及术前多层螺旋CT门脉成像,选择合适角度、深度及穿刺方向,经肝组织穿刺门静脉(15例选择右支穿刺,29例为左支穿刺),穿刺成功后引入导丝并交换入5 F猪尾导管行门静脉造影,测定门静脉压力,交换球囊导管行分流道扩张(分流道直径8~10 mm),送入支架释放系统,准确定位后释放支架,然后用弹簧圈行胃冠状静脉和胃短静脉栓塞,造影证实曲张静脉血管影消失,支架内血流通畅,再次测定门静脉压力后结束手术(见图1)。术后12 h卧床,监测生命体征、有无腹腔内出血表现,并常规抑酸、抗凝、酌情抗感染、预防性抗肝昏迷治疗。
1.2.2 观察指标术前常规行肝、肾功能检查,术后3 d、1周、1个月、半年定期复查肝肾功能,包括血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、白蛋白(Alb),血肌酐(Cr)、尿素氮(BUN)、血清K+、血清Na+。术后1周,1、3个月行超声检查,以后间隔半年复查,了解支架通畅情况,采用复诊、电话方式进行随访,连续随访9~42个月,直至患者死亡或失访。
1.3 统计学分析
采用SPSS13.0统计软件进行数据分析,数据资料和计量资料结果均以±s表示,手术前后连续变量分析采用配对t检验,计量资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
54例TIPS术联合GCVE术操作均获成功,建立有效分流通道,弹簧钢圈栓塞后血管造影证实曲张静脉消失,无侧支循环开放。术前平均门静脉压力为(43.6±4.3)cm H2O,术后平均门静脉压力为(24.7±3.9)cm H2O,静脉血流速度加快,门静脉梯度压明显下降(P<0.05)。术后患者的临床症状、体征均有改善,出血得到有效控制,15例急症手术后均成功止血。术后近期(1个月内)均未出现腹腔积血、心脏压塞、胆汁漏等穿刺相关并发症。术后3~7 d,25例腹水患者腹胀均有减轻,腹水不同程度减少,患者食欲逐渐增加。
2.2 手术前后肝、肾功能变化
门脉分流后肝脏血流灌注减少可加重肝功能损害,并造成血氨增加,术后3 d、1周患者肝功能指标ALT、AST、TBIL、DBIL均有不同程度升高,尤其以Child-Pugh C级患者上升明显(P<0.05),术后1个月复查以上指标开始下降,术后半年逐渐恢复至术前水平。血清Alb于术后1个月普遍出现轻度增加趋势。手术后随着消化道出血的有效控制、肾前性少尿和氮质血症的改善,患者尿量逐渐增加,BUN、Cr在术后1周即有显著下降(P<0.05),以Child-Pugh C级者下降明显,至半年随访亦有下降趋势(表1)。
表1 Child A~C级不同组间手术前后肝肾功能变化(±s)
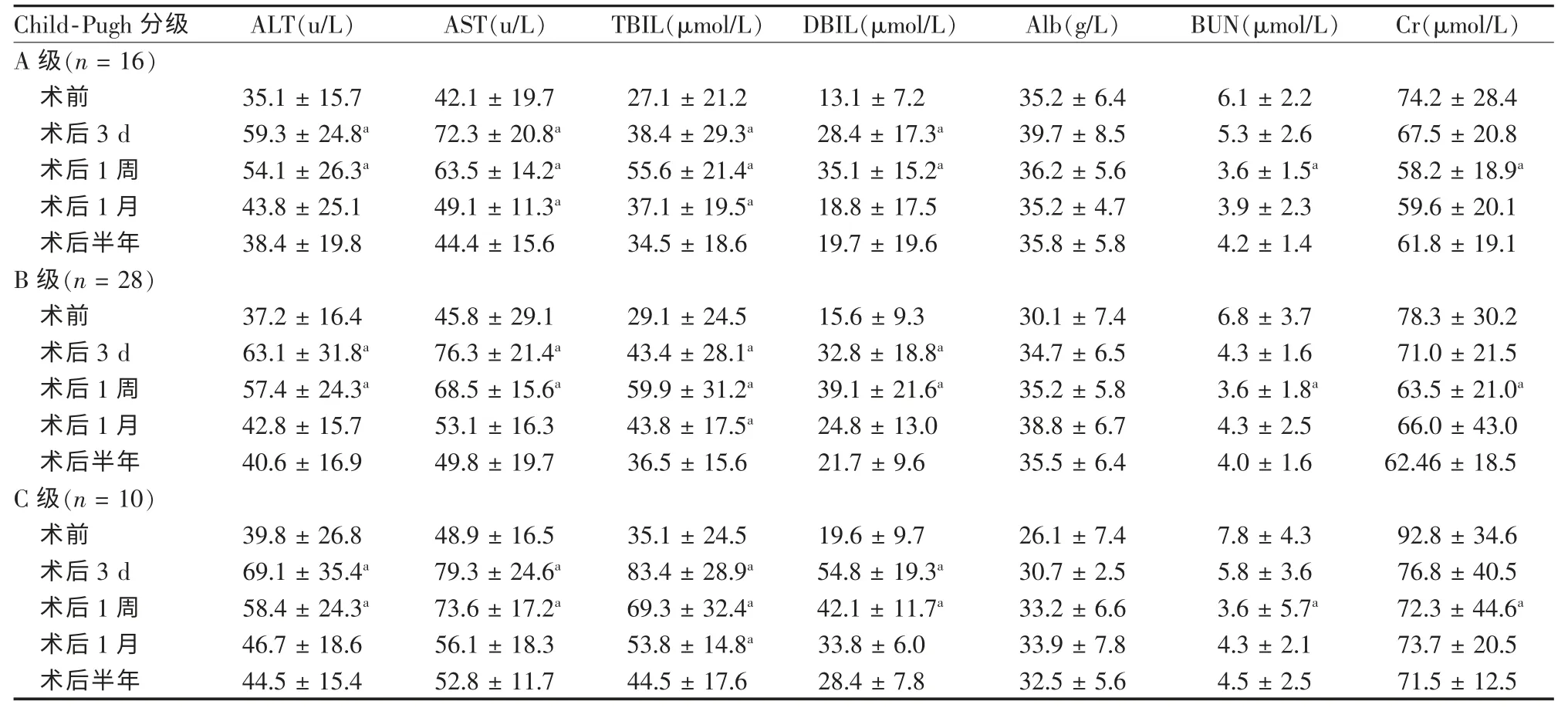
表1 Child A~C级不同组间手术前后肝肾功能变化(±s)
注:a为与术前比较,P<0.05
?
2.3 并发症及转归
术后再出血:术后1、6个月,1、2、3年再出血率分别为0,3.7%(2例),9.3%(5例),14.8%(8例,6例为术后首次出血,2例为反复出血),20.4%(11例,4例为术后首次出血,7例为反复出血)。累计出血为26例次,再出血原因分别为曲张静脉破裂出血38.5%(10/26),门脉高压性胃病34.6%(9/26),消化性溃疡26.9%(7/26)。术后分流道狭窄为15例(27.8%),分别发生于术后1年(2例),16~24个月(5例),26~37个月(8例),其中10例行TIPS分流术,5例因狭窄程度较轻未行处理。肝性脑病:14例(25.9%),均为Ⅰ~Ⅱ期,分别发生于术后半年(3例),15~24个月(6例),29~34个月(5例),Child-Pugh A~C级肝性脑病的发病率分别为16.7%(2/12)、21.4%(6/28)和50.0%(5/10)。随访期间共死亡7例,均死亡于手术3年后,2例死于原发性肝癌,4例死于消化道大出血,1例死于多器官功能衰竭。7例中4例为Child-Pugh C级患者。
3 讨论
TIPS通过在肝实质内建立肝静脉与门静脉间的人工分流通道,能显著降低门静脉压力,从而有效控制食管胃底静脉曲张破裂出血。近年多中心的临床研究表明,即使在存在肝静脉栓塞、肝恶性肿瘤等手术相对禁忌的情况下,在发生致命性上消化道大出血时,TIPS仍优于外科手术,其抢救的成功率>95%,已成为门静脉高压症上消化道出血的二级预防和难治性腹水治疗的推荐措施[2-3]。
肝内门静脉穿刺是TIPS操作能否成功,或是否出现心脏压塞、腹腔内出血、胆囊损伤等TIPS严重并发症的关键环节,术者除必须具有丰富操作经验以外,还必须结合术前详细的影像学检查(超声或CT,尤其多层螺旋CT)明确门静脉、血流状态及与肝静脉的位置关系。本组45例均于术前行多层螺旋CT门静脉成像,评估门静脉的通畅情况和解剖关系,为制订手术方案提供重要参考依据。门静脉右支分流为TIPS经典的穿刺途径,穿刺亦相对容易。由于门静脉右支承担肝脏75%~80%血流供应,分流后对肝脏血流灌注明显减少,术后可形成对肝脏功能的进一步损害,影响远期疗效。本研究中患者术后肝功能损害于术后1周内达到高峰,尤其以Child-Pugh C级患者波动幅度最大,体现了分流后肝脏灌流减少而肝损害进一步加重的过程,术后血清Alb的小幅增加可能与患者食欲恢复,蛋白质摄入增加有关。近年一系列动物实验和临床研究均表明,门静脉左支分流对肝脏损害较小,分流道狭窄和肝昏迷的概率明显低于门脉右支分流,远期疗效要优于右支分流。本组资料中,除前期30例TIPS时选择门脉右支分流外,后期24例均选择门脉左支分流,在临床观察中也注意到左支分流后患者术后肝功能恢复较快的现象。
TIPS术中是否需要同时栓塞曲张静脉,一直有不同意见。单纯的TIPS治疗、尤其是择期分流患者,有学者认为只需要建立分流通道,一般无须栓塞曲张的静脉,其原因在于有效分流建立后,随着门静脉压力减低,曲张的静脉多能自行消失[4-6]。由于门静脉高压及食管胃底静脉曲张是一个漫长的渐进性过程,肝硬化可进一步加重,加之分流后曲张静脉的病理改变在分流术后即门脉压力降低后仍在一定时间内持续存在,故并不能完全避免再出血。TIPS联合GCVE能够降低门静脉压力,分流和断流作用互为补充,有助于预防或延迟断流术后新的侧支血管形成,在理论上可减少再出血概率。鉴于食管静脉曲张出血后,再出血概率至少为50%。本研究采用TIPS联合GCVE,15例急症TIPS,术后均成功止血。术后2年的再出血率为14.8%。文献报道,单纯TIPS术后再出血1年发生率即可达20%~26%[7]。Tesdal等[9]的研究也表明TIPS联合GCVE对预防食管胃静脉曲张破裂再出血的作用优于单纯TIPS。值得关注的是,本研究中有9例再出血由门脉高压性胃病引起,可能与为断流术后门静脉仍处于高压状态使胃壁血液回流阻力增加,胃黏膜缺血缺氧,微循环血流减少及胃黏膜屏障受损有关。
TIPS开展30余年来,术后较高的分流道再狭窄率和肝性脑病仍然是限制并影响TIPS中远期疗效的重要因素。分流道狭窄的机制复杂,文献报道术后半年至1年狭窄率可达20%~70%[9],目前认为是损伤-修复、支架生物相容性、分流道血流效应和胆汁外漏诱发内膜增生等多因素共同作用的结果。早期分流道狭窄的主要病理基础为支架内血栓形成,与支架位置不当和术后抗凝不足密切相关。中远期分流道狭窄(>1个月以上)主要由分流道内假性内膜过度增生所致。Viatorr和Fluency等设计的新型覆膜支架可使分流道血流与肝组织隔离,阻止胆汁向分流道漏出或肝组织向分流道内过度生长,其1年初次通常率可达80%~100%[10]。本研究中采用Fluency覆膜支架,手术后1年支架狭窄率仅为3.7%(2/54)。
肝性脑病的发生机制,为TIPS分流后源于肠道的毒性代谢产物未经肝脏解毒和清除,直接进入体循环并透过血脑脊液屏障,引起脑能量代谢紊乱,使患者出现行为失常、意识障碍甚至昏迷,严重吋危及生命,文献报道其发生率16%~55%。分流途径、分流道大小及肝功能Child-Pugh C级与肝性脑病关系密切。门静脉左支主要接受来自血氨浓度较低的脾静脉血,对肝功能损害较小,与右支分流比较,左支分流的优势显而易见。近年来,越来越多的学者提倡使用8 mm支架[11-13],以免分流量过大,并通过实验和临床研究证明采用8 mm内径支架后,门静脉压力梯度较前低,但患者止血率与支架再狭窄率、静脉曲张消失率与10 mm支架无明显差异,但肝性脑病发生率却明显下降。本组病例主要采用8 mm支架,随访期间肝性脑病的累计发生率为24.1%,其中Child-Pugh C级患者例数和比率要明显高于Child-Pugh A级和B级患者。
本研究为主要针对肝硬化上消化道出血患者,并未针对顽固性腹水患者,也无合并肝肾综合征的患者,术前血清钠处于正常水平,TIPS对电解质的影响也并不明显,术后近期肝功能虽有一定损害,但并无相关并发症发生,对于肝功能相对较好的患者,即使伴有肾衰竭仍是TIPS治疗的适应证。目前尚无公认、统一的TIPS的适应证标准,随着分流支架结构和材料的进步,血管介入与消化内科在肝硬化治疗上的深入融合,将进一步更新门脉高压治疗的新理念。TIPS联合GCVE是治疗肝硬化门静脉高压症,尤其是上消化道出血安全有效的方法,具有安全性好、止血效果确切、再出血率更低、可重复操做等优点,可作为肝硬化门静脉高压急性上消化道出血的首选治疗方法之一。本研究的不足之处在于病例数较少,有待于增加样本量,对TIPS术后的中远期影响因素和疗效评价,如不同Child-Pugh分级患者术后存活率、肝性脑病发生率等临床问题有待于今后进行更加深入研究。
[1]徐克,腾皋军.Abrams介入放射学[M].北京:人民卫生出版社,2010:512-523.
[2]原姗姗,韩国宏,樊代明.TIPS治疗门静脉高压并发症预后评价的现状[J].介入放射学杂志,2011,20:245-248.
[3]蒋明德,秦建平.TIPS的临床应用再评价[J].世界华人消化杂志,2003,11:1989-1992.
[4]李京雨,徐力扬,张强,等.肝血管性疾病门静脉高压的介入性诊断与治疗[J].临床肝胆病杂志,2011,27:643-646.
[5]张金山,王茂强,杨立,等.经颈静脉肝内门腔静脉内支架分流术的临床应用(附80例随访分析)[J].中华放射学杂志,1994,28:800-807.
[6]Deleve LD,Valla DC,Garcia-Tsao G,et al.Vascular disorders of the liver[J].Hepatology,2009,49:1729-1764.
[7]Boyer TD,Haskal ZJ,American Association for the Study of Liver Diseases.The role of transjugular intrahepatic portosystemic shunt(TIPS)in the management of portal hypertension:update 2009[J].Hepatology,2010,51:306.
[8]Tesdal IK,Filser T,Weiss C,et al.Transjugular intrahepatic portosystemic shunts:adjunctive embolotherapy of gastroesophageal collateral vessels in the prevention of variceal rebleeding[J].Radiology,2005,236:360-367.
[9]胥莹,李迎春,郭涛,等.肝硬TIPS患者术后再出血分析[J].胃肠病学杂志,2011,16:551-553.
[10]唐承薇,李肖.肝硬化门静脉高压治疗策略[J].中国实用内科杂志,2011,31:79-80.
[11]李常青,许东海,徐道振,等.门静脉穿刺造影改良经颈静脉肝内门体分流术治疗门静脉高压上消化道出血[J].中华肝脏病杂志,2005,13:403-406.
[12]Gaba RC,Khiatani VL,Knuttinen MG,et al.Comprehensive review of TIPS technical complications and how to avoid them[J].Am J Roentgenol,2011,196:675-685.
[13]李灵敏,肖天利,廖化禹,等.经颈静脉肝内门体分流术对进展期肝硬化患者肝功能影响[J].第三军医大学学报,2010,32:2235-2238.
