经肝动脉化疗栓塞与射频消融和无水乙醇注入对大肝癌的疗效评价及预后分析
2013-06-23孟庆雯李勇胡宝山邵培坚占美晓赵岩黄建文何旭陆骊工
孟庆雯,李勇,胡宝山,邵培坚,占美晓,赵岩,黄建文,何旭,陆骊工
原发性肝细胞癌(HCC)是严重危害人类健康的疾病之一。大多数患者就诊时已属中晚期,失去手术机会,所以肝动脉化疗栓塞(TACE)、局部消融等介入治疗成为首选。大肝癌(肿瘤直径≥5 cm)由于自身的特殊性,就诊时大多已发生压迫或侵犯管道系统,手术切除的难度较大等[1],目前尚无标准的治疗方式。当前针对大肝癌的治疗手段,主要有TACE、射频消融(RFA)、微波消融(MWA)、肝内无水乙醇注入术(PEI)等。已有报道显示TACE联合RFA、或PEI、或MWA能提高疗效[2-4]。我们回顾性分析了92例大肝癌患者采用不同治疗方式后的临床效果、生存时间及预后因素。
1 材料与方法
1.1 病例基本情况
1.1.1 入选标准均需具备下列条件:①诊断为HCC,且肿瘤直径大于5 cm;②肝功能Child-Pugh A或B级;③入组后只单独或联合接受TACE、RFA、PEI 3种介入治疗方式;④病历及随访资料完整。
1.1.2 排除标准具下列之一者:①入组后接受过除TACE、RFA、PEI 3种治疗方式外的其他治疗措施;②有门脉主干癌栓。
2006年1月—2010年12月纳入原发性大HCC患者92例。78例病理确诊为HCC,14例结合患者病史、体征、AFP及影像学检查作出临床诊断。其中男78例,女14例,有乙型肝炎(乙肝)的患者44例(47.8%),有肝硬化的患者17例(18.5%)。67例肝内肿瘤为单发病灶,41例有门脉癌栓(44.6%),肿瘤病灶直径为(6.4~19.2)cm,平均为12.3 cm。根据肝功能Child-Pugh分级标准,A级69例,B级23例。根据BCLC分期,B级52例、C级40例。在既往治疗中,其中21例为外科切除术复发性HCC。
1.2 方法
1.2.1 分组情况回顾性分析92例大肝癌患者,按照治疗方式的不同分为:①TACE联合RFA组(Ⅰ组):15例男性患者,先行TACE后再行RFA,年龄31~76岁,平均(51±14)岁,术前肿瘤最大径为(12.2±2.9)cm;②TACE联合PEI组(Ⅱ组):29例,先行TACE后再行PEI,其中男23例,女6例,年龄19~73岁,平均(46±14)岁,术前肿瘤最大径为(12.5±2.5)cm;③TACE、RFA联合PEI组(Ⅲ组):21例,先行TACE后再行RFA,后以PEI巩固效果,其中男17例,女4例,年龄38~91岁,平均(55±11)岁,术前肿瘤最大径为(12.8±3.2)cm;④TACE组(Ⅳ组):27例,单纯行TACE,其中男23例,女4例,年龄27~77岁,平均(55±15)岁,术前肿瘤最大径为(11.4±3.1)cm。其中TACE一般行1~5次,RFA行2~5次,PEI行1~2次。4组一般临床资料及肿瘤情况差异无统计学意义。
治疗前所有病例均常规进行血液学检查(血常规,肝肾功能、肿瘤标志物、凝血检查、乙肝等)、影像学检查(胸部X线、腹部CT增加),术前均签署知情同意书。
1.2.2 TACE方法采用Seldinger技术于腹腔动脉或肝动脉选择性造影,明确肿瘤位置、供血动脉、大小、数目、性质等情况,再用微导管超选择肿瘤供血动脉,然后注入化疗药物(氟尿嘧啶类、丝裂霉素类、阿霉素类、铂类),一般以2~3种药物联合应用,并用超液态碘油5~20 ml和阿霉素40~60 mg制成混悬液,经导管由肿瘤供血动脉注入以栓塞瘤灶。栓塞剂剂量根据造影显示肿瘤的大小及血管富乏程度而定。
1.2.3 RFA方法采用美国RITA1500型肿瘤RFA治疗仪,发射频率为400 kHz,功率为1~250 W。综合患者的基本情况、病灶位置、肿瘤大小等确定射频参数及选择合适的路径。因大肝癌肿瘤直径较大,在治疗过程中应及时调整消融电极的位置多针重叠、多次叠加治疗,整个消融范围应超过病变区0.5~1.0 cm,以保证肿瘤组织充分坏死。
1.2.4 PEI方法在超声、X线透视或CT引导下用一次性穿刺细针,经皮肝穿刺入目标肿瘤病灶,缓慢注入碘油乙醇混合物(1∶3),根据肿瘤大小,分别注入5~30 ml,以病灶完全被浸润为准则。
1.2.5 疗效评价首次TACE术后复查血常规、肝肾功能、AFP、腹部CT或MRI。后每3个月复查血液指标及腹部CT或MRI。根据肿瘤坏死及有无复发等情况,决定是否有必要再次行介入治疗。由影像学检查(CT、MRI)判定肿瘤的坏死程度。肿瘤最大直径缩小10%为肿瘤缩小,反之则判定为未缩小;根据腹部CT或MRI平扫及增强,如病变区无强化,且造影时未见肿瘤染色,则判定为完全坏死,反之则判定为不完全坏死,肿瘤有残留病灶。
1.3 统计学分析
采用SPSS13.0统计软件,连续变量资料采用均数±标准差表示。计数资料采用卡方检验比较其分布差异,采用Kaplan-Meier计算生存时间,采用Cox回归计算影响总生存时间(OS)的预后因素,以P<0.05为差异有统计学意义。
2 结果
2.1 92例大肝癌患者临床基线资料
经卡方检验,4组病例的主要临床资料差异无统计学意义,提示4组病例分组均衡。

表192 例大肝癌患者的主要临床资料(例)
2.2 4种治疗方式肿瘤缩小率及肿瘤坏死率的比较
4组治疗方式临床效果比较,在肿瘤缩小率及肿瘤坏死率存在统计学差异(P=0.008,P=0.026)(表2)。TACE、RFA联合PEI组在肿瘤缩小率及肿瘤坏死率均显著高于另3组。
2.3 4种治疗方式OS比较
4组治疗方式相比,OS相比,差异有统计学意义(P=0.00)。其中Ⅲ组的OS最长,显示针对大肝癌患者TACE、RFA联合PEI这种治疗方式的总生存时间最长(表3,图1)。
2.4 影响大肝癌患者OS预后的单因素及多因素分析
预后因素分析:将单因素分析得出具有统计学意义的指标(门脉癌栓、术前AFP值)纳入多因素分析显示门脉癌栓及术前AFP值是影响OS的预后因素(P=0.028,P=0.031),见表4、5。
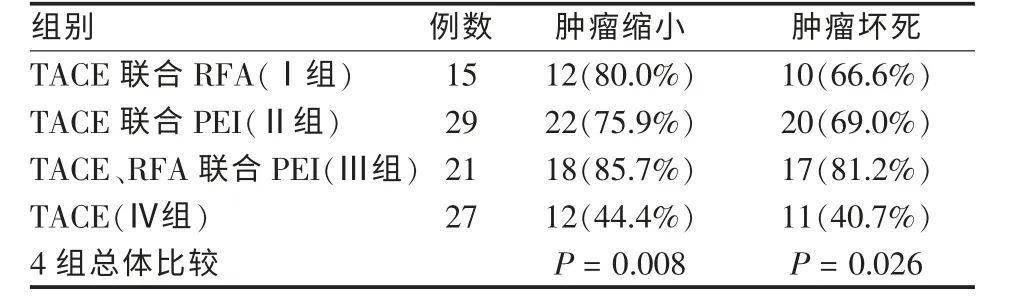
表24 组治疗方式在肿瘤缩小率的比较

表34 组治疗方式总生存时间比较
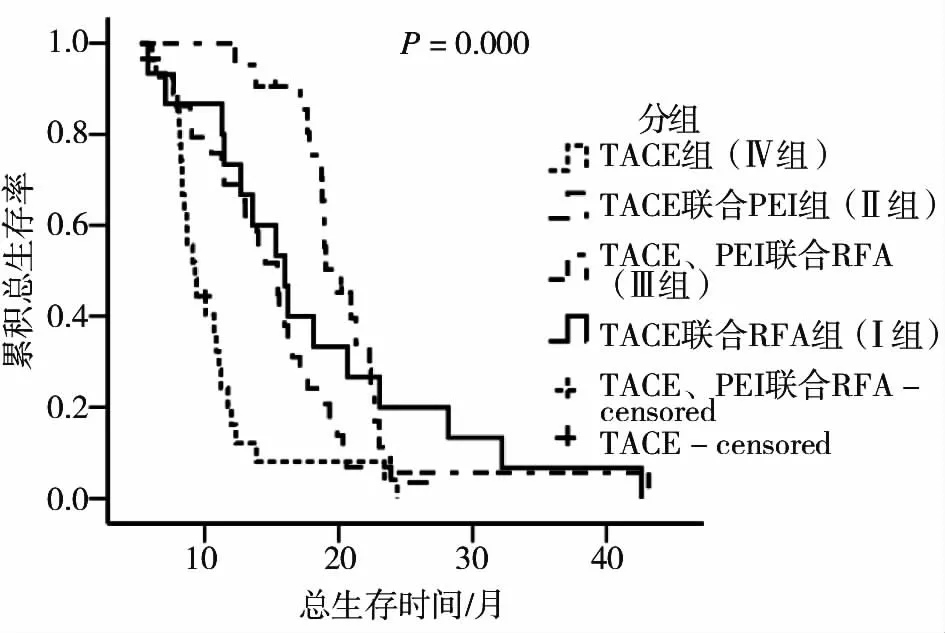
图14 种治疗方式OS的比较

表4 单变量分析影响大肝癌患者OS预后的因素

表5 多变量分析影响大肝癌患者OS预后的因素
3 讨论
大肝癌是临床治疗的难点。近年来,以TACE、RFA、PEI等介入治疗在大肝癌治疗中备受推崇。但单纯TACE治疗大肝癌的坏死率较低,术后肿瘤残余及复发率较高,且由于病灶较大,需要的化疗栓塞药物剂量较大,可能加重损坏患者肝功能,严重者易激发肝功能衰竭而导致死亡[5]。
RFA具有见效快、彻底、可重复操作等优点,但其疗效与肿瘤病灶所在的位置、肿瘤血流密切相关。RFA常用于直径≤3 cm的肝肿瘤,而对于体积较大、且靠近大血管的肿瘤受“热沉效应”的影响则容易致消融时热量的散失,导致肿瘤残留。因此,单纯RFA治疗大肝癌,术后完全坏死率低,临床疗效未得到广泛认同[6-8]。
PEI的疗效与肿瘤组织类型、有无包膜有关。对于肿瘤病灶较大,尤其是瘤内纤维间隔的影响,再加上乙醇弥散的不可控性和渗透能力有限,常需多次、大剂量注入,才能达到理想效果,这样就增加了不良反应及发生并发症的可能性。
理论上,TACE、RFA联合PEI这3种治疗方式的联合能够优势互补。这是因为:大肝癌肿瘤病灶经TACE后大部分不能完全坏死。联合RFA可使残留的肿瘤组织进一步坏死,尤其对于乏血供的肿瘤组织,RFA可直接通过离子摩擦产热使肿瘤细胞坏死,加强了TACE术后的疗效。同时,先行TACE通过对阻塞肝肿瘤血管,减少了肝动脉内血流的“热沉效应”,也缩短了射频时间。但RFA也有自身的局限性,对位于血管旁及肝门部等的病灶,热消融可能会引起穿孔。而无水乙醇的液体渗透性和弥散性,可浸润血管旁及肝门部病变。且由于先行了TACE及RFA,瘤内纤维间隔分解、阻抗力减低使得肿瘤内乙醇的弥散分布更容易,因此,TACE、RFA及PEI三者联合疗效较好[9-11]。
本研究也证实了这一理论:TACE、RFA联合PEI,与TACE联合RFA/PEI及单独TACE这3种治疗方式相比,其肿瘤缩小率、坏死率、OS均明显高于其他3组,且具有统计学差异,这与文献报道一致[10]。
单纯TACE治疗并发门脉癌栓的HCC效果并不理想,而联合RFA治疗则可提高完全坏死率。已有文献报道,对门脉癌栓的近心端进行RFA,对门脉癌栓的控制率可高达70%,RFA使近心端的癌栓缺血坏死,阻止了门脉癌栓进一步向主干及其他分支发展[12]。同时联合PEI,无水乙醇注入门静脉后能充分渗透至整个癌栓周边,通过无水乙醇的作用,导致凝固性坏死,从而促进癌栓的坏死。因此,针对门脉癌栓,TACE、RFA联合PEI联合治疗方式明显优于其他方式,这也与文献报道一致[13]。
综上所述,采用TACE、RFA联合PEI治疗方式并没有增加不良反应,既可显著提升肿瘤缩小率及坏死率,又延长患者的生存预后,大大优于TACE联合RFA/PEI或单纯TACE这3种治疗方式,是目前较为适合的联合治疗方式。
[1]汤衍斌,林增海,马涛.大肝癌治疗的临床研究现状[J].临床合理用药杂志,2012,05:171-172.
[2]Gao F,Gu YK,Fan WJ,et al.Evaluation of transarterial chemoembolization combined with percutaneous ethanol ablation for large hepatocellular carcinoma[J].World J Gastroenterol,2011,17:3145-3150.
[3]帕哈尔丁·白克热,杨树法,黄伍奎,等.肝动脉化疗栓塞联合射频消融术治疗30例原发性大肝癌的疗效评价[J].介入放射学杂志,2012,21:322-326.
[4]孙贤俊,何胜利,陈颢.射频消融治疗大肝癌疗效的临床研究现状[J].中西医结合肝病杂志,2011,21:123-126.
[5]Kirikoshi H,Saito S,Yoneda M,et al.Outcome of transarterial chemoembolization monotherapy,and in combination with percutaneous ethanol injection,or radiofrequency ablation therapy for hepatocellular carcinoma[J].Hepatol Res,2009,39:553-562.
[6]方志雄,程丹,方志宏,等.肝动脉化疗栓塞联合射频消融治疗大肝癌疗效评价[J].中华临床医师杂志:电子版,2012,06:2823-2825.
[7]赵明,王健鹏,吴沛宏,等.TACE与TACE联合RFA治疗中晚期原发性肝癌167例临床对比分析[J].中华医学杂志,2010,90:2916-2921.
[8]Veltri A,Moretto P,Doriguzzi A,et al.Radiofrequency thermal ablation(RFA)after transarterial chemoembolization(TACE)as a combined therapy for unresectable non-early hepatocellular carcinoma(HCC)[J].Eur Radiol,2006,16:661-669.
[9]刘德鑫,李华东,李新丰,等.肝动脉栓塞化疗联合射频及无水乙醇注射治疗中晚期肝癌的评价[J].介入放射学杂志,2009,18:389-391.
[10]张福君,吴沛宏,赵明,等.肝动脉栓塞化疗后射频消融联合酒精消融对原发性肝癌的疗效评价[J].中华肿瘤杂志,2005,27:248-250.
[11]Kurokohchi K,Hosomi N,Yoshitake A,et al.Successful treatment of large-size advanced hepatocellular carcinoma by transarterial chemoembolization followed by the combination therapy of percutaneous ethanol-lipiodol injection and radiofrequency ablation[J].Oncol Rep,2006,16:1067-1070.
[12]Giorgio A,de Stefano G,Di Sarno A,et al.Radiofrequency ablation of hepatocellular carcinoma extended into the portal vein:Preliminary results[J].J Ultrasound,2009,12:32-37.
[13]郑加生,孙斌,生守鹏,等.合并门静脉癌栓的原发性肝癌的综合介入治疗[J].中国介入影像与治疗学,2011,08:86-89.
