成年缺血性烟雾病脑梗死的分布模式及侧支循环特点
2013-06-23高红华高连波文佳媚
高红华,高连波,文佳媚
陈诚军,许剑峰,陈跃光,董健,归冬梅,张大东
烟雾病又称脑底异常血管网病,是一种特殊类型的、慢性进展性脑血管病。以双颈内动脉末端及其大分支进行性狭窄或闭塞,伴颅底异常新生血管网为特征。随着神经影像学的发展及对脑血管病病因认识的提高,临床中发现越来越多的烟雾病患者。由于Willis环构成动脉的长期慢性缺血以及因血流紊乱产生的剪切力,烟雾病患者常存在不同类型的侧支循环[1],其脑卒中的模式同样也表现为多态性[2]。DSA对烟雾病的诊断价值已有报道[3],本文拟通过DWI及DSA对烟雾病性急性脑梗死患者的结构影像学及血管影像学进行综合分析,进一步探索烟雾病性脑梗死的发病机制及不同分期侧支循环的特点。
1 对象与方法
1.1 对象
2009年1月—2012年12月,我院脑血管病中心收治急性脑梗死患者34例,其中女20例,男14例,年龄23~63岁,平均(43.4±12.1)岁。所有患者入院时均行MRI及MRA检查,DWI证实为急性脑梗死,MRA显示双颈内动脉末端病变,于24 h内行DSA检查。34例中,有高血压史22例,病程3个月~20年;口服减肥药物史2例;脑梗死病史8例,短暂性脑缺血发作史6例,患者首发症状年龄为23~59岁,平均年龄(41.5±10.4)岁;吸烟史8例;大量饮酒史2例。
1.2 入组和排除标准
入选标准:①年龄≥16岁;②DSA或MRA显示颈内动脉末端和(或)大脑前动脉(ACA)和(或)大脑中动脉(MCA)起始部狭窄或闭塞;③脑内异常血管网;④双侧病变。
排除标准:①存在其他动脉粥样硬化危险因素:高血压、糖尿病、高血脂、吸烟史,DSA显示存在颅外动脉粥样硬化改变;②合并其他疾病:自身免疫性疾病,脑膜炎,脑肿瘤,唐氏综合征,头部放射,脑外伤,镰状细胞贫血,其他导致烟雾现象或烟雾综合征的病因。
1.3 DWI梗死灶分类
采用1.5T GE Signal MR扫描仪,根据Tatu等[4]制定的血管供应区域,将急性梗死病灶分为3种类型:皮层梗死、分水岭梗死、穿支动脉梗死。分水岭梗死又分为前分水岭梗死、后分水岭梗死和皮质下分水岭梗死。记录每例患者DWI上显示的梗死类型及具体部位。
1.4 DSA检查
使用GE Innova血管造影机进行DSA检查,为全面观察代偿模式,颈内动脉及颈外动脉造影时超选。由2名神经介入医师在机动态评估并记录DSA分期及侧支循环开放情况。因入组病例为初诊患者,缺乏连续、系列的可以反映疾病动态演变的造影片,故本研究采用2002年日本学者Mugikura等[5]在Suzuki分期基础上提出的精简分期,用以评估每个受累大脑半球同侧的血管级别,即1期(相当于Suzuki的1~2期):颈内动脉末端轻或中度狭窄,伴或不伴颈内动脉烟雾状血管,ACA或MCA全部分支显影良好;2期(相当于Suzuki的3期):颈内动脉末端重度狭窄,ACA或MCA起始段闭塞伴明显的颈内动脉烟雾状血管,ACA或MCA分支至少有几个分支显影良好;3期(相当于Suzuki的4期):MCA和ACA均闭塞,有明显的颈内动脉系统烟雾血管,仅有少量的ACA或MCA分支通过烟雾血管前向微弱显影;4期(相当于Suzuki的5~6期):MCA和ACA起始部完全闭塞,伴或不伴颈内动脉系统烟雾血管,前向造影中没有ACA或MCA显影。1期为烟雾病早期,2~3期为中期,4期为晚期。
依据以往侧支循环相关文献[6],将侧支循环分为3级。1级侧支:ACA→软脑膜动脉→MCA、MCA→软脑膜动脉→ACA。2级侧支:脉络膜动脉延长或扩张、后交通动脉→大脑后动脉(PCA)→软脑膜动脉→ACA或MCA、PCA→软脑膜动脉→ACA或MCA、脉络膜后动脉→胼周后动脉→ACA。3级侧支:颈外动脉侧支。
1.5 统计学方法
采用SPSS13.0软件进行统计学分析。计量资料进行正态分布检验,符合正态分布者,采用均数±标准差(±s)表示。各解剖区域梗死分布用百分率表示。等级资料采用Mann-Whitney U检验,P<0.05为差异有统计学意义。
2 结果
2.1 DWI梗死分布情况
34例急性脑梗死患者DWI显示共累及42个大脑半球,4例为双侧大脑半球病变,4例为双侧病变伴脑干梗死。42个大脑半球发生脑梗死的类型及分布见图1~3和表1。

表1 急性脑梗死的类型及分布(例)
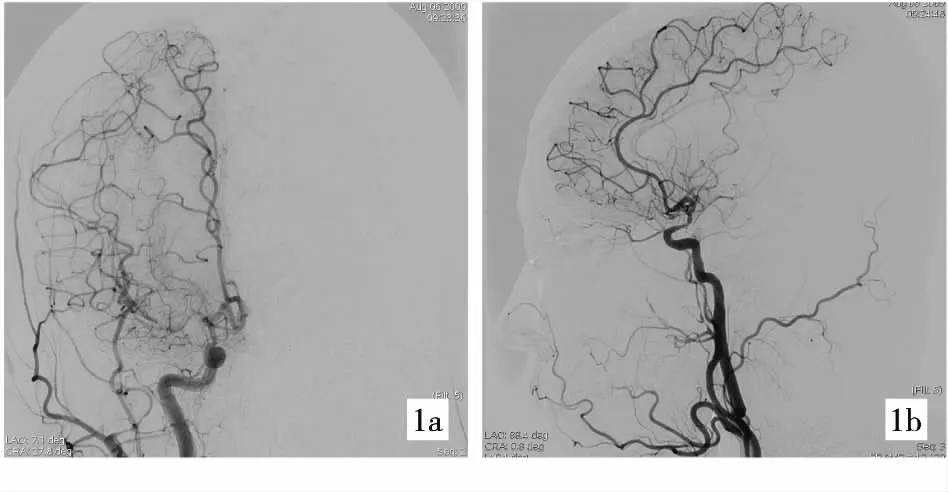
图1 DSA示右侧ICA末端(1a)及右侧MCA M1段狭窄(1b)伴新生毛细血管

图2 DSA示左侧ICA末端狭窄伴C7段动脉瘤性扩张(2a)和MCA M1段闭塞伴新生毛细血管(2b)
2.2 急性脑卒中同侧侧支循环代偿模式
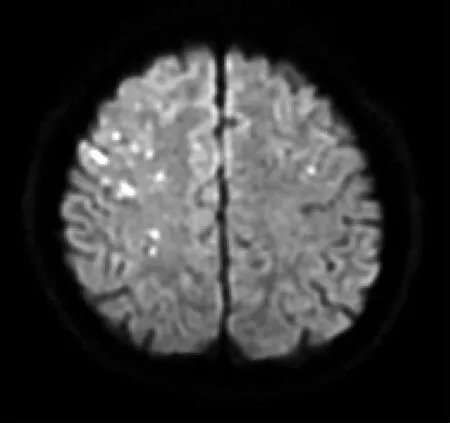
图3 DWI示双顶叶皮层多发急性梗死
对42个受累半球的血管床进行评估。DSA显示同侧侧支循环代偿情况如下:1级侧支:共23个,ACA→软脑膜动脉→MCA 22个,MCA→软脑膜动脉→ACA 1个;2级侧支:共29个(下列各通路同时出现≥2个时,只计数为1),脉络膜动脉延长或扩张6个、后交通动脉→PCA→软脑膜动脉→ACA或MCA 19个、PCA→软脑膜动脉→ACA或MCA或脉络膜后动脉→胼周后动脉→ACA 24个;3级侧支:同侧颈外动脉之脑膜中动脉、颞浅动脉经软脑膜动脉与MCA吻合3个。
2.3 DSA不同分期的侧支循环开放情况
34例急性脑梗死患者的42个受累大脑半球,DSA显示急性梗死半球Mugikura 1~4期所占比例分别为:1期21.43%(9个),2期40.47%(17个),3期19.05%(8个),4期19.05%(8个)。42个脑卒中受累半球同侧的各级侧支循环共55个,各期侧支循环的开放情况见表2。
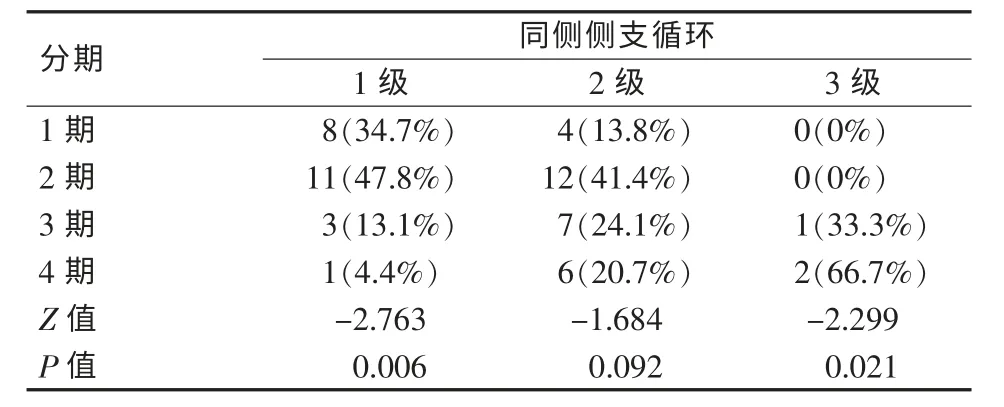
表2 DSA不同分期的侧支循环开放情况
3 讨论
2009年日本的一项调查显示,烟雾病的患病率为10.5/100 000,年发病率为0.94/100 000,女∶男=2.18,症状发生的2个高峰分别为45~49岁及5~9岁[7]。中国目前的数据与亚洲其他国家有所差异,男性多于女性(1.16∶1),成年烟雾病的发病率高于儿童(3.5∶1)[8],这些差异可能来源于数据中包括了一些烟雾综合征的患者,以及小儿神经科在中国还不普遍[9]。本研究纳入烟雾病患者34例,女∶男=1.43,女性多于男性,首发症状年龄为23~59岁,中位年龄42岁,与国外文献报道基本一致。这些患者中既往有高血压病史者22例,占64.71%,但DSA显示颅外动脉正常,双侧颈内动脉末端及远端血管病变也并非高血压所致的粥样硬化改变,这提示烟雾病可能与高血压并存,或者后者为前者的结果。
烟雾病的脑卒中模式具有多样性。本研究34例患者发生42处大脑半球梗死。过去普遍认为烟雾病患者的缺血事件为严重低灌注所致[10]。本组资料显示,烟雾病性脑梗死以中期(Mugikura 2~3期)多见(所占比例59.52%)。病灶模式以皮层梗死与分水岭梗死最常见(均为71.4%),其中皮层病变以顶叶多见(93.3%),分水岭梗死以皮质下分水岭为多(93.3%),二者均为受累的MCA和/或ACA的供血区域,提示烟雾病患者急性脑梗死的发病机制中有动脉-动脉栓塞及低灌注/栓子清除障碍共同参与。已有病理研究显示,狭窄的颈内动脉和MCA管壁以及扩张的烟雾血管内可见血栓,成分为纤维蛋白和血小板,为动脉内栓子的来源[11]。尽管目前还未发现任何药物可以有效地阻止烟雾病的病情进展,但对其发病机制认识的深入,有助于指导急性期的药物治疗,扩容基础上的抗血小板聚集治疗或有裨益。
烟雾病患者病程中脑血管新生和侧支循环形成的变化贯穿始终。新近研究一致认为烟雾病的预后与相关的侧支循环息息相关[12]。本研究显示,随着烟雾病缺血分期的增高,l、2级侧支循环呈现先增多、后减少的趋势,主要集中于烟雾病的中期,所占比例分别为60.9%和65.5%,1级侧支的差异具有统计学意义(Z=-2.763,P<0.01),2级侧支的差异无显著性(Z=-1.684,P=0.092)。3级侧支循环则出现于烟雾病晚期。考虑其原因,随着烟雾病的进展,颈内动脉末端由狭窄至闭塞,并向其近端扩展,脑血流动力学紊乱的加重和剪切力的增加,促进了侧支循环的出现与开放,所以1、2级侧支循环从早期到中期呈现增多趋势。而到了晚期,病变进展至眼动脉以远闭塞,并累及PCA,1,2级侧支势必受影响,取而代之的是颈外动脉侧支。侧支循环的变化规律反映了烟雾病患者颅内血管病变进展的程度,也是病变进展的必然结果。对于不同分期、不同级别侧支循环的代偿能力尚需进一步的评价。
[1]Liu W,Zhu S,Wang X,et al.Evaluation of angiographic changes of the anterior choroidal and posterior communicating arteries for predicting cerebrovascular lesions in adult moyamoya disease[J].J Clin Neurosci,2011,18:374-378.
[2]胡琦,康慧聪,陈琳,等.MMD脑卒中部位的分布特征及其机制[J].中华神经科杂志,2009,42:745-748.
[3]范新华,黄祥龙,刘林祥.Moyamoya病数字减影血管造影的诊断价值[J].介入放射学杂志,2005,14:116-118.
[4]Tatu L,Moulin T,Bogousslavsky J,et al.Arterial territories of the human brain:cerebral hemispheres[J].Neurology,1998,50:1699-1708.
[5]Mugikura S,Takahashi S,Higano S,et al.Predominant involvement of ipsilateral anterior and posterior circulations in moyamoya disease[J].Stroke,2002,33:1497-1500.
[6]Liu W,Xu G,Yue X,et al.Hyperintense vessels on FLAIR:a useful non-invasive method for assessing intracerebral collaterals[J].Eur J Radiol,2011,80:786-791.
[7]Baba T,Houkin K,Kuroda S.Novel epidemiological features of moyamoya disease[J].J Neurol Neurosurg Psychiatry,2008,79:900-904.
[8]Liu J,Zhao W,Wang W.Moyamoya disease in China[M]//Cho BK,Tominaga T,eds.Moyamoya Disease Update,Tokyo,Berlin,Heidelberg,New York,Springer,2010:370-373.
[9]Takahashi JC,Miyamoto S.Moyamoya disease:recent progress and outlook[J].Neurol Med Chir(Tokyo),2010,50:824-832.
[10]Kim JM,Lee SH,Roh JK.Changing ischaemic lesion patterns in adult moyamoya disease[J].J Neurol Neurosurg Psychiatry,2009,80:36-40.
[11]Takagi Y,Kikuta K,Nozaki K,et al.Histological features of middle cerebral arteries from patients treated for Moyamoya disease[J].Neurol Med Chir(Tokyo),2007,47:1-4.
[12]Scott RM,Smith ER.Moyamoya disease and moyamoya syndrome[J].N Engl J Med,2009,360:1226-1237.
