超细ZnFe2O4纳米晶与蛋白质的相互作用
2013-06-14姬晓旭黄新堂
李 强 姬晓旭 钟 秋 黄新堂*, 熊 丽*,
(1华中师范大学纳米科技研究院,武汉 430079)(2南阳师范学院物理与电子工程学院,南阳 473061)(3湖北省遗传调控与整合生物学重点实验室,华中师范大学生命科学学院,武汉 430079)
蛋白质分子与纳米颗粒的相互作用会对纳米颗粒的生物学性质产生显著影响。当纳米颗粒接触到生物体后,蛋白质分子有可能在纳米颗粒表面建立起动态的吸附-脱附平衡,从而形成Protein Corona[1]。研究表明Protein Corona不仅对纳米颗粒的生物安全性、毒性、细胞的识别和吞噬、体内分布等多种生物学性质产生重大影响[2-4],而且也会影响到纳米颗粒在生物或医学领域的应用,例如,纳米颗粒用于蛋白质分离[5-8]、蛋白质分子对纳米表面的修饰[9-15]、纳米材料的制备[16-19]、蛋白质分子与纳米材料之间的电子传递及其在电化学传感器领域的应用[20-23]以及生物分析[7,24]等多个领域都与纳米颗粒与蛋白质分子的相互作用性质有关。因此,研究纳米颗粒与蛋白质分子的相互作用及其相关机理正越来越引起学者们的广泛关注[25-31]。很多研究表明,纳米颗粒主要通过纳米表面与蛋白质分子之间的作用力与蛋白质分子发生相互作用,例如,静电相互作用、疏水相互作用、范德华力等[1-2]。其中静电相互作用是纳米颗粒与蛋白质之间的一种很重要的相互作用方式。在实验方面,ζ电势不仅反映纳米颗粒或蛋白质分子的带电状态,而且还可以通过溶液pH值的调节来改变[32]。通过研究在不同pH值条件下纳米颗粒对蛋白质分子的吸附量及其与ζ电势的关系,可以推断出它们的相互作用机理。如果纳米颗粒与蛋白质分子的ζ电势符号相反时才能观察到蛋白质吸附现象,则表明静电相互作用是主要的作用力,否则,其他因素将起主要作用[33]。蛋白质分子与纳米颗粒的相互作用还会影响到蛋白质的构象以及纳米颗粒的流体动力学直径,在实验方面可以通过FTIR光谱和DLS技术分别进行研究[1]。
作为铁氧体类材料中的重要一员,ZnFe2O4纳米材料不仅在传感器[34-35]、光催化[36]、能源[37]等领域有潜在的应用,而且在生物医学领域也有广泛的应用,例如,ZnFe2O4纳米颗粒用于磁共振成像[38]、生物分析[39]等。但是,ZnFe2O4纳米颗粒与蛋白质分子的相互作用性质却研究的较少,因而有必要考察ZnFe2O4纳米颗粒与蛋白质分子的相互作用及其机理,这将进一步促进这类材料在相关领域的应用。本研究通过水热法制备了单分散的超细ZnFe2O4纳米晶(约10 nm),并对其进行了表征。为了研究与蛋白质分子的相互作用,以BSA和牛血红蛋白为模式蛋白,在不同的pH条件下考察纳米晶对蛋白质的吸附性质及其与纳米晶和蛋白质的ζ电势之间的关系。此外,还研究了纳米晶吸附蛋白质分子后DLS粒径的变化以及蛋白质构象的变化。为进一步揭示ZnFe2O4纳米晶与蛋白质分子相互作用机理提供必要的参考。
1 实验部分
1.1 试 剂
实验所用试剂FeCl3·6H2O、ZnCl2均为分析纯,购自国药集团化学试剂有限公司;考马斯亮蓝G250,BSA和牛血红蛋白均购自Sigma公司;实验用水为Millipore制备的去离子水(18.2 MΩ·cm)。
1.2 ZnFe2O4纳米晶的制备
将 10 mmol FeCl3·6H2O 和 5 mmol ZnCl2溶解于50 mL去离子水中,在磁力搅拌的过程中用氨水调节pH值为8.0,然后装入80 mL的高压釜中,在190℃的温度下水热反应10 h。反应结束后,将所得的沉淀用去离子水清洗3遍,然后在60℃烘箱中干燥以备后续实验所用。
1.3 ZnFe2O4纳米晶的表征
所得产物的物相结构用PANalytical X′Pert Pro粉末X射线衍射仪进行分析。参数为Cu Kα射线λ=0.154 06 nm,扫描范围 10°~80°,步长 0.026°。纳米晶的形貌用高分辨透射电子显微镜JEOL JEM-2010FEF进行观察。元素构成通过EDX方法确定(AMETEK)。
1.4 ZnFe2O4纳米晶对BSA和牛血红蛋白的吸附实验
以10 mmol·L-1的乙酸钠缓冲液为溶剂,配制2 mL反应液,其中蛋白质(BSA或牛血红蛋白)浓度为0.5 mg·mL-1,ZnFe2O4纳米晶浓度分别为 1、2、3、4和5 mg·mL-1。为了研究pH值的影响,实验分别在pH值为4.8、5.5、7.0和8.0的条件下进行。反应液振荡 2 min 后,经过 10 000 r·min-1,3 min 的离心除去纳米晶,上清液中蛋白质浓度用Bradford方法检测。蛋白质的吸附率通过公式(c0-ce)/c0×100%进行计算,其中c0为蛋白质的原始浓度,ce为反应后的蛋白浓度。蛋白质的吸附容量(mg蛋白质/g纳米晶)通过公式[(c0-ce)/cnano]×1 000进行计算,其中cnano为纳米晶的浓度。
蛋白质及纳米晶在不同的pH条件下的ζ电势通过Marlven zen3690仪器测量得到。为了研究蛋白质吸附对纳米晶DLS粒径的影响,纳米晶吸附蛋白质前后的DLS粒径同样在Marlven zen3690仪器上测得。
1.5 FTIR光谱法分析纳米晶对蛋白质构象的影响
将吸附了蛋白质的纳米晶用去离子水清洗3遍以除去缓冲液成分,然后在-60℃充分冷冻干燥以除去水分。FTIR光谱分析采用KBr压片法,约1%的样品与KBr混合研磨,然后压片,在FTIR光谱仪Avatar 360上测定红外光谱。作为对比,纯的BSA、牛血红蛋白和纳米晶的FTIR光谱用同样的方法测定。
2 结果与讨论
2.1 ZnFe2O4纳米晶的表征
图1c为纳米晶的XRD衍射图,可以看出所有的衍射峰对应于尖晶石结构的ZnFe2O4(PDF No.22-1012),无其他杂峰出现。EDX结果(图1d)表明纳米晶的元素构成为Zn、Fe和O,而且Zn与Fe的原子比为12正好符合化学式ZnFe2O4中的Zn与Fe的原子比例。图1a显示的是纳米晶在TEM下的形貌,可以看出纳米晶为球形,尺度在10 nm左右,形貌均一。在HRTEM照片(图1b)中可以清晰的看到纳米晶的晶格,经测量晶格间距为0.300 nm正好对应于XRD中晶面(220)的衍射峰。综合以上的结果,本实验制备的样品为直径约10 nm,尖晶石型的ZnFe2O4纳米晶。
水热法是制备铁氧体类纳米材料的有效方法,并且已经有了比较深入的研究[40-42]。在制备时,先将氯化铁和氯化锌溶于水中使得Fe3+和Zn2+离子在原子层面均匀混合,然后加入碱源使金属离子共沉淀成混合均匀的Fe(OH)3和Zn(OH)2溶胶。由于热力学的原因,在室温下不能生成ZnFe2O4晶相,只有在高温水热条件下ZnFe2O4晶相的生长才成为一个自发的过程[41]。当水热温度超过100℃时,开始出现ZnFe2O4晶相,随着水热反应温度的升高纳米晶的尺度逐渐增大,反应温度为200℃时纳米晶的尺度约为10 nm,在300℃时达到30 nm;反应的最初2 h里,纳米晶的成核与生长过程共存,2 h之后,纳米晶经历一个Ostwald熟化过程,粒径逐渐稳定,不再随着反应时间的延长而增大[42]。本研究在190℃条件下,经过10 h的水热反应制备出了约10 nm的ZnFe2O4纳米晶,符合文献报道的反应机理。
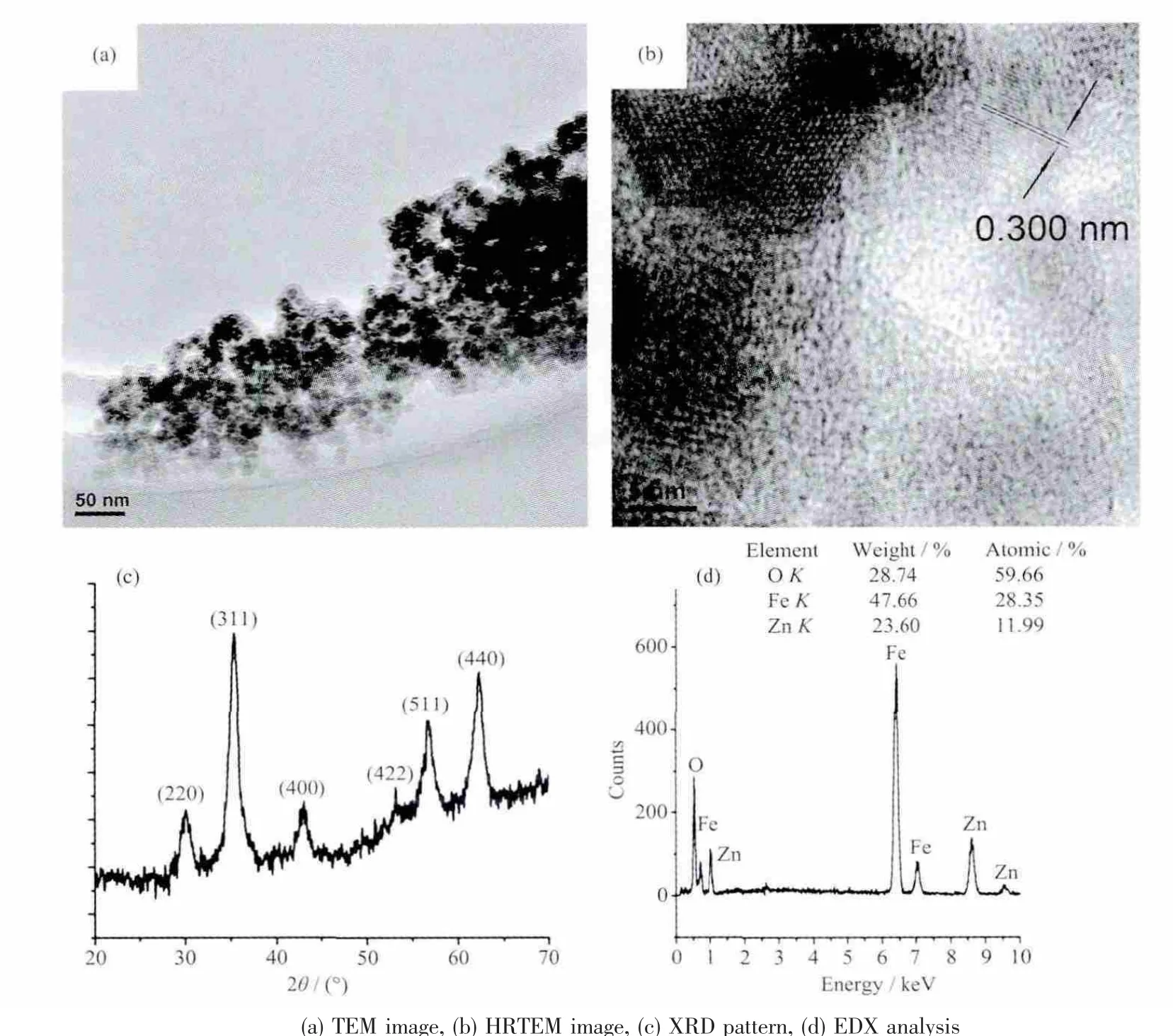
图1 ZnFe2O4纳米晶的表征Fig.1 Characterizations of ZnFe2O4nanocrystals
2.2 ZnFe2O4纳米晶对蛋白质的吸附及其与ζ电势的关系
图2是纳米晶在不同pH条件下对BSA和牛血红蛋白的吸附特征。从图2a可以看出,纳米晶对BSA有很强的吸附能力,并且和pH值有关。当浓度为1 mg·mL-1而且pH为5.5的条件下,纳米晶对BSA吸附率最高(76.5%),而在pH为4.8时吸附率最低仅有36.6%。当纳米晶的浓度超过2 mg·mL-1时,纳米晶对BSA的吸附率在所有的pH范围内都能到达100%。图2b是计算得出的BSA吸附容量与pH值之间的关系,在pH为5.5时,纳米晶的吸附容量最高达到382.8 mg·g-1,而在pH为4.8时,吸附容量为199.9 mg·g-1。为了研究纳米晶对蛋白质的吸附机理,在不同pH条件下对ZnFe2O4纳米晶、BSA和牛血红蛋白的ζ电势进行了测量(图3)。从图中可以看出,纳米晶的ζ电势在所有的pH范围内都为正,表明所带的电荷为正电荷,而且随pH值的变化不大。BSA的ζ电势随pH值的变化非常明显,在pH=4.8时为正4.5 mV,表明带正电荷,随着pH值升高ζ电势降低并且变为负值。静电相互作用是纳米颗粒与蛋白质分子之间的一种很重要的相互作用方式。由于静电相互作用具有同性电荷排斥,异性电荷吸引的性质,所以在理想的状态下,只有纳米颗粒与蛋白质分子带相反电荷时,才会出现纳米颗粒与蛋白质分子之间的吸附现象。而实验结果表明,当纳米晶与BSA所带电荷相同时(pH=4.8),纳米晶对BSA仍然有很强的吸附。此外,当纳米晶具有最高的吸附容量时(pH=5.5),纳米晶与BSA之间的ζ电势之差却不是最大(pH为5.5、7.0和8.0时,ζ电势之差分别为32.1、42.8和39.3 mV)。因此静电相互作用不能完全解释ZnFe2O4纳米晶与BSA之间的相互作用。这种违反静电相互作用规律的吸附现象可能与蛋白质分子所带电荷的空间分布不均一性有关,也可能与疏水性相互作用有关,并且在一些文献中已有所报道[33,43]。

图2 ZnFe2O4纳米晶在不同pH条件下对蛋白质的吸附性质Fig.2 Protein adsorption properties of ZnFe2O4nanocrystals at different pH values
图2c是ZnFe2O4纳米晶在不同pH条件下对牛血红蛋白的吸附率曲线。当pH为7.0或8.0时,纳米晶对牛血红蛋白有很强的吸附能力,1 mg·mL-1浓度的纳米晶能够达到高于80%的吸附率,而在pH=4.8或5.5时,纳米晶对牛血红蛋白的吸附率却非常低。图2d是计算得出的吸附容量与pH值之间的关系,再结合图3中ζ电势的结果,可以看出,当牛血红蛋白和纳米晶的ζ电势符号相同时 (pH=4.8或5.5),纳米晶对牛血红蛋白的吸附容量极低,而符号相反时(pH=7.0或8.0),吸附容量高达434.0 mg·g-1和 432.3 mg·g-1。综合分析图 2c、2d 和图 3 的结果,不难发现ZnFe2O4纳米晶对牛血红蛋白的吸附与电荷的排斥或吸引规律高度相关。所以静电相互作用是纳米晶与牛血红蛋白质之间的主要相互作用方式。

图3 纳米晶、BSA和牛血红蛋白在不同pH值下的ζ电势Fig.3 ζ potentials of nanocrystals,BSA and Hemoglobin under different pH values
2.3 ZnFe2O4纳米晶与蛋白质分子相互作用的DLS分析
DLS是研究纳米颗粒与蛋白质分子相互作用的一种有效方法。当检测激光照射到纳米颗粒表面时,由于纳米颗粒本身的布朗运动,会使散射光产生多普勒位移。通过这种多普勒位移可以得到纳米颗粒的扩散系数,再通过Stokes-Einstein关系就可计算出纳米颗粒的流体力学直径;由于纳米颗粒表面形成的水化层或吸附的离子层能够影响到纳米颗粒的布朗运动,所以动态光散射技术测出的粒径往往大于纳米颗粒的真实粒径;当蛋白质分子接触到纳米颗粒后,蛋白质吸附在纳米颗粒表面的数量或方式将显著改变纳米颗粒的布朗运动,然后通过纳米颗粒的流体力学直径的变化反映出来[1]。图4是ZnFe2O4纳米晶吸附蛋白质分子后DLS粒径的变化。从图中可以看出,BSA或牛血红蛋白的吸附对纳米晶粒径的分布以及大小产生了不同的影响。未吸附蛋白质的纳米晶粒径为仅为38.35 nm,而吸附牛血红蛋白质后纳米晶的粒径明显变大并分裂成3个峰,分别位于64.95、182.7和2 692 nm。从中可以看出38.35 nm的峰消失,表明所有的纳米晶都吸附了牛血红蛋白分子。由于单个纳米颗粒以及纳米颗粒的二聚体、寡聚体和团聚体在DLS测量结果中会表现为不同的粒径分布峰,所以通过比较不同峰的粒径大小关系,能够推断出纳米颗粒所处的状态。这一原理已经成功用于免疫分析[44]。由于64.95 nm小于38.35 nm的2倍(76.7 nm),再考虑到蛋白质吸附的影响,64.95 nm的峰是单个纳米晶吸附牛血红蛋白后形成的。而182.7 nm是64.95 nm的2.8倍,表明182.7 nm的峰对应于3个纳米晶吸附血红蛋白之后形成的三聚体。2 692 nm的峰则是大量纳米晶吸附蛋白后团聚而成的,但是峰的强度很弱,表明这种团聚体所占的比例很小。相比于牛血红蛋白的情况,纳米晶吸附BSA后的粒径分布却非常简单,仅在927.2 nm处有一个非常强的峰。表明纳米晶吸附BSA后仅以团聚体的形式存在。综合DLS结果,不难发现ZnFe2O4纳米晶吸附牛血红蛋白后主要以单体和三聚体的形式存在,仅存在极少量的团聚体,而纳米晶吸附BSA后完全以团聚体的形式存在。这种差异反映出纳米晶与牛血红蛋白和BSA相互作用方式的不同。
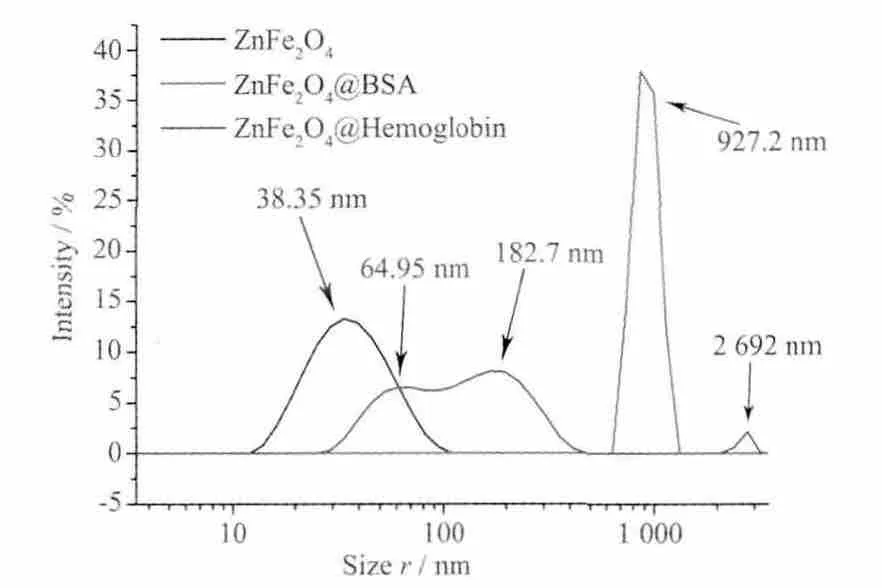
图4 蛋白质吸附对纳米晶DLS粒径的影响Fig.4 Protein adsorption effects on DLS size of nanocrystals

图5 纳米晶与蛋白质相互作用的FTIR分析Fig.5 FTIR analysis of nanocrystal-protein interaction
2.3 ZnFe2O4纳米晶与蛋白质分子相互作用的FTIR光谱分析
FTIR光谱是研究纳米材料对蛋白质分子构象影响的一种有效手段,具有灵敏、快速和廉价的优点[1,45]。红外光谱源于分子中的极性化学键的各种振动模式。由于这些振动模式对于化学键强度及键长的微小变化极为敏感,因此当化学键由于外界因素发生微小变化时,能够通过红外光谱灵敏的反映出来。在蛋白质分子中相邻极性化学键的振动耦合与蛋白质的三维空间结构有关,当蛋白质空间结构发生变化时,会影响到极性化学键的振动频率并在红外光谱中反映出来[45]。图5是纳米晶吸附蛋白质分子后对蛋白质FTIR光谱的影响。从图中可以看出,ZnFe2O4纳米晶在553 cm-1处有一个非常强的吸收峰。该峰是纳米晶中金属离子与氧离子之间的伸缩振动产生的,是铁氧体材料最强的特征性吸收峰[46]。蛋白质分子的FTIR光谱中有两个特征性的峰分别是酰胺Ⅰ带(1 700~1 600 cm-1)和酰胺Ⅱ带(1 600~1 500 cm-1)。其中酰胺Ⅰ带源自肽键中羰基C=O的伸缩振动,对于蛋白质分子空间构象变化比较敏感,因此广泛用于蛋白质构象的研究。酰胺Ⅱ带源自酰胺键N-H平面内的弯曲振动和C-N平面内的伸缩振动,但对蛋白质空间构象的变化不敏感[45]。从图5a中可以看出,纯的BSA在1 650 cm-1处有一个强的吸收峰,对应于酰胺Ⅰ带,而1 535 cm-1则对应于酰胺Ⅱ带。当纳米晶吸附BSA后,在红外谱中出现了酰胺Ⅰ带的峰1 651 cm-1和酰胺Ⅱ带的峰1 536 cm-1,表明了BSA的存在,同时出现了ZnFe2O4的特征性吸收峰554 cm-1。对比于纯BSA的红外谱,纳米晶仅导致BSA的酰胺Ⅰ带和酰胺Ⅱ带增加了一个波数,表明对蛋白构象影响不大。图5b是纳米晶对牛血红蛋白构象的影响。纯的牛血红蛋白的酰胺Ⅰ带和酰胺Ⅱ带分别位于1 653 cm-1和1 536 cm-1,而纳米晶的吸附则导致酰胺Ⅰ带减少3个波数,酰胺Ⅱ带增加1个波数,与图5a相比发现纳米晶对牛血红蛋白的构象影响大于对BSA构象的影响,反映出纳米晶与这两种蛋白相互作用机理的不同。
3 结 论
水热法制备的ZnFe2O4纳米晶对BSA和牛血红蛋白都有很强的吸附能力,但是它们的相互作用机理不同。纳米晶对牛血红蛋白的吸附符合静电吸附的规律,但对BSA的吸附则不符合静电吸附的规律。DLS研究显示纳米晶吸附牛血红蛋白后主要以单体和三聚体的形式存在,仅存在极少量的团聚体,而纳米晶吸附BSA后全部以团聚体的形式存在。FTIR光谱研究则表明牛血红蛋白空间构象更易受到纳米晶的影响。ZnFe2O4纳米晶在合适的pH条件下对蛋白质的吸附容量高达380 mg·g-1以上,而且与不同蛋白质的相互作用机理不同,具有一定的选择性,因此在蛋白质的高效和高选择性分离方面可能有潜在的应用。
致谢:文章作者感谢武汉大学电子显微镜中心提供高分辨率透射电子显微镜观察。
[1]Mahmoudi M,Lynch I,Ejtehadi M R,et al.Chem.Rev.,2011,111:5610-5637
[2]Nel A E,Mdler L,Velegol D,et al.Nat.Mater.,2009,8:543-557
[3]Ge C C,Du J F,Zhao L,et al.PNAS,2011,108:16968-16973
[4]Hu W B,Peng C,Lü M,et al.ACS Nano,2011,5:3693-3700
[5]Sun S G,Ma M H,Qiu N,et al.Colloids.Surf.B Biointerfaces,2011,88:246-253
[6]DU Chong-Lei(杜崇磊),DU Wei(杜伟),WANG Bing(汪冰),et al.Chin.J.Anal.Chem.(Fenxi Huaxue),2010,38(6):902-908
[7]ZHAO Zi-Lai(赵紫来),BIAN Zheng-Yun(卞征云),CHEN Lang-Xing(陈朗星),et al.Prog.Chem.(Huaxue Jinzhan),2006,18(10):1288-1297
[8]HUANGShan-Sheng(黄杉生),YIN Yue-Fen(殷月芬),WANG Ke-Min(王柯敏),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2004,25(12):2238-2241
[9]HUANG Tian-Tian(黄天天),FU Yan(付雁),ZHANG Jin-Li(张金利),et al.Prog.Chem.(Huaxue Jinzhan),2012,24(8):1610-1622
[10]ZHANG Huai(张 怀),ZHANG Yun-Huai(张 云 怀),LI Jing(李静),et al.Prog.Chem.(Huaxue Jinzhan),2008,20(2/3):253-259
[11]NI Song-Bo(倪淞波),LI Yan-Bao(李延报),WANG Xiu-Mei(王秀梅).Prog.Chem.(Huaxue Jinzhan),2011,23(1):231-245
[12]LÜ Ya-Fen(吕亚芬),CAI Cheng-Xin(蔡称心).Acta Chim.Sinica(Huaxue Xuebao),2006,64(24):2396-2402
[13]ZOU Xue-Yan(邹雪艳),CHU Liu-Jie(褚留杰),DONG Shuo(董烁),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2012,33(7):1394-1400
[14]LI Ya-Ru(李亚茹),ZHANG Xue-Lian(张雪莲),PAN Yuan-Yuan(潘园园),et al.J.Funct.Mater.(Gongneng Cailiao),2012,43(8):1045-1048
[15]WU Wei(吴伟),HE Quan-Guo(贺全国),CHEN Hong(陈洪).Prog.Chem.(Huaxue Jinzhan),2008,20(2/3):265-272
[16]Xu M,Li J,Iwai H,et al.Sci.Rep.,2012,2:1-6
[17]YANG Xiao-Chao(杨小超),MO Zhi-Hong(莫志宏).Acta Chim.Sinica(Huaxue Xuebao),2010,68(15):1549-1552
[18]ZHANG Li(张莉),TANG Xin-Feng(唐新峰),GAO Wen-Bin(高文斌).J.Inorg.Mater.(Wuji Cailiao Xuebao),2008,23(4):860-864
[19]YUAN Yuan(袁媛),HE Xiao-Xiao(何晓晓),SHI Hui(石慧),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2010,31(11):2167-2172
[20]Gan X,Liu T,Zhong J,et al.Chem.Bio.Chem.,2004,5:1686-1691
[21]Zhou H,Gan X,Liu T,et al.J.Biochem.Biophys.Methods,2005,64:38-45
[22]Zhu X,Yuri I,Gan X,et al.Biosens.Bioelectron.,2007,22:1600-1604
[23]Zhou H,Gan X,Liu T,et al.Bioelectrochemistry,2006,69:34-40
[24]SHAN Hong-Yan(单洪岩),LIU Dian-Jun(刘殿骏),WANG Zhen-Xin(王振新).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2010,31(12):2372-2374
[25]MENG Jie(孟洁),YANG Man(杨曼),WANG Chao-Ying(王超英),et al.New Carbon Mater.(Xinxing Tancailiao),2007,22(3):218-226
[26]JU Si-Ting(鞠思婷),PU Ling-Yu(朴玲钰),YANG Lei(杨磊),et al.Prog.Chem.(Huaxue Jinzhan),2010,22(9):1767-1775
[27]GUO Xin-Lu(过馨露),ZHANG Jian(张建),WANG Wei(王炜).Prog.Phys.(Wulixue Jinzhan),2012,32(6):285-293
[28]TANG Shi-Hua(唐世华),HUANG Jian-Bin(黄建滨).Acta Chim.Sinica(Huaxue Xuebao),2008,66(13):1534-1540
[29]SONG Wei(宋巍),CHEN Hong(陈红).Chin.Sci.Bull.(Kexue Tongbao),2007,52(23):2701-2704
[30]SHI Jie(史婕),FENG Bo(冯波),LU Xiong(鲁雄),et al.J.Inorg.Mater.(Wuji Cailiao Xuebao),2011,26(12):1329-1303
[31]LI De-Jun(李 德 军),YUAN Li(袁 丽),YANG Ying(杨 莹),et al.Sci.China.C(Zhongguo Kexue C),2009,39(6):596-600
[32]Doane T L,Chuang C H,Hill R J,et al.Acc.Chem.Res,2012,45:317-326
[33]Rabe M,Verdes D,Seeger S.Adv.Colloid.Interface.Sci,2011,162:87-106
[34]JIANG Yong(蒋 勇 ),SONG Wu-Lin(宋 武 林 ),XIE Chang-Sheng(谢长生),et al.Rare Met.Mater.Eng.(Xiyou Jinshu Cailiao Yu Gongcheng),2006,35(4):617-620
[35]JIAO Zheng(焦正),CHEN Feng(陈锋),LI Min-Qiang(李民强),et al.J.Inorg.Mater.(Wuji Cailiao Xuebao),2002,17(2):316-320
[36]SUN Mo-Jie(孙墨杰),HU Quan(胡全),LI Jian(李健),et al.Acta Chim.Sinica(Huaxue Xuebao),2013,71:213-220
[37]Xing Z,Ju Z,Yang J,et al.Nano Res.,2012,5(7):477-485
[38]Barcena C,Sra A K,Chaubey G S,et al.Chem.Comm.,2008:2224-2226
[39]Gao L,Wu J,Lyle S,et al.J.Phys.Chem.C,2008,112:17357-17361
[40]Komarneni S,Fregeau E,Breval E,et al.J.Am.Ceram.Soc.,1988,71(1):C26-C28
[41]SANG Shang-Bin(桑商斌),GU Ying-Ying(古映莹),HUANG Ke-Long(黄可龙).J.Funct.Mater.(Gongneng Cailiao),2001,32(1):27-29
[42]Kumazawa H,Oki K,Cho H M,et al.Chem.Eng.Comm,1992,115:25-33
[43]Rezwan K,Studart A R,Voros J,et al.J.Phys.Chem.B,2005,109:14469-14474
[44]Liu X,Dai Q,Austin L,et al.J.Am.Chem.Soc.,2008,130:2780-2782
[45]Barth A.Biochim.Biophys.Acta,2007,1767:1073-1101
[46]Waldron R D.Phys.Rev.,1955,99:1727-1735