Pd/MnOx+Pd/γ-Al2O3整体式催化剂降解地表臭氧
2013-06-14周丽娜陈耀强任成军龚茂初
周丽娜 陈耀强 任成军 龚茂初
(四川大学化学学院,教育部绿色化学重点实验室,成都 610064)
0 引 言
尽管大气层的臭氧有保护人类健康的作用,但是在地球表面,高浓度的臭氧对人的健康会造成很大的危害。机动车尾气产生的氮氧化物和碳氢化合物在紫外线照射下会形成光化学烟雾,使地表臭氧浓度持续升高。当地表臭氧浓度达到0.1 μL·L-1时,人的呼吸道就会发炎;地表臭氧浓度达到1 μL·L-1时,人们仅可以在这样的环境中活动1~2 h。美国职业安全和健康管理局(OSHA)法规规定8 h内允许暴露的臭氧阈值为0.1 μL·L-1。同样,在日本工作环境中允许的臭氧最大浓度也为0.1 μL·L-1[1]。2012年3月,环境保护部与国家质量监督检验检疫总局联合发布的国家环境质量标准《环境空气质量标准》中规定 8 h内臭氧平均浓度必须低于 100~160 μg·m-3(0.046~0.075 μL·L-1),自 2016 年 1 月 1 日起在全国实施。因此,降解地表臭氧迫在眉捷。
臭氧的净化方法有热分解法、电磁波辐射法、循环回用法、活性炭吸附法、药液吸收法和催化分解法等[2-4]。催化分解法可在常温下对臭氧进行有效而迅速的分解且处理成本低。因此,采用催化剂对臭氧进行催化分解成为最受关注的方法。Oyama等研究了气相臭氧的分解,比较了不同金属氧化物对臭氧的分解能力,其中以MnO2为活性组分制备的催化剂对臭氧的分解性能最好。Wu等[5]研究了地表空气净化催化剂,得出了Pd催化剂不仅具有高的臭氧转化率,而且在低温下具有强烈抑制水汽的作用。Terui和Yokota[6]以Pd和MnOx为活性组分制得的催化剂,在25℃,相对湿度为80%,空速为260,000 h-1条件下,催化分解0.5 μL·L-1臭氧,转化率为60%~80%。Kameya和Urano[7]用钯盐溶液浸渍在MnO2粉末上制得的催化剂在高相对湿度(RH>90%),低空速(30 000 h-1)下分解高浓度 O3,效果较明显。前人的研究表明:采用MnOx和Pd为活性组分的催化剂在高相对湿度下降解地表臭氧非常有效。
本工作采用胶溶法制备大比表面且粘接性好的γ-Al2O3载体材料[8],以 KMnO4和 Mn(NO3)2反应制备的MnOx为活性组分,负载抗湿性的Pd[5-7,9],制备出Pd/MnOx+Pd/γ-Al2O3整体式催化剂,在高空速(380 000 h-1)高相对湿度(RH=85%~90%)条件下,研究0.60 μL·L-1O3分解性能,同时对催化剂进行了相关表征,得到了有意义的结果。
1 实验部分
1.1 催化剂的制备
胶溶法制备γ-Al2O3:将一定量的拟薄水铝石加入一定量的水和浓HNO3,球磨后生成溶胶,经陈化、干燥和600℃焙烧3 h后得到γ-Al2O3(比表面积272 m2·g-1)。
氧化还原法制备MnOx:将物质的量比为2∶3的高锰酸钾和50%硝酸锰水溶液与氨水并流滴定,控制pH值为9,生成的沉淀物Mn(OH)2经陈化、洗涤,抽滤和干燥,分别在300、400、500、600和700℃焙烧6 h,获得MnOx样品。
Pd/MnOx+Pd/γ-Al2O3的制备:用等孔体积法将硝酸钯溶液分别负载在MnOx和γ-Al2O3上,其中,wMnOx∶wγ-Al2O3=4∶1, 对应的 Pd 负载量分别为 1.33wt%和2.66wt%。将负载Pd的两种粉体机械混合,加入适量蒸馏水球磨制成浆液,涂覆在体积为0.28 cm3的蜂窝堇青石陶瓷基体 (美国Coring公司,400孔/inch2)小样上,于200℃空气中焙烧3 h,制得Pd/MnOx+Pd/γ-Al2O3整体式催化剂。其中,Pd为1.6%,MnOx为78.7%,γ-Al2O3为19.7%。催化剂在堇青石基体上的涂覆量为340 g·L-1。
MnOx/γ-Al2O3的制备:将 500 ℃焙烧的 MnOx与γ-Al2O3按质量比4∶1机械混合,加入适量蒸馏水球磨制成浆液,涂覆在体积为0.28 cm3的蜂窝堇青石陶瓷基体小样上,于200℃空气中焙烧3 h,制得MnOx/γ-Al2O3整体式催化剂。涂覆量为340 g·L-1。
Pd/γ-Al2O3的制备:将硝酸钯溶液等体积浸渍于γ-Al2O3中,经烘干、焙烧后制得催化剂粉末。将粉末和适量的水混合,球磨制成浆液,涂覆在体积为0.28 cm3的蜂窝堇青石陶瓷基体小样上,于200℃空气中焙烧3 h,制得Pd/γ-Al2O3整体式催化剂。涂覆量为 340 g·L-1,Pd 为 5.44 g·L-1。
1.2 催化剂的评价
活性测试装置 (如图1)由空气压缩机、JY-3型O3发生器(成都乾贵净化设备厂)、催化剂反应炉和M4+型O3分析仪(南京巴尚科技有限公司)等组成。装置中入口 O3浓度为(0.60±0.02)μL·L-1,相对湿度(RH)为85%~90%,反应器温度由程序控温仪控制,升温速率 1.5 ℃·min-1,空速(GHSV)为 380 000 h-1下对催化剂进行活性测试。
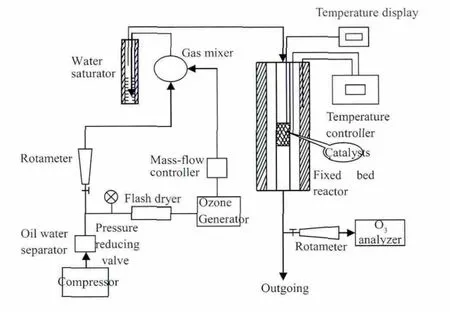
图1 臭氧分解测试装置示意图Fig.1 Apparatus for catalytic decomposition of ozone gas
1.3 催化剂的表征
X射线衍射(XRD)分析在荷兰X′pert型X射线衍射仪上进行,Cu Kα(λ=0.154 06 nm)射线,管电压40 kV,管电流 40 mA,扫描范围 2θ=10°~80°。催化剂的X射线光电子能谱(XPS)分析在XSAM800型电子能谱测试仪上进行,以Al Kα为激发源,X射线高电压和电流分别为12 kV和12 mA。电子结合能数值用C1s(284.8 eV)校准。程序升温还原(H2-TPR)在自组装微型流动反应装置上进行,样品用量100 mg。实验前样品先在20 mL·min-1N2流中加热至300℃,并保持60 min,然后降至室温后,切换为5%H2/N2混合气(流速为 20 mL·min-1),再以 8 ℃ min-1,从室温升至800℃,TCD检测耗氢量。样品的比表面积和孔体积用低温N2吸附法在全自动比表面和孔隙度分析仪AUTOSORB-1系列 (美国康塔仪器公司)上测定,样品先于300℃下抽真空脱气处理1 h,以高纯N2为吸附质(-196℃)测定催化剂的织构性质。
2 结果与讨论
2.1 催化活性及Pd与MnOx的协同作用
图 2 为 O3在 Pd/γ-Al2O3、MnOx/γ-Al2O3和 Pd/MnOx+Pd/γ-Al2O3催化剂上的降解。由图得知,O3的起始(12℃)转化率分别为28%、60%和84%,O3完全转化温度分别为58、32和20℃,活性顺序为Pd/MnOx+Pd/γ-Al2O3>MnOx/γ-Al2O3>Pd/γ-Al2O3。在高空速高相对湿度下,Pd单独作为活性组分时Pd/γ-Al2O3催化剂降解O3的能力较弱,MnOx单独作为活性组分时MnOx/γ-Al2O3催化剂有较好的催化活性。Pd和 MnOx两种活性组分共存时,Pd/MnOx+Pd/γ-Al2O3催化剂活性既明显高于Pd/γ-Al2O3催化剂,又高于MnOx/γ-Al2O3催化剂。可以看出,Pd/MnOx+Pd/γ-Al2O3催化剂中活性组分Pd和MnOx存在协同作用。在高相对湿度下,H2O和O3在催化剂表面竞争吸附,MnOx/γ-Al2O3催化剂活性受到抑制。而对于Pd/MnOx+Pd/γ-Al2O3催化剂,Pd一方面作为活性组分,另一方面作为抗湿剂[5,7]抑制H2O分子在催化剂表面的吸附,使O3与活性位充分接触,从而使该催化剂在高湿度下具有优异的活性。
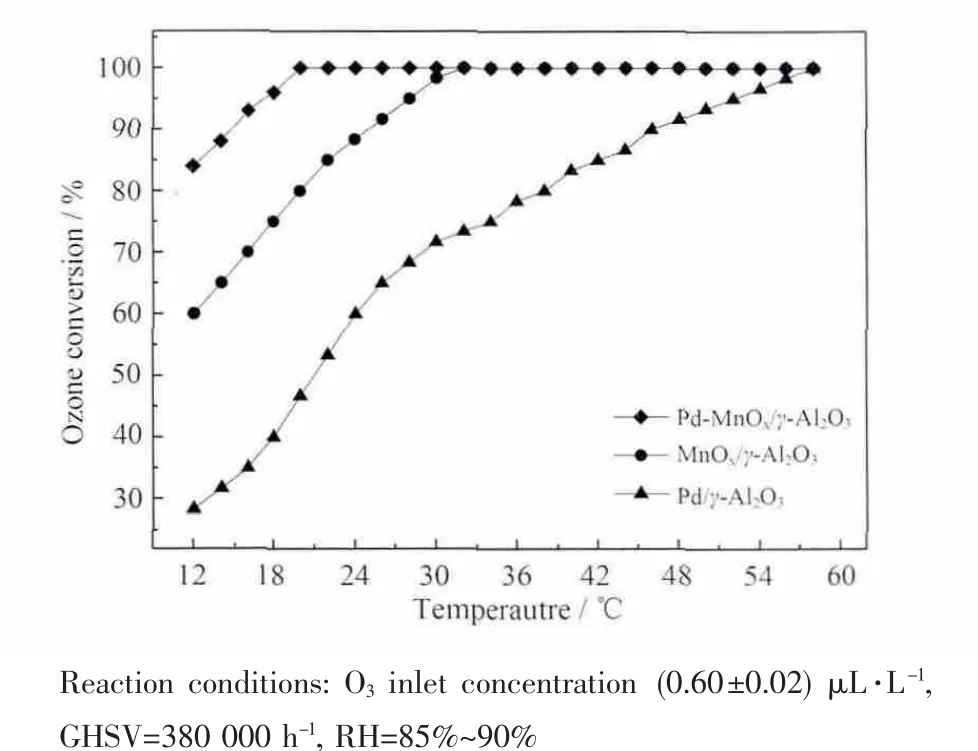
图2 Pd/γ-Al2O3、MnOx/γ-Al2O3 和 Pd/MnOx+Pd/γ-Al2O3催化剂对O3的降解Fig.2 O3conversion as a function of reaction temperature on Pd/γ-Al2O3,MnOx/γ-Al2O3and Pd/MnOx+Pd/γ-Al2O3catalysts

图3 Pd/γ-Al2O3、MnOx/γ-Al2O3 和 Pd/MnOx+Pd/γ-Al2O3催化剂H2-TPR图Fig.3 H2-TPR profiles of Pd/γ-Al2O3,MnOx/γ-Al2O3and Pd/MnOx+Pd/γ-Al2O3catalysts
图 3 为 Pd/γ-Al2O3、MnOx/γ-Al2O3和 Pd/MnOx+Pd/γ-Al2O3的 H2-TPR 图。由图可见,Pd/γ-Al2O3催化剂在121℃出现了一个弱还原峰,可归属为Pd物种的还原[10]。MnOx/γ-Al2O3催化剂在336和450℃有2个还原峰,336℃的还原峰可归属为MnO2和Mn2O3还原成Mn3O4,450℃的还原峰可归属为Mn3O4还原成 MnO[11]。Pd/MnOx+Pd/γ-Al2O3催化剂在 160~230℃出现了1个宽的还原峰,明显不同于MnOx/γ-Al2O3样品的结果,表明Pd的存在显著降低了MnOx的还原温度,Pd-MnOx之间存在明显的相互作用。Xie等[12]认为是贵金属Pd的氢溢流作用导致了MnO2的还原温度向低温方向移动。氢溢流现象是吸附于贵金属Pd表面的H2可更快地解离为H原子,并扩散到MnO2表面,增强了MnO2的还原性。Pd氢溢流作用解释了贵金属Pd与MnOx之间的相互作用。与活性结果相联系,Pd与MnOx之间的相互作用促进了Pd/MnOx+Pd/γ-Al2O3催化剂降解O3催化活性的提高。
2.2 MnOx焙烧温度对催化剂活性的影响
图4为不同MnOx焙烧温度下的催化剂降解O3的活性曲线。实验结果表明,对焙烧温度为300、400、500、600及 700 ℃的样品,初始 O3(12 ℃)转化率分别为78%、80%、84%、88.3%和82%。O3完全转化温度分别为25、23、20、18和22℃。催化剂的活性随MnOx焙烧温度升高而增加,但过高的焙烧温度(700℃)会导致催化剂活性降低,MnOx在600℃焙烧的催化剂对O3的分解活性最好。
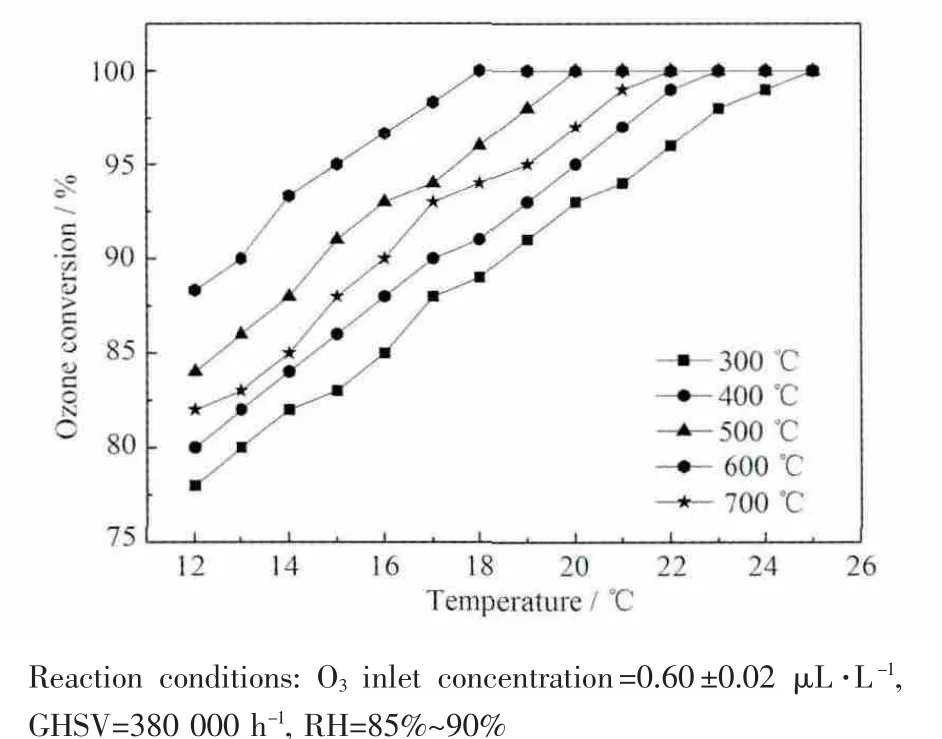
图4 MnOx焙烧温度对Pd/MnOx+Pd/γ-Al2O3催化剂降解O3活性的影响Fig.4 O3conversion as a function of reaction temperature on the Pd/MnOx+Pd/γ-Al2O3as MnOxcalcined at different temperatures
Terui和Yokota[6]制备的催化剂(含MnOx85.6%,Pd 1.7%和14.4%Al2O3),在25℃相对湿度为80%,空速为 260 000 h-1条件下,催化分解 0.5 μL·L-1臭氧,转化率仅为60%~80%。余全伟等[13]用焙烧MnCO3粉末法制得的Pd-MnOx/SiO2-Al2O3催化剂,在空速为360 000 h-1下催化分解 0.60 μL·L-1臭氧,完全转化温度为30℃。本文制备的催化剂反应条件(相对湿度85%~90%,空速380 000 h-1,臭氧浓度0.6 μL·L-1等)较文献[6,13]苛刻,在低温(18 ℃)下具有更高的转化率(90%~100%)。表明我们制备的催化剂具有更优异的活性。若将该催化剂涂覆于汽车水箱的波浪型散热片上,当汽车高速运行时,利用水箱表面的废热,在高空速条件下能有效去除地表O3,具有较好的应用前景。
2.3 催化剂的XRD表征
图5为不同MnOx焙烧温度下催化剂的XRD图。由图看出,催化剂只有MnOx物相;没有观察到γ-Al2O3的衍射峰,也没有观察到PdO或含Pd物种的衍射峰,表明Pd在催化剂表面分散良好,也可能Pd含量低(1.6%),晶粒太小未被XRD检测出。催化剂中MnOx焙烧温度为300℃时MnOx以Mn3O4和Mn5O8物相存在,400 ℃焙烧时 MnOx为 MnO2,500、600和700℃焙烧时MnOx均由MnO2和Mn2O3组成。当温度从300℃升至400℃时,Mn3O4和Mn5O8在空气气氛中氧化转变成MnO2。继续升温至500℃时,部分MnO2开始还原成 Mn2O3[14],出现 Mn2O3衍射峰。当升温至600℃,MnO2衍射峰变弱,Mn2O3衍射峰增强,部分MnO2继续转变成Mn2O3。700℃时由于温度升高MnO2和Mn2O3的晶型更加完整,MnO2和Mn2O3衍射峰均变强。Berbenni等[15]研究了不同焙烧温度时锰氧化物的相变。250℃主要物相为Mn3O4,并伴随一定量的MnO2。480℃除MnO2和Mn3O4外,形成了新物相Mn5O8(Mn3O4+2/5O2=3/5 Mn5O8)。615℃ MnO2/Mn5O8分解生成 Mn2O3。与本文研究的随着焙烧温度升高MnOx物相变化趋势基本一致,细小的差异是由制备方法不同所致。

图5 不同MnOx焙烧温度制备的Pd/MnOx+Pd/γ-Al2O3催化剂XRD图Fig.5 XRD patterns of the Pd/MnOx+Pd/γ-Al2O3using MnOxcalcined at different temperatures
结合活性测试数据得出,400℃焙烧的MnOx催化剂活性优于300℃焙烧的催化剂,MnOx焙烧温度为500、600和700℃时催化剂活性又优于400℃焙烧的样品,说明单一MnO2物相构成的催化剂活性优于Mn3O4和Mn5O8混合物相组成的催化剂,由MnO2和Mn2O3混合物相组成的催化剂对O3的分解能力比单一MnO2物相好,即是MnO2和Mn2O3共存有利于O3分解。Einaga等[16]提出O3分解机理为:O3+Mnn+→O2-+Mn(n+2)++O2;O3+O2-+Mn(n+2)+→O22-+Mn(n+2)++O2;O22-+Mn(n+2)+→Mnn++O2, 表 明 活 性 组 分MnOx在O3分解过程中既参与氧化反应,又参与还原反应。既含有+4价的高价锰(MnO2)又含有+3价的低价锰(Mn2O3)的催化剂具有较好的活性,这一实验结果进一步证实了该机理的合理性。
2.4 催化剂表面Mn的价态及氧物种分析
由图6可知,Mn2p3/2的XPS谱峰较宽且不对称,表明Mn以不同的氧化态存在。据文献[17-18]报道,Mn(Ⅱ)、Mn(Ⅲ)和 Mn(Ⅳ)的 Mn2p3/2的电子结合能分别为640.8、641.8和642.6 eV。由Mn2p3/2谱图可知,300℃焙烧的催化剂表面MnOx的价态为Mn2+和Mn4+。结合XRD图分析,300℃焙烧的催化剂中MnOx物相为Mn3O4和少量的Mn5O8,根据文献[19]Mn3O4可能由 Mn2+和 Mn4+组成 (2MnO·MnO2),Mn5O8[20]可能由 Mn2+和 Mn4+组成 (2MnO·3MnO2)。300℃焙烧的样品XPS和XRD的结果在物种上是一致的。400℃焙烧的催化剂表面MnOx也为Mn2+和Mn4+,但XRD检测到的催化剂锰氧化物只有MnO2。可能是MnO以非晶态形式存在,Mn2+主要存在于催化剂表面,而Mn4+分布在催化剂表面和体相。500、600和700℃焙烧的催化剂表面 MnOx为 Mn3+和Mn4+,XRD检测的物相也是MnO2和Mn2O3。
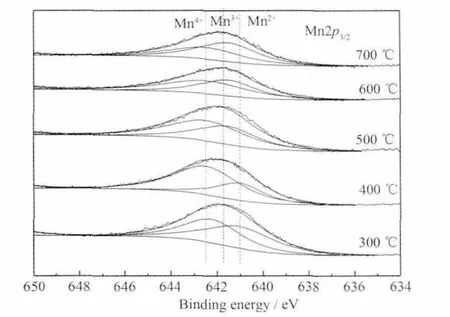
图6 不同MnOx焙烧温度的Pd/MnOx+Pd/γ-Al2O3催化剂Mn2p3/2XPS谱图Fig.6 Mn2p3/2spectra of the Pd/MnOx+Pd/γ-Al2O3 catalysts using MnOxcalcined at different temperatures
不同MnOx焙烧温度制备的样品表面Mn2+、Mn3+、Mn4+物种的相对含量列于表1中。从300到400℃催化剂表面Mn2+含量下降,Mn4+含量增加,即是表面MnO部分氧化成了MnO2。400至500℃,MnO完全氧化生成了MnO2,同时部分MnO2分解生成了Mn2O3,因此,500℃焙烧的催化剂表面为MnO2和Mn2O3。600℃焙烧时MnO2继续分解成Mn2O3[11],导致600℃焙烧的样品表面MnO2含量减少,Mn2O3含量增加。700℃时样品表面部分MnO2继续分解生成Mn2O3,以致表面Mn4+含量进一步降低,同时由于温度升高体相中MnO2和Mn2O3晶型更加完整,故MnO2和Mn2O3衍射峰均变尖锐。
图7为催化剂O1s的XPS谱图。由谱图可知,催化剂表面存在3类氧物种:低结合能 (OⅠ:529.7~530.1 eV)的谱峰归属为金属氧化物中的晶格氧(O2-),中间结合能(OⅡ:531.0~531.6 eV)的谱峰归属为表面吸附氧(O2-/O-)、羟基和氧空位,高结合能(OⅢ:533.0 eV)的谱峰归属为化学吸附水中的氧[17,21]。三类氧物种的相对含量分别列于表2。由表2可看出,600℃焙烧的MnOx催化剂表面吸附氧(O2-/O-)、羟基氧及氧空位最多,其次为500℃焙烧样品,再次是700℃焙烧样品,然后分别是400和300℃焙烧样品。在O3的分解过程中,O3首先与表面羟基作用形成氢键[22],然后在Lewis酸位上发生解离吸附形成活性氧物种 O2-、O-及 O22-[1,22-23]。O3的分解在室温(12~25℃)进行,结合催化剂活性和O3分解机理分析,表面吸附氧(O2-/O-)、羟基氧和氧空位在O3分解中起活性氧的作用。催化剂的活性与表面活性氧物种的含量一致。即表面活性氧物种是导致不同MnOx焙烧温度的催化剂活性差异的一个重要因素。
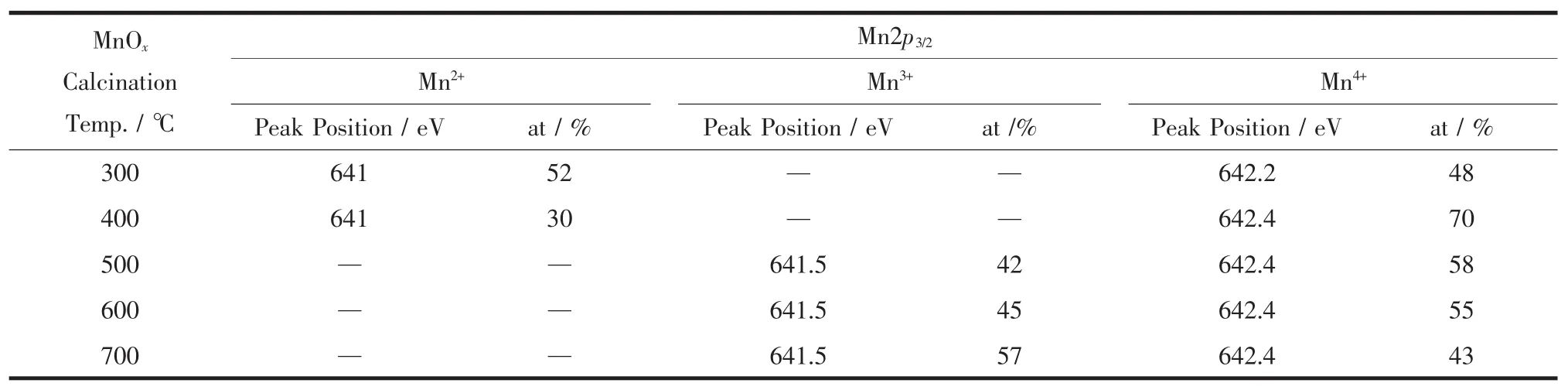
表1 Pd/MnOx+Pd/γ-Al2O3催化剂的Mn2p3/2的价态和含量Table1 XPS results of Mn2p3/2for the Pd/MnOx+Pd/γ-Al2O3catalysts
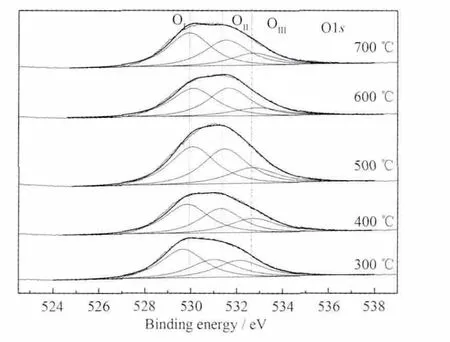
图7 不同MnOx焙烧温度的Pd/MnOx+Pd/γ-Al2O3催化剂O1s XPS谱图Fig.7 O1s spectra of the Pd/MnOx+Pd/γ-Al2O3catalysts using MnOxcalcined at different temperatures

表 2 Pd/MnOx+Pd/γ-Al2O3催化剂的 O1s XPSTable2 XPS results for O1s for the Pd/MnOx+Pd/γ-Al2O3catalysts

表3 不同MnOx焙烧温度制备的Pd/MnOx+Pd/γ-Al2O3催化剂织构性质Table3 Textural properties of the Pd/MnOx+Pd/γ-Al2O3catalysts using MnOxcalcined at different temperatures
2.5 催化剂的织构性质
由表3可见,随着MnOx焙烧温度的升高,催化剂的比表面积、孔容逐渐减小,平均孔径逐渐增大。原因是随着焙烧温度升高,样品中的小孔逐渐烧结。结合活性测试 (图4),300和400℃焙烧的催化剂织构性能虽然好,但活性却较差,可见催化剂织构性质不是影响活性的主要因素,物相为主要因素。500和600℃焙烧的催化剂活性高于700℃,这3个样品的物相基本相同,但各物相的比例存在差异,而500和600℃焙烧的样品比表面积和孔容高于700℃焙烧的样品。将Pd/MnOx+Pd/γ-Al2O3催化剂活性测试数据与物相、表面性质及织构性质相关联得出,催化剂的活性主要由活性组分MnOx的物相和表面吸附氧物种的多少决定,织构性质也有一定的影响。
3 结 论
采用氧化还原法以高锰酸钾和硝酸锰为锰前驱体制备MnOx,胶溶法制备γ-Al2O3,分别等体积浸渍Pd后机械混合制备出Pd/MnOx+Pd/γ-Al2O3整体式催化剂。O3降解的结果表明Pd和MnOx之间存在明显协同作用。催化活性主要取决于催化剂中活性组分MnOx的物相及表面吸附氧物种的多少。MnO2和Mn2O3共存有利于催化活性的提高。在高相对湿度和高空速条件下,MnOx在600℃焙烧制得的Pd/MnOx+Pd/γ-Al2O3催化剂于18℃就可完全降解地表O3,表现出优异的催化性能,具有较好的应用前景。
[1]Dhandapani B,Oyama S T.Appl.Catal.B,1997,11(2):129-166
[2]CHEN Ye-Pu(陈烨璞),JIANG Ai-Li(蒋爱丽),TAN Gui-Xia(谭桂霞),et al.Industrial Catal.(Gongye Cuihua),2006,14(5):52-55
[3]FU Jia-Yuan(傅嘉媛),FENG Yi-Jun(冯易君),ZHONG Bing(钟兵),et al.Sichuan Environ.(Sichuan Huanjing),2001,20(3):10-14
[4]LI Wei(李 伟),SUN De-Zhi(孙 德 智),LIU Chang-An(刘长安),et al.J.Harbin Institute Technol.(Harbing Gongye Daxue Xuebao),2004,36(5):624-627
[5]Wu M C,Kelly N A.Appl.Catal.B.,1998,18(1/2):79-91
[6]Terui S,Yokota Y.US Patent,5187137.1993-02-16
[7]Kameya T,Urano K.J.Environ.Eng.2002,128(3):286-292
[8]Zhang X,Zhang F,Chan K Y.Mater.Lett.,2004,58(22/23):2872-2877
[9]Kitaguchi S,Terui S,et al.US Patent,5296435.1994-03-22
[10]YAO Yan-Ling(姚艳玲),FANG Rui-Mei(方瑞梅),SHI Zhong-Hua(史忠华),et al.Chin.J.Catal.(Cuihua Xuebao),2011,32(4):589-594
[11]Rezaei E,Soltan J,Chen N,et al.Chem.Eng.J.,2013,214:219-228
[12]Xu G P,Zhu Y X,Ma J,et al.Stud.Surf.Sci.Catal.,1997,112:333-338
[13]YU Quan-Wei(余全伟),ZHAO Ming(赵 明),LIU Zhi-Ming(刘志敏),et al.Chin.J.Catal.(Cuihua Xuebao),2009,30(1):1-3
[14]Fu X B,Feng J Y,Wang H,et al.Catal.Commun.,2009,10(14):1844-1848
[15]Berbenni V,Marini A.Mater.Res.Bull.,2003,38(14):1859-1866
[16]Einaga H,Harada M,Futamura S.Chem.Phys.Lett.,2005,408(4/5/6):377-380
[17]Santos V P,Pereira M F R,Órfǎo J J M,et al.Appl.Catal.B,2010,99:353-363
[18]Wei Y J,Yan L Y,Wang C Z,et al.J.Phys.Chem.B,2004,108(48):18547-18551
[19]Ardizzone S,Bianchi C L,Tirelli D.Colloids.Surf.A,1998,134(3):305-312
[20]Thota S,Prasad B,Kumar J.Mater.Sci.Eng.B,2010,167(3):153-160
[21]Chen H Y,Sayari A,Adnot A,et al.Appl.Catal.B,2001,32:195-204
[22]Bulanin K M,Lavalley J C,Tsyganenko A A.Colloid Surface A,1995,101(2/3):153-158
[23]Li W,Oyama T.J.Am.Chem.Soc.,1998,120(35):9047-9052