胰岛素样生长因子Ⅰ/Ⅰ型胶原复合物修复兔半月板无血运区损伤
2013-06-14于书记姜鑫
于书记,姜鑫
(1.潍坊医学院外科学教研室;2.潍坊医学院附属潍坊市人民医院骨关节外科,山东 潍坊 261053)
近年来,大量行半月板部分或全部切除术的患者较早的出现膝关节退变性骨关节炎[1-2],预后很不乐观,提示半月板在膝关节运动负重、缓冲震荡和维持稳定等方面发挥着重要的生物力学功能、扮演着极其关键而特殊的角色[3-4]。因此现阶段对于半月板损伤后修复的研究显得尤其重要和必要!
实验研究[5-6]证实胰岛素样生长因子Ⅰ(IGF-Ⅰ,Insulin-like growth factor I)对体外培养的软骨细胞等多种组织细胞有显著的促增殖作用,且研究显示Ⅰ型胶原具有良好的生物相容性,可作为组织损伤修复的支架材料,而目前用胰岛素样生长因子Ⅰ/Ⅰ型胶原复合物(IGF-Ⅰ/Ⅰ型胶原复合物)修复半月板损伤的研究报道较少。本实验旨在验证胰岛素样生长因子Ⅰ/Ⅰ型胶原复合物对兔半月板无血运区损伤的修复效果,为临床半月板无血运区损伤的修复探索新的途径。
1 材料和方法
1.1 设计
随机分组,对比观察。
1.2 时间及地点
实验于2011 年8 月至2012 年10 月在潍坊医学院动物实验室完成。
1.3 实验动物
健康成年新西兰大白兔36 只,雌雄不限,体质量2.2~2.8 kg,由潍坊医学院动物实验中心提供。实验过程中对动物的处置参照国家科学技术部2006 年发布的《关于善待实验动物的指导性意见》[7]。
1.4 实验材料
IGF-Ⅰ,Ⅰ型胶原溶液(武汉博士德生物工程有限公司);光镜及HE 染色试剂由潍坊医学院组织学实验室提供。
1.5 实验方法
1.5.1 IGF-Ⅰ/Ⅰ型胶原复合物的制备
既往研究表明体外培养半月板、软骨等组织细胞时,IGF-Ⅰ在50 μg/L 浓度时具有最大促增殖效应。用双腔注射器抽取等量的质量浓度为50 μg/L IGF-I 溶液和I 型胶原溶液制成复合物注射于治疗部位。
1.5.2 动物模型建立
将健康成年新西兰大白兔36 只按随机数字法均分为3 组,并于实验前8 小时禁食,自由饮水。用2.5%戊巴比妥钠(2.5 mg/kg)于兔耳缘静脉注射全麻;麻醉后仰卧位固定四肢,双后肢膝部脱毛,常规碘酊、酒精消毒,铺无菌巾。屈膝90°,取双膝关节髌韧带外侧手术入路(防止术后尿液污染导致切口感染)约2 cm 弧形切口,沿髌骨外上缘至胫骨结节处切开皮肤及皮下各层,用自制的半月板拉钩显露外侧半月板前角、体部及股骨髁软骨面。参照相关文献[8],用镰状刀片于外侧半月板游离缘体部造成一个长0.7 cm、宽0.3 cm 的统一的无血运区纵行全层裂伤模型。
1.5.3 随机分组
空白对照组中半月板损伤区不作任何填塞处理,IGF-Ⅰ组半月板损伤区内注射1 mL IGF-Ⅰ溶液(配制50 μg/L 的浓度);IGF-Ⅰ/Ⅰ型胶原组半月板损伤区注入胰岛素样生长因子Ⅰ/Ⅰ型胶原复合物至填充剂与半月板表面相平为止。然后用3.0 尼龙线紧密缝合关节囊以防液体渗出,抗生素敷料包扎。
1.5.4 术后处理
术后每只兔每天肌注青霉素8 万单位,连续5 d,预防感染。自制小夹板固定膝部2 周,限制关节活动。分笼饲养,连续观察进食、活动、切口有无红肿及渗液等情况。分别于术后第4、8、12 周,分批随机选取3 组中各4 只实验动物,从耳缘静脉行空气栓塞法处死,打开关节腔,切取半月板组织标本并无菌保存。
1.5.5 观察指标
将半月板标本进行大体形态观察后,置入体积分数为10%甲醛溶液中固定2~3 d,再进行脱水、浸蜡包埋处理,最后对切片采用苏木精—伊红染色,行光镜下组织学检查。
1.5.6 设计、实施、评估者
实验设计、干预实施为第一作者,评估为第二作者;实验实施者接受正规培训,评估者采用盲法评估。
2 结 果
2.1 大体观察
观察3 组中36 只实验兔,手术后膝关节均无切口感染及关节积液,无半月板与关节面软骨粘连;空白对照组及IGF-Ⅰ组半月板损伤区3 个时间点均未愈合、未见组织填充(图1),IGF-Ⅰ/Ⅰ型胶原组的半月板裂口在第12 周时均已被组织填充;愈合组织的颜色较正常半月板组织深,裂口较术前变窄,其表面稍向内陷,愈合组织与邻近半月板组织粘连紧(图2)。
2.2 组织学检查
空白对照组:术后各观察期裂口边缘均无纤维软骨细胞或成纤维细胞增殖。IGF-Ⅰ组:术后4 w,半月板边缘滑膜细胞少量增生;术后8 w,半月板边缘滑膜细胞显著增生,半月板裂口未见愈合迹象;术后12 w,裂隙处仍无纤维软骨细胞增殖,亦无同源细胞群出现。
IGF-Ⅰ/Ⅰ型胶原组:术后第4 周,镜下见缺损处被胶质样组织充填,可见少量纤维组织与正常组织交织,裂隙两边有纤维软骨细胞增殖表现,修复组织内尚未见明显纤维软骨细胞(图3);术后第8 周,镜下见纤维样组织形成,并与周围正常组织相连,纤维排列不规则,可见散在的纤维软骨细胞生长,无软骨囊形成(图4);术后第12 周,镜下见整个缺损区均已被纤维软骨样组织填充,愈合组织内见较多纤维软骨细胞形成,部分可见软骨囊或软骨陷窝,胶原纤维排列较前规则,接近于正常的半月板组织(图5)。另有少数标本表现为瘢痕样组织愈合,未见纤维软骨细胞出现,纤维排列欠规则,愈合组织与正常半月板的组织学特征有明显差异(图6)。
3 讨 论
3.1 半月板的生理分区及损伤的治疗进展
半月板在临床上根据血运供应、承受机械应力以及解剖部位不同一般被分为3 个区:红区、白区和红一白区。红区位于半月板滑膜缘,又称有血运区;白区位于半月板游离缘,又称无血运区;红—白区为红区向白区过渡部分,由红区毛细血管终末支供血。既往研究表明[9],无血运区营养主要来自滑液,损伤后不能自行修复。本实验中空白对照组整个观察期始终没有愈合的反应,与这一普遍结论是相符的,这可能与半月板游离缘大部分区域没有血供缺乏营养支持及半月板软骨细胞自身的增殖惰性等多种因素有关。近年来半月板钻孔建立血管通道[10]、凝血块移植、滑膜移植等治疗半月损伤均有大量研究,取得了一定程度的进展。而当前对组织工程半月板的研究成为热点,其中以种子细胞[11]、支架材料和细胞因子的研究居多。本实验即研究以胰岛素样生长因子Ⅰ与Ⅰ型胶原材料相结合修复兔半月板损伤的效果,结果显示胰岛素样生长因子Ⅰ在Ⅰ型胶原作为生物支架材料存在时可有效刺激活体兔半月板纤维软骨细胞的增殖,IGF-Ⅰ/Ⅰ型胶原复合物对兔半月板无血运区的损伤在一定程度上具有较好的修复作用,这为临床半月板无血运区损伤的修复奠定了实验基础,提供了一种相对可行的参考方法。
3.2 GF-Ⅰ的生物特性及在半月板损伤愈合中的作用
研究表明[12],IGF-Ⅰ对成骨细胞的增殖和分化及骨代谢的调节也有重要作用,是骨塑形改建过程中的重要调节因子,刺激成骨前体细胞增殖,促进Ⅰ型胶原和骨基质的合成,促进骨的生长和损伤的修复。经研究证实[13],IGF-Ⅰ是一种在体内参与多种生理调节的多肽,可调节软骨发育和软骨自稳态,刺激软骨细胞分裂增殖,并促进软骨蛋白聚糖的合成,维持软骨细胞的表型,促进软骨愈合。
后有研究表明[14],IGF-Ⅰ可以明显促进立体培养的半月板纤维软骨细胞的增殖,尤其对于无血运区的细胞促增殖效果更显著。本实验中,IGF-Ⅰ组只对半月板边裂口缘滑膜细胞有促增殖作用,而对无血运区损伤的愈合却无明显影响,这可能与胰岛素样因子单独存在时由于缺少生物支架材料的保护更容易被降解、稀释等原因有关,也可能是由于增生的细胞数量较少,新生的细胞缺少纤维蛋白支架的支撑而不能移行生长,最终达不到愈合的目的。
3.3 Ⅰ型胶原在组织损伤愈合中的作用
Ⅰ型胶原是一种分布在骨、软骨、肌腱、血管、皮肤等结缔组织的含糖蛋白质,作为天然的细胞外基质,其结构非常有利于培养中细胞的黏附、增殖和分化。Ⅰ型胶原为半月板基质的主要成分,能有效促使半月板纤维软骨细胞尽早黏附、维持表型、形成集落,并能刺激细胞分泌胶原等。研究结果[15]显示:Ⅰ型胶原作为生长因子缓释载体和基因治疗的载体,具有良好的生物相容性,在半月板、关节软骨等结缔组织损伤的修复中有着广阔的前景。
3.4 IGF-Ⅰ/Ⅰ型胶原复合物在半月板损伤愈合中的作用
本实验结果表明,IGF- Ⅰ/Ⅰ型胶原复合物可增强IGF-Ⅰ的生物学活性,比单用IGF-Ⅰ的效果明显要好,多数表现为纤维软骨样组织愈合。这提示半月板并非一定是完全惰性的组织,在适宜的条件刺激下,半月板无血运区的损伤可产生纤维组织愈合。我们认为:当给予适当的生长环境,并有种子细胞、支架材料、生长因子三者甚至更多因素的共同参与时,纤维软骨细胞大量增殖及基质蛋白充分合成等,半月板无血运区损伤的愈合是可实现的。如果引入反转录-聚合酶链式反应(RT-PCR)技术,可更加确切的证实愈合组织为半月板组织。
期待在后续研究中,进一步引入种子细胞或更多种生长因子,优化实验设计结构,进行更深层次的探索,以期能获得一种更理想的复合型组织工程材料,使半月板的损伤能在组织结构和生物力学功能上获得双重修复。

图1 空白对照组及IGF-Ⅰ组未愈合
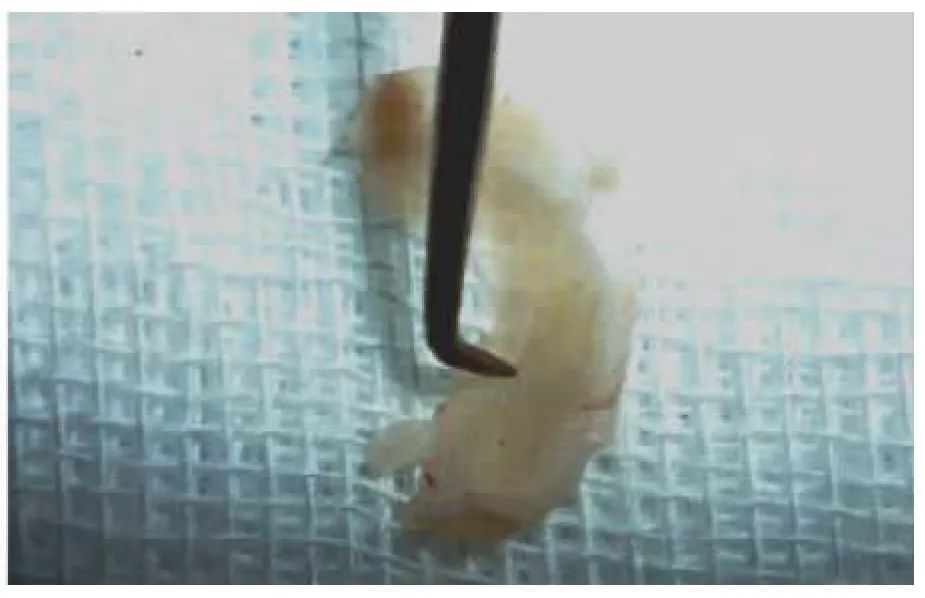
图2 复合物组愈合且连接紧密

图3 IGF-Ⅰ/Ⅰ型胶原组术后第4 周胶质样组织充填 HE×100

图4 IGF-Ⅰ/Ⅰ型胶原组术后第8 周纤维样组织填充 HE×100
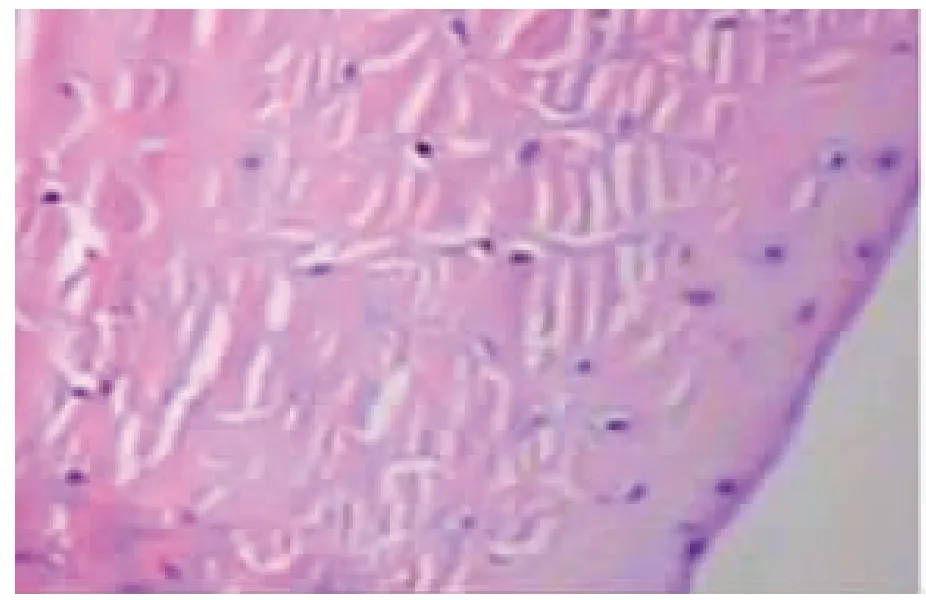
图5 IGF-Ⅰ/Ⅰ型胶原组术后第12 周纤维软骨样组织 HE×100

图6 IGF-Ⅰ/Ⅰ型胶原组术后第12 周瘢痕样组织愈合 HE×100
[1]McDermott ID,Amis AA.The consequences of meniscectomy.[J].Bone Joint Surg Br,2006,88 (12):1549-1556.
[2]Shiramizu K,Vizesi F,Bruce W,et al.Tibiofemoral contactareas and pressures in six high flexion knees.[J].Int Orthop,2009,33 (2):403-406.
[3]Richards DP,Barber FA,Herbert MA.Compressive loads in longitudinal lateral meniscus tears:a biomechanical study in porcine knees.[J].Arthroscopy,2005,21 (12):1452-1456.
[4]Andersson-Mo lina H,Karlsson H,Rockborn P.Arthorscopic par-tial and to meniscectomy:A long-term follow-up study with matched controls [J].Arthorscopy,2002,18 (2):183-189.
[5]Shi S,Mercer S,Tdppel SB.Effect of transfection strategy on growth factor over expression by atricular chondrocytes.[J].Otrhop Res.2010,28 (11):103-109.
[6]Heckmann TP,Barber-Westin SD,Noyes FR.Meniscal repair and transplantation:indications, techniques, rehabilitation,and clinical outcome.[J].Orthop Sports Phys Ther,2006,36 (10):795-814.
[7]中华人民共和国科学技术部.关于善待实验动物的指导性意见[S].2006.
[8]Baksh D,Yao R,Tuan RS.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow [J].Stem Cells,2007,25 (6):1384-1392.
[9]Noyes FR,Barber-Westin SD.Repair of complex and avascular meniscal tears and meniscal transplantation [J].J Bone Joint Surg Am,2010,92 (4):1012-1029.
[10]Fox DB,Luther JK,Whitener D.An in vitro model to assess mechanisms and erricacy of a cellular conduit for treatment of avascular meniscal injuries [J].In Vitro Cell Dev Biol Anim,2008,44 (7):185-188.
[11]Pabbruwe MB,Kafienah W,Tarlton JF,et al.Repair of meniscal cartilage white zone tears using a stem cell collagen-scaffold implant [J].Biomaterials,2010,31 (9):2583-2591.
[12]Stabnov L,Kasukawa Y,Guo R,et a1.Effect of insulin-like growth factor-l (IGF-1)plus alendronate on bone density during puberty in IGF- I- deficient MIDI mice [J].Bone,2002,30 (6):909-916.
[13]Higgins TF,Johnson BD.Effect of exogenous IGF- 1 on chondrocyte apoptosis in a rabbit intra articular ostetomy model[J].Orthop Res,2010,28 (1):125-130.
[14]Tumia NS,Johnstone AJ.Regional regenerative potential ofmeniscal cartilage exposed to recom binant insulin-like growth factor- I in vitro [J].Bone Joint Surg (Br),2004,86(7):1077-1081.
[15]Kasemkijwattana C,Kesprayura S,Chaipinyo K,et al.Autologous chondrocytes implantation for traumatic cartilage defects of the knee [J].J Med ASSOC Thai,2009,92 (10):1282-1286.
