EBVaGC中LMP1和BHRF1的表达与血管生成淋巴管生成的关联性研究
2013-06-09王爱亮
张 伟 王爱亮 崔 凯 孙 静 李 胜△
(1济南大学山东省医学科学院医学与生命科学学院,山东 济南250062;2山东省肿瘤防治研究院,济南250117;3济宁医学院附属医院,山东 济宁272029)
EB病毒(Epstein-Barr virus,EBV)与人类多种恶性肿瘤有关,例如Burkitt淋巴瘤(BL)、Hodokin病(HD)、鼻咽癌(NPC)及胃癌(GC)等[1],胃癌细胞内存在EBV者定义为EBV相关性胃癌(EBVaGC)。EB病毒潜伏膜蛋白基因(LMP1)和EB病毒早期编码基因(BHRF1)是公认的病毒致癌基因,EBV编码的BHRF1蛋白在约90%EBVaGC组织中可检测到,但未发现LMP1的表达[2-3]。因此,我们收集EBV相关胃癌组织,利用免疫组化方法检测LMP1、BHRF1、血管内皮生长因子(VEGF-C)、淋巴细胞内皮标记物(LYVE-1)和高度糖基化的i型跨膜糖蛋白(CD34)的表达情况,探讨与临床病理的关系,从而初步了解其在EBVaGC中发生的作用。
1 资料与方法
1.1 一般资料
所有患者均来自山东省籍贯并且三代居住在山东省内的当地汉族人群。所有病例均取自山东省肿瘤防治研究院和济宁医学院附属医院病理科2008年至2012年的手术标本,采用标本均签署知情同意书。胃癌手术切除的胃癌组织标本600例(含石蜡包埋组织),选取经原位分子杂交检测鉴定EB病毒相关性胃癌30例。
1.2 方法
1.2.1 病理标本处理 标本经10%中性缓冲福尔马林固定、石蜡包埋。所有标本均以4μm连续切片,LMP1、BHRF1、VEGF-C、LYVE-1和CD34单克隆抗体按1∶200稀释,以下操作步骤按试剂盒说明进行,最后DAB(二氨基联苯胺)显色,常规复染封片。用已知的阳性切片作阳性对照,以PBS代替上述抗体作阴性对照。其中一张用苏木精-伊红染色,光镜观察进行组织病理学分类。
1.2.2 免疫组织化学(SP法) 我们应用过氧化物酶标记的链霉素(Streptavidin Peroxidase,SP)免疫细胞化学方法对上述标本中LMP1、BHRF1、VEGF-C、LYVE-1和CD34的表达水平进行检测。
1.2.3 试剂 LMP1、BHRF1、VEGF-C、LYVE-1和CD34单克隆抗体购自北京中杉金桥生物技术有限 公 司(DAKO Cytomation,Glostrup,Denmark),均为浓缩型产品。S-P试剂盒购自福州迈新公司。用已知的乳腺癌标本作为阳性对照,PBS(磷酸盐缓冲液)代替一抗作为阴性对照。
1.2.4 结果判定 阅片由两位病理科医师分别双盲阅片,LMP1、BHRF1、VEGF-C均以细胞膜或胞浆出现棕黄色颗粒为阳性细胞信号;VEGF-C以细胞膜和/或胞浆呈现棕黄色颗粒为阳性细胞。每例切片至少计数10个400倍视野,计数阳性细胞占所有细胞的百分数,阳性细胞数>25%为阳性,以阳性细胞数所占比例分为:<10%(-),11%~25%(+),25%~50%(⧺),>50%(⧻)。染色强度判定:不着色(-),浅棕黄色(+),棕黄色(⧺),棕褐色(⧻)。综合阳性细胞数和染色强度对染色结果进行分析。
采用抗CD34多克隆抗体标记微血管内皮细胞,其标记的微血管的结果判定如下:先在低倍(×100倍)镜下全面观察切片,寻找微血管高密度区,在400倍视野下,以与周围肿瘤细胞和结缔组织成分有明显区别的、任何一个染成棕黄色的内皮细胞或内皮细胞簇作为一个微血管,只要结构不相连,其分支结构也作为一个血管进行计数;但管腔>8个红细胞大小或带有肌层的血管均不计数。记录5个高倍视野内的微血管数,取其平均值作为每例的微血管密度(MVD)。
同样通过免疫组织化学方法显色,微淋巴管在光镜下为棕黄色细长管壁包绕的条索状或不规则形的管腔,以抗LYVE-1单克隆抗体标记微淋巴管内皮细胞,其标记的微淋巴管的结果判定如下:在低倍镜(×100倍)下寻找LYVE-1阳性脉管密集区,换高倍镜(×400倍)选取5个视野计数,取其平均值计算微淋巴管密度(MLVD)。
1.3 统计学方法
采用SPSS18.0统计软件对实验数据进行分析。
2 结果
2.1 3种EBVaGC临床病理因素不同水平的LMP1、BHRF1、VEGF-C的表达比较及MVD和MLVD量的比较
LMP1位于细胞膜上及胞浆中,呈棕色颗粒状分布,胞核阴性,30例EBVaGC中6例弱阳性,阳性率为20%。BHRF1位于细胞膜上及胞浆中,呈棕色颗粒状分布,30例EBVaGC中20例呈阳性,阳性率为66.67%。VEGF-C表达阳性在镜下均表现为胞浆内出现棕黄色颗粒,19例阳性,阳性率为63.33%。
免疫组织化学染色中CD34主要定位于微血管内皮细胞,组织中微血管形态不规整,分布不均;癌灶边缘血管较密集,成簇状,部分呈发芽状,管腔相对规则,但微血管分布不均。
微淋巴管在光镜下为棕黄色细长管壁包绕的条索状或不规则形的管腔,LYVE-1主要表达在癌巢周围间质脉管内皮细胞。癌巢组织内的淋巴管分布少,且管径小;癌旁周围组织淋巴管分布相对于癌巢内多,呈不规则形,并且有大量的淋巴细胞浸润。MLVD阳性脉管多呈管腔状、条索状弥漫或散在分布在癌巢周围间质,常可见癌细胞浸润。
LMP1在30例EBVaGC中6例阳性,阳性率为20%。不同TNM分期的LMP1蛋白表达阳性率的差异无统计学意义(P>0.05),有无周围淋巴结转移的LMP1蛋白表达阳性率的差异也无统计学意义(P>0.05)。BHRF1有20例阳性,阳性率为66.67%,不同TNM分期的BHRF1表达阳性率的差异有统计学意义(P<0.05)。有无周围淋巴结转移的BHRF1表达阳性率的差异有统计学意义(P<0.05),提示BHRF1表达和TNM分期级、有无周围淋巴结转移有关联。VEGF-C 19例阳性,阳性率为63.33%,有无周围淋巴结转移的VEGF-C蛋白的表达阳性率差异有统计学意义(P<0.05),提示VEGF-C蛋白的表达与EBVaGC的周围淋巴结转移(P<0.05)有关联(表1)。
2.2 形态计量学图像分析法测定MVD、MLVD结果比较
EBVaGC中MVD在不同性别、有无周围淋巴结转移之间差异无统计学意义,而在不同的TNM分期之间差异有统计学意义。形态计量学图像分析法测定MLVD发现,EBVaGC中MLVD在不同TNM分期和有无周围淋巴结转移之间差异有统计学意义(表2)。
2.3 BHRF1和VEGF-C的表达与MVD及MLVD之间的关系
30例EBVaGC组织中BHRF1阳性表达者的MVD与阴性组无差别,说明BHRF1的表达与MVD无统计学的关联,而与MLVD有统计学的关联。在VEGF-C阳性表达的19例EBVaGC组织中,MVD和MLVD均明显高于阴性组,两组比较其差异具有显著的统计学意义,说明VEGF-C可能参与EBVaGC的血管和淋巴管生成,其高表达间接促进肿瘤细胞沿新生的淋巴管迁徙和转移(表3)。

表1 3种EBVaGC临床病理因素不同水平的LMP1、BHRF1和VEGF-C表达比较
表2 3种EBVaGC临床病理因素不同水平的MVD和MLVD比较(±s)
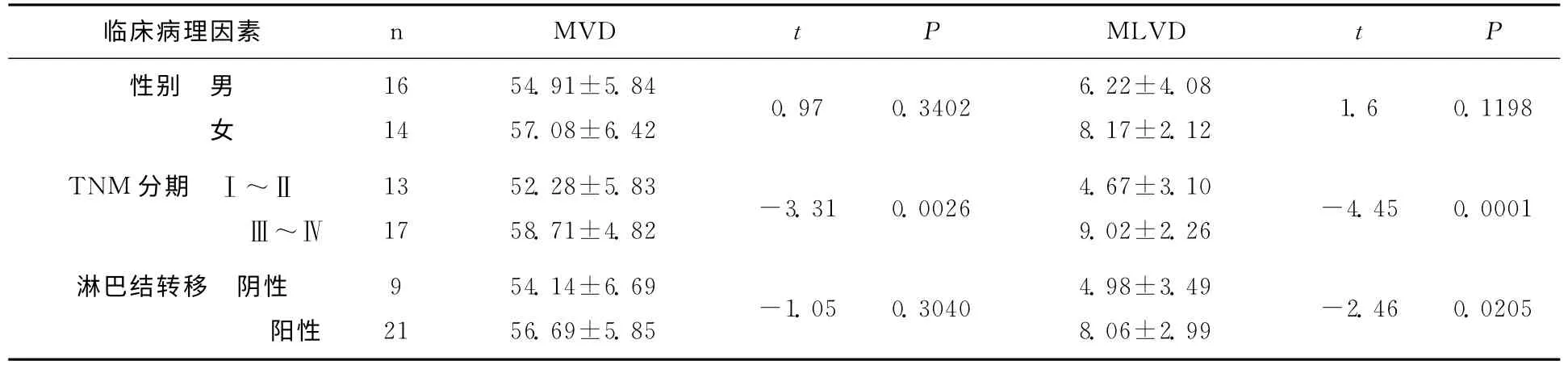
表2 3种EBVaGC临床病理因素不同水平的MVD和MLVD比较(±s)
临床病理因素 n MVD t P MLVD t P性别 男54.91±5.84女16 14 57.08±6.42 0.97 0.3402 6.22±4.08 8.17±2.12 1.6 0.1198 TNM分期 Ⅰ~ⅡⅢ~Ⅳ13 17 52.28±5.83 58.71±4.82 -3.31 0.0026 4.67±3.10 9.02±2.26 -4.45 0.0001淋巴结转移 阴性阳性9 54.14±6.69 21 56.69±5.85 -1.05 0.3040 4.98±3.49 8.06±2.99-2.46 0.0205
表3 不同BHRF1和VEGF-C水平MVD、MLVD表达情况的比较(±s)

表3 不同BHRF1和VEGF-C水平MVD、MLVD表达情况的比较(±s)
n MVD t P MLVD t P BHRF1表达 阴性阳性10 20 29.00±15.08 0.31 0.7625 4.72±1.79 8.95±3.63 30.60±9.49-3.46 0.0018 VEGF-C表达 阴性阳性11 19 36.09±10.80 -4.63<0.0001 4.59±1.75 8.99±3.73 18.20±9.04-3.67 0.001
3 讨论
EBVaGC是一个新出现的概念,因胃癌细胞中存在EB病毒而得名。据估计,全球每年新增EBVaGC患者多于80万人[4],而全球10%的胃癌病例被证实与EB病毒相关[5]。EBVaGC在临床上表现为以男性为主,发病年龄较小,多发生在胃上部和胃体部,肿瘤直径较小。EBVaGC较少发生淋巴结转移,5年存活率可达66.2%,比EB病毒非相关性胃癌(EBVnGC)高[6]。
LMP1是EB病毒编码的一种6次跨膜蛋白,与细胞粘附性改变、细胞外基质降解和肿瘤血管生成等均有密切的联系[7]。EBVaGC为I型潜伏感染,表达EBNA1,EBERs和BARF0,部分病例表达LMP2A4种I型潜伏感染基因,而不表达LMP1和EBNA2[8]。本次实验结果显示在30例EBVaGC中6例呈弱阳性(阳性率20%),与性别、分期及有无周围淋巴结转移方面无统计学关联,说明在EBVaGC中LMP1呈低表达,对EBVaGC发生淋巴转移作用有限。
BHRF1属EB病毒早期抗原,在EB病毒溶解复制周期的早期大量表达,和Bcl-2具有部分相同的蛋白序列,可能与Bcl-2一样能延缓细胞的终末分化,增加抵抗DNA损伤药物和促进细胞在无血清情况下生存,从而抑制细胞凋亡[9]。在本次试验中,我们通过对30例EBVaGC标本的免疫组化染色证实,BHRF1在30例EBVaGC中20例阳性(阳性为66.67%),其高表达与TNM分期和周围淋巴结转移有统计学关联,表明BHRF1高表达可能促进EBVaGC病情进展。
本文通过形态计量学图像分析法测定MLVD,发现在EBVaGC中MLVD与TNM分期和周围淋巴结转移关系密切(表2),而20例BHRF1阳性患者与10例BHRF1阴性患者中MLVD平均值亦存在显著差异,与淋巴结转移情况吻合。但形态计量学图像分析法测定的MVD与TNM分期显著相关,而与性别、周围淋巴结转移无关。因此,根据实验结果,我们推论EBVaGC较少发生淋巴结转移与BHRF1的高表达可能抑制EBVaGC周围淋巴转移有关。
通过免疫组化与组织学观察对EBVnGC(EB病毒非相关性胃癌)与EBVaGC病理切片进行比较,结果表明EBVnGC组织中微血管形态不规整,分布不均,以癌肿边缘为主,而EBVaGC肿瘤微环境中,微血管和微淋巴管的增生较少,因而可能减少其淋巴转移的风险,该发现与临床EBVaGC较少发生淋巴结转移亦相符。
VEGF-C是新近鉴定出的淋巴管生长因子,也是酪氨酸激酶受体(VEGFR-3/fit-4)的特异性配体,能通过选择性地诱导淋巴管生成促进淋巴结转移播散[10]。
目前关于VEGF-C的研究在鼻咽癌等头颈部肿瘤中已较为深入,大量研究提示其表达与淋巴转移关系密切[11],EBV编码的LMP1蛋白可以通过直接或间接的方式上调VEGF-C的表达,从而对鼻咽癌的淋巴转移及发生发展起到促进作用[12]。而本次实验以胃癌患者为研究对象,在EBVaGC标本中对比19例VEGF-C阳性标本和11例VEGF-C阴性标本的微血管和微淋巴管生成情况,结果发现,19例VEGF-C阳性表达EBVaGC中,MVD和MLVD均明显高于阴性组,其差异具有统计学意义,提示VEGF-C表达水平的上调可能与微血管和微淋巴管增生关系密切(表3),可能参与EBVaGC的血管和淋巴管生成,其高表达间接促进肿瘤细胞沿新生的淋巴管迁徙和转移。
目前已知在鼻咽癌中LMP1存在高表达,它与VEGF的表达和鼻咽癌的侵袭性、血管生成密切相关。而在本研究中发现EBVaGC中存在LMP1低表达和BHRF1高表达,与鼻咽癌存在差异。而EBVaGC和NPC中侵袭性、血管生成和淋巴管生成的差异是否与LMP1和BHRF1的表达差异有关,LMP1和BHRF1的表达在EBVaGC和NPC发生发展过程中的作用,甚至以及EBVaGC和NPC中的侵袭性、血管生成和淋巴管生成关系等分子机理等,仍有待进一步研究。
[1] Fukayama M,Hino R,Uozaki H.Epstein-Barr virus and gastric carcinoma:virus-host interactions leading to carcinoma[J].Cancer Sci,2008,99(9):1726-1733.
[2] Decaussin G,Sbih-Lammali F,de Turenne-Tessier M,et al.Expression of BARF1gene encoded by Epstein-Barr virus in nasopharyngeal carcinoma biopsies[J].Cancer Res,2000,60(19):5584-5588.
[3] Seto E,Yang L,Middeldorp J,et al.Epstein-Barr virus(EBV)-encoded BARF1gene is expressed in nasopharyngeal carcinoma and EBV-associated gastric carcinoma tissues in the absence of lytic gene expression[J].J Med Virol,2005,76(1):82-88.
[4] 陈莉,朱远源.肿瘤研究的新热点-EB病毒[J].肿瘤防治研究,2008,5(10):750-754.
[5] Chen JN,He D,Tang F,et al.Epstein-Barr virus-associated gastric carcinoma:a newly defined entity[J].J Clin Gastroenterol,2012,6(4):262-271.
[6] van Beek J,zur Hausen A,Klein Kranenbarg E,et al.EBVPositive gastric adenocarcinomas:a distinct clinicopathologic entity with a low frequency of lymph node involvement[J].J Clin Oncol,2004,22(4):664-670.
[7] 欧小波,陈小毅.EB病毒潜伏膜蛋白1与肿瘤转移研究的进展[J].肿瘤防治研究,2005,34(1):72-74.
[8] 张霞,刘霞,荆永正,等.EB病毒相关胃癌及鼻咽癌组织病毒主要潜伏期基因启动子甲基化状态分析[J].青岛大学医学院学报,2010,46(5):399-406.
[9] Nicholls J,Kremmer E,Meseda CA,et al.Comparative analysis of the expression of the epstein‐barr virus(EBV)anti‐apoptotic gene BHRF1in nasopharyngeal carcinoma and EBV‐related lymphoid diseases[J].J Med Virol,2001,65(1):105-113.
[10]石小燕,胡国清,袁响林,等.VEGF-C与鼻咽癌增殖和转移的关系[J].中华肿瘤杂志,2006,8(5):364-367.
[11]赵国光,向晓娟,何友兼.血管内皮生长因子C,D在鼻咽癌组织中的表达及其临床意义[J].癌症,2007,6(1):90-95.
[12]易翔唐,覃颖.EB病毒潜伏膜蛋白-1和环氧合酶-2及血管内皮生长因子C在鼻咽癌中的表达及其关系[J].临床耳鼻咽喉头颈外科杂志,2010,(3):126-128.
