全肺切除术后辅助化疗的5年生存分析
2013-06-09
上海交通大学附属仁济医院胸外科,上海 200127
全肺切除术后辅助化疗的5年生存分析
梁而慷 曹子昂 郑家豪 汤峻 付于捷 唐健 孙志勇
上海交通大学附属仁济医院胸外科,上海 200127
背景与目的:全肺切除术能有效提高中晚期肺癌患者的切除率,术后辅助化疗也已经成为肺叶切除术后肺癌患者的一种重要的治疗手段,但全肺切除术后辅助化疗是否能提高肺癌患者的生存获益目前仍有争议,本研究通过对全肺切除术后辅助化疗患者的5年生存分析,评价其疗效及临床意义。方法:回顾分析1998年1月—2006年12月于上海交通大学附属仁济医院胸外科接受全肺切除术的67例肺癌患者的临床资料,以是否按时完成术后辅助化疗分为化疗组(n=30)和非化疗组(n=37),随访其5年生存状况,应用SAS9.13统计学软件包处理数据,判断其1、3、5年的生存率差异是否有统计学意义。在大组分析的结果中,以病理类型、临床分期、N2组别、手术侧、手术方法等可能影响长期生存结果的因素进行亚组分析。结果:两组基本参数一致,全肺切除术后化疗组1、3、5年生存率分别为79.76%、53.58%、34.44%,非化疗组分别为59.46%、32.43%和21.62%。两组比较3年生存率差异有统计学意义(P<0.05)。亚组分析显示在非小细胞肺癌组及鳞癌组中,化疗组3年生存率分别为70.30%、75.41%,非化疗组分别为37.50%、40.00%,差异有统计学意义(P<0.05)。Ⅲa组中,化疗组1年生存率为93.55%,非化疗组为50.00%,差异有统计学意义(P<0.05)。各亚组中,化疗组和非化疗组的长期生存率差异均无统计学意义。结论:全肺切除术后辅助化疗能提高肺癌患者的早期生存率,但对于提高长期生存率作用有限。为改善长期生存状况,对合适患者进行巩固化疗,以及放化疗联合应用可能是一种有效的方法。
全肺切除术;肺癌;辅助化疗
近30年来,我国肺癌病死率已上升了46.8%,占全部恶性肿瘤死亡人数的22%。从2005年起,肺癌的发病率及病死率已跃居“众癌之首”,据国家卫生机构预计,到2025年,我国每年死于肺癌的人数将接近100万例。
尽管多项循证医学证据表明,肺癌的治疗应是以手术为中心的综合治疗,其中术后辅助化疗已被多个临床试验证实能使患者获益[1],但是否在全肺切除术后,尤其是右全肺切除术后患者中应用辅助化疗始终存在争议。为此,本研究回顾性分析了自1998年1月—2006年12月于上海交通大学附属仁济医院胸外科接受全肺切除术的71例肺癌患者的临床资料,现将术后5年的生存随访结果报道如下。
1 资料和方法
1.1 一般资料
71例行肺癌全肺完全切除术的患者中,男性60例,女性11例,年龄36~76岁,中位年龄58岁,60岁以上29例。病理类型:鳞癌35例(49.3%);腺癌19例(26.8%);小细胞癌10例(14.1%);大细胞癌4例(5.6%);腺鳞癌3例(4.2%)。中央型肺癌53例(74.6%);周围型肺癌18例(25.4%)。本组患者病理分期均根据术后病理结果,参照IASLC/UICC2009年第7版肺癌TNM分期标准分期,Ⅱb期10例(14%)、Ⅲa期33例(46%),Ⅲb期24例(34%),Ⅳ期4例(6%)。术前KPS评分均≥70,术后辅助化疗前KPS评分均≥60。术前肺功能评估及动脉血气分析均符合全肺切除标准。71例患者中,围手术期死亡4例(术后40 d内死亡),其中1例因术中心血管意外死亡,3例均死于术后肺部感染、呼吸衰竭,与肿瘤无关,不列入研究对象。余下67例患者分为两组,术后6周内开始辅助化疗,并按时完成4个疗程以上为化疗组(n=30);未完成术后辅助化疗为非化疗组(n=37),进行对照研究。
1.2 方法
1.2.1 手术方法
71例全肺切除术,左侧全肺切除术33例,右侧全肺切除术38例。共有32例行心包内全肺切除术,心包缺损较大者予以补片修补,留孔引流,全组未发生心包填塞及心脏疝。
1.2.2 化疗方法
化疗组采用含铂的二联化疗方案,要求完成4个疗程以上的辅助化疗。其中GP方案17例(吉西他滨1 000 mg/m2第1天,第8天+顺铂30 mg/m2×3 d)、NP方案5例(长春瑞滨25 mg/m2,第1天,第8天+顺铂30 mg/m2×3 d)、TP方案5例(紫杉醇135 mg/m2+顺铂30 mg/m2×3 d)、EP方案3例(足叶乙苷80 mg/m2×5 d+顺铂30 mg/m2×3 d)。
1.2.3 随访
随访日期为自1998年1月—2006年12月肺癌全肺切除术后患者,随访期为2007年3月—2011年12月,经门诊及电话随访67例,随访率为100%。
1.3 统计学处理
以每6个月为时间点,计算患者生存情况,判断两组1、3、5年生存率是否有统计学差异。在大组分析的结果上,以病理类型、肿瘤形态、临床分期、N分期、T分期、手术侧、手术方法等可能影响长期生存结果的因素进行亚组分析,判断两组1、3、5年生存率差异是否有统计学意义。两组之间计量资料的比较在满足正态分布的情况下采用(最小值,最大值)进行描述,两组方差齐的情况下采用成组t检验,不齐的情况下采用t检验。计数资料采用例数(构成比)进行描述,两组之间构成比的比较采用χ2检验,不满足χ2检验的条件,采用确切概率。各年生存率采用寿命表法进行估计,两组生存率曲线之间的比较采用Wilcoxon-Breskow检验,5年生存率的比较采用χ2检验。α=0.05。所有数据采用SAS 9.13计算。P<0.05为差异有统计学意义。
2 结 果
2.1 化疗组和非化疗组基本情况比较
化疗组患者于术后6周(术后13~42 d)内开始辅助化疗,并按时完成4个疗程以上,其中12例曾于术前接受过1~2次新辅助化疗;非化疗组患者未完成术后辅助化疗,其中7例曾于术前接受过1~2次新辅助化疗,术后因骨髓严重抑制或PS状态较差未能完成辅助化疗。
两组年龄、性别、身高、体重、吸烟指数、病理类型、肿瘤形态、T、N分期、手术范围、手术侧、kps评分等临床资料基本均衡(表1、表2)。
2.2 两组的生存期比较
化疗组1、3、5年生存率分别为79.76%、53.58%和34.44%,非化疗组分别为59.46%、32.43%和21.62%。两组比较,3年生存率差异有统计学意义(P<0.05),1、5年生存期差异无统计学意义(P>0.05)。
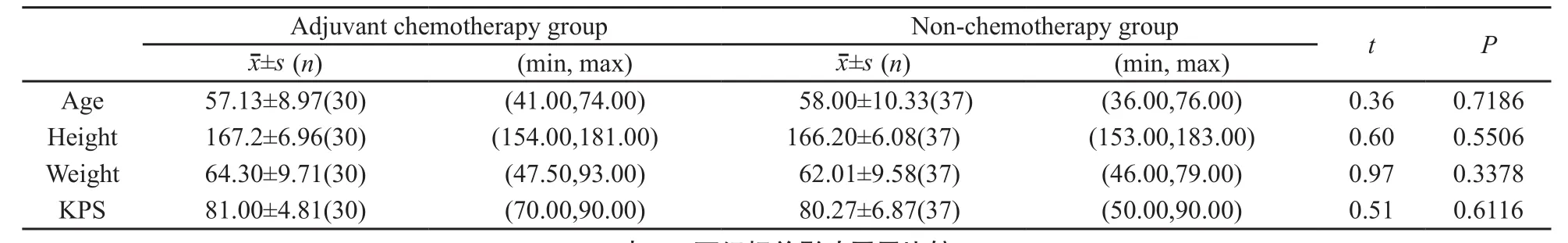
表 1 两组基本因素比较Tab. 1 The comparison of baseline in two groups
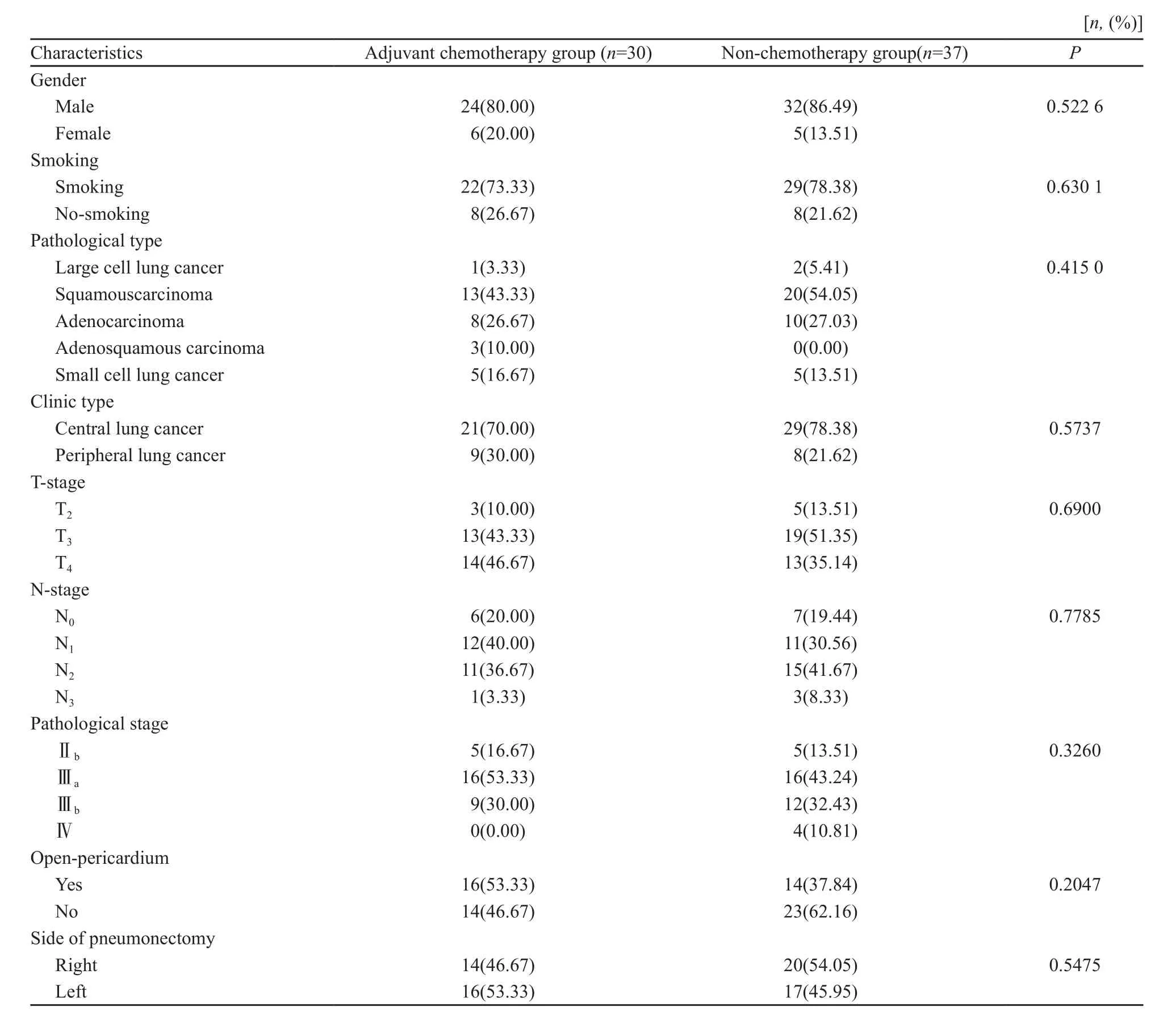
表 2 两组相关影响因子比较Tab. 2 The comparison of baseline in various factors
2.3 辅助化疗对不同病理类型患者生存率的影响
非小细胞肺癌(non-small cell lung cancer,NSCLC)患者化疗后,3年生存率为70.30%,其中鳞癌患者为75.41%;未采用化疗的NSCLC患者的3年生存率为37.50%,其中鳞癌患者为40.00%,差异有统计学意义(P<0.05)。长期生存差异无统计学意义(图1B、C)。大细胞癌组、腺癌组及小细胞癌组生存率差异无统计学意义。
2.4 辅助化疗对不同T、N分期患者生存率的影响
Ⅲa期患者中,化疗组1年生存率为93.55%,非化疗组为50.00%,差异有统计学意义(P<0.05),因均以晚期患者为主,3、5年生存率差异无统计学意义(图1D)。N2期患者中,化疗组和非化疗组的生存率差异无统计学意义(P>0.05,图1E)。

图 1 术后辅助化疗和非辅助化疗患者生存曲线Fig. 1 The survival curve of the adjuvant chemotherapy group and the non-chemotherapy group
2.5 不同手术侧辅助化疗对不同T、N分期患者生存率的影响
右全肺切除和左全肺切除患者,经心包全肺切除和非经心包全肺切除患者中,术后辅助化疗和非辅助化疗的生存率比较差异无统计学意义(P>0.05)。
3 讨 论
对于无法进行肺叶切除或袖状切除术的中晚期肺癌患者,全肺切除术通过扩大手术区域可有效提高肿瘤的完全切除率,但大量Meta分析证据显示,外科手段无法清除区域内残留癌细胞及微转移灶,单纯扩大手术范围并不能改善患者的生存情况,术后辅助化疗理论上可以控制手术区域残留癌细胞及周边区域的微小转移灶,减少肿瘤转移和复发的危险,是肺癌术后综合治疗的主要手段。
术后辅助化疗在小细胞肺癌中的疗效已经得到了较一致的认可[1],但应用于NSCLC曾经颇有争议。意大利肺癌辅助化疗项目(Adjuvant Lung Project Italy,ALPI)[2](MVP方案)认为NSCLC完全切除术后辅助化疗不能提高生存率;英国肺癌辅助化疗试验(The Big Lung Trial,BLT)[3](MIC和MVP方案)同样显示了阴性结果。两个报告同时提示,辅助化疗可能增加非肿瘤病死率。包括上述两项研究在内的早期临床随机对照试验均否定了NSCLC术后辅助化疗的价值[4]。
随着以顺铂为主联合第三代化疗药物应用于临床后,陆续出现的国际肺癌辅助治疗研究(法国)(International Adjuvant Lung Cancer Trial,IALT)[5]、CALGB9633(美国)[6]、JBR10(加拿大)[7]等临床研究认为术后辅助化疗能使Ⅰb~Ⅲa期的NSCLC患者获益,但同时也增加了早期非肿瘤死亡的危险(IALT)[4-5],IALT研究包括36%的Ⅰ期患者、24%的Ⅱ期患者以及近40%的Ⅲ期患者,其中,有1/3患者接受了全肺切除术,术后辅助化疗能使这些患者获益[8]。
尽管NSCLC肺叶切除术后辅助化疗能使患者获益,但全肺切除术后应用辅助化疗的疗效和安全性仍有较大争议,因全肺切除术切除了更多有功能的肺组织,尤其是右全肺切除术。在术后1个月内,肺功能各项指标均显著降低,6个月后逐步恢复到一个稳定水平。右全肺切除和老年全肺切除术后患者需要约1年才能恢复到一个稳定水平[9]。远期肺功能水平可以和其他肺切除组无明显区别[10]。肺功能下降会影响组织氧供并导致患者KPS评分降低,在此状态下接受术后辅助化疗可能面对更高的非肿瘤死亡风险,故而,化疗的安全性应是首要考虑的决定因素,廖美琳等[1]认为术后辅助化疗的主要决定因素在于体力状态评分(performance status,PS)而非切除术本身。高卫等[11]通过对1 350例NSCLC预后因素的分析,也发现KPS评分与NSCLC患者的预后呈显著正相关。本组患者中与化疗相关的非肿瘤病死率约1.4%,与IALT的结果相近。右全肺和左全肺切除在生存获益方面无明显差异。研究提示,通过细致的手术操作、完善的术后处理和健康宣教,避免过早过高强度的活动,全肺切除术后患者在术后6周内达到接近肺叶切除术后的KPS水平是可能实现的,本组患者辅助化疗前KPS评分均≥60,化疗完成率为78.9%。全肺术后辅助化疗的困难期在第1、第2个周期,这也是术后肺功能最差的谷底期,为顺利度过这一时期,首先必须选择不良反应较小的方案,本组30例患者以GP (吉西他滨+铂类)方案为主,对PS状态的影响相对较小,是主要有利因素。其次,在辅助化疗初期,可适当减少药物用量,取其基本剂量之下限,而在其后各周期中逐渐加量,在4~5个周期内完成全剂量,可以提高全肺切除术后患者化疗的安全性。术后辅助化疗开始时间需依据患者的全身情况,理论上应在术后30 d内开始。本组患者因为全肺切除的原因,化疗的开始时间被控制在术后6周以内,最早的患者于术后13 d接受第1次辅助化疗,平均开始时间为术后26.3 d,小于肿瘤细胞的倍增时间(鳞癌92 d,腺癌168 d),符合术后辅助化疗的要求。本组结果显示,全肺切除术后辅助化疗能提高患者的早期生存状况,两组3年生存率差异有统计学意义,但1、5年生存率差异无统计学意义。原因可能与本组主要为中晚期患者,Ⅲ期以上患者占85%,短期化疗的有效不能改变长期病程中肿瘤复发和转移的产生。
新辅助化疗可能使Ⅲ期患者得到生存获益[12-14],但也可能增加术后风险,对于化疗非敏感人群,还存在疾病进展的危险[15]。de Boer等[16]认为,新辅助化疗是安全可行的。Roberts等[17]认为新辅助化疗可能增加术后严重肺部感染的风险。Niwa等[18]则认为,新辅助化疗会使术后并发症和死亡率增加。丁嘉安等[19]对107例患者进行分组对照研究,结果显示,新辅助化疗对NSCLC围手术期的安全性无显著影响,但此项研究没有对肺叶切除术和全肺切除术进行分组观察。本组有19例患者曾接受1~2次的新辅助化疗,其中7例未能完成术后辅助化疗,提示术前新辅助化疗可能是全肺切除术后患者完成术后辅助化疗的不利因素,统计分析显示新辅助化疗未能使本组患者生存获益情况有显著提高,可能与样本量较小有关。本研究在大组分析的结果上,依据病理类型、肿瘤形态、临床分期、N分期、T分期、手术侧、手术方法等可能影响长期生存结果的因素进行了亚组分析。
有学者认为右全肺切除术后患者肺功能很差,化疗不能延长生存期[20-21],而左全肺切除术后患者化疗获益的可能性更大,建议区别对待[22]。本组结果显示右全肺切除和左全肺切除在生存率上无统计学差异。尤其是NSCLC鳞癌组,早期生存率差异有统计学意义,但长期生存率差异无统计学意义。该结果可能与化疗方案以吉西他滨和铂类(GP方案)为主有关,GP方案已被证实对鳞癌更有效。
Ⅲa期患者能从术后辅助化疗中获益,但同样仅限于早期生存率(1年)。与国内外多项研究结果一致。王勐等[22]报道Ⅲa期NSCLC左全肺切除术后辅助化疗可以提高生存率,Xu等[23]报告只有Ⅲ期NSCLC患者能从术后辅助化疗中获益。王思愚等[24]报告术后化疗能显著提高Ⅲa期NSCLC患者1、2年生存率,但3年以上生存率差异无统计学意义。Ⅲa期患者病变范围较大伴局部淋巴转移和微转移可能,单纯手术治疗难以取得较好的效果,术后辅助化疗可能改善其早期生存状态。本组Ⅲb期患者无生存获益,Barlesi等[25]和韦尉东等[26]分别对Ⅲb期完全切除术后肺癌患者的生存分析,同样提示辅助化疗无生存优势。
本组研究结果提示N2期患者单纯术后辅助化疗无明显获益。王思愚等[27]报道了266例N2期肺癌患者的疗效,提出纵隔淋巴结转移数目和转移程度,是影响NSCLC患者预后的重要因素。王长利等[22]经对3 894例手术后NSCLC患者的临床分析后认为,N2期患者应进行辅助放疗。林勇斌等[28]对288例手术切除的Ⅲa N2期NSCLC患者研究表明,术后放化疗组较单纯化疗组的的生存时间明显延长。王洲等[29]通过对N2肺癌根治术后肿瘤复发模式的临床分析,指出手术后单纯化疗对N2患者局部复发和转移性复发的的预防作用均不显著,加用放疗后可以使局部复发的概率明显下降,其结论佐证了本研究的结果。
总之,全肺切除术后辅助化疗能提高肺癌患者的早期生存率,显示了辅助化疗在肺癌综合治疗中的重要地位,但对于提高长期生存率作用有限。
[1] 廖美琳. 肺部肿瘤学[M]. 上海: 上海科学技术出版社, 2008.
[2] SCAGLIOTTI G, FOSSATI P, TORRI V, et al. Randomized study of adjuvant chemotherapy for completely resected stageⅠ, Ⅱ, ⅢA non-small cell lung cancer [J]. J Natl Cancer Inst, 2003, 95(19): 1453-1461.
[3] WALLER D, STEPHENS R J, SPIRO S G, et al. The Big Lung Trial (BLT): Determining the value of cisplatin-based chemotherapy for all patients with non-small cell lung cancer (NSCLC)-Preliminary result in the surgical setting[J]. Proc Am Soc Clin Oncol, 2003, 22: 632.
[4] 吴一龙. 非小细胞肺癌术后辅助化疗: 做, 还是不做?[J]. 循证医学, 2003, 3(2): 65-67.
[5] LE CHEVALIER T. For the IALT Investigators. Results of the randomized International Adjuvant Lung Cancer Trial (IALT): Cisplatin-based chemotherapy (CT) vs. no CT in 1867 patients(pts) with resected non-small cell lung cancer (NSCLC)[J]. Proc Am Soc Clin Oncol, 2003, 22(Abstr): 6.
[6] STRAUSS G, HERNDON J, MADDAUS M, et al. Randomized clinical trial of adjuvant chemotherapy with paclitaxel and carboplatin following resection in stage ⅠB non-small cell lung cancer :Report of cancer and Leukemia Group B Protocol 9633[J]. Proc Am Soc Clin Oncol, 2004, 23(Suppl): 7019.
[7] WINTON T, LIVINGSTON R, JOHNSON D, et al. A prospective randomized trial of adjuvant vinorelbine and cisplatin in completely resected stage Ⅰb and Ⅱnon-small cell lung cancer intergroup JBR.10 [J]. Proc Am Soc Clin Oncol, 2004, 23(Suppl): 7018.
[8] RODRIGO A, ARIANE D, JEAN P P, et al. Long-term results of the International Adjuvant Lung Cancer Trial evaluating adjuvant cisplatin-based chemotherapy in resected lung cancer [J]. J Clin Oncol, 2010, 28(1): 35-42.
[9] 龚太乾, 蒋耀文, 王如文, 等. 全肺切除术对肺功能的影响[J]. 第三军医大学学报, 2005, 27(7): 89-95.
[10] FERGUSON M K, KARRSION T. Dose pneumonectomy for lung cancer adversely influence long-term survival?[J]. J Thorac Cardiovasc Surg, 2000, 119(3): 440-448.
[11] 高卫, 王宝成, 狄剑时, 等. 非小细胞肺癌预后因素的Cox回归分析[J]. 肿瘤研究与临床, 2003, 15(6): 91-96.
[12] ZHOU Q H, LIU L X, LI L, et al. A randomized clinic trial of preoperative neoadjuvant chemotherapy followed by surgery in the treatment of stage Ⅲ non-small cell lung cancer [J]. Lung Cancer, 2003, 41(Suppl 2): 45-46.
[13] BARLESI F, DODDOLI C, CHETAILLE B, et al. Survival and postoperative complication in daily practice after neoadjuvant therapy in resectable stage ⅢA-N2 non-small cell lung cancer[J]. Inter Cardio Thoracic Surg, 2003, 2(4): 558-562.
[14] STAMATIS G, EBERHARD W, POTTGEN C, et al. Trends in diagnosis and therapy of lung cancer. Surgery after multimodality treatment for non-small cell lung cancer [J]Lung cancer, 2004, 45(Suppl 2): 107-112.
[15] BETTICHER D C, ROSELL R. Neoadjuvant treatment of early-stage resectable non-small cell lung cancer [J]. Lung Cancer, 2004, 46(Suppl 2): 23-32.
[16] DE BOER R H, SMITH I E, PASTORINO U, et al. Pre-operative chemotherapy in early stage resectable non-smallcell lung cancer a randomized feasibility study justifying a multicentre phase Ⅲ trial[J]. Br J Cancer, 1999, 79(9-10): 1514-1518.
[17] ROBERTS J R, EUSTIS C, DEVORE R, et al. Induction chemotherapy increases perioperative complications in patients undergoing resection for non-small cell lung cancer[J]. Ann Thorac Surg, 2001, 72(3): 885-888.
[18] NIWA H, NAKAMAE K, YAMADA T, et al. Assessment of extensive surgery for locally advanced lung cancer. safety and efficacy of induction therapy[J]. Jpn J Thorac Cardiovasc Surg, 1999, 47(9): 411-418.
[19] 丁嘉安, 王兴安, 杨倍, 等. 新辅助化疗对围手术期非小细胞肺癌患者的影响[J]Chin J lung Cancer, 2003, 6(6): 148-156.
[20] MARTIN J, GINSBERG R J, ABOLHODA A, et al. Morbidity and mortality after neoadjuvant therapy for lung cancer: the risk of right pneumonectomy[J].Ann Thorac Surg, 2001, 72(4): 1149-1154.
[21] 中国抗癌协会肺癌专业委员会. 中国肺癌临床指南[M]. 北京: 人民卫生出版社, 1997: 104-106.
[22] 王勐, 王长利, 宫立群, 等. 非小细胞肺癌患者左全肺切除术后化疗的疗效[J]. 癌症, 2007, 26(12): 1365-1368.
[23] XU G, BONG T, LIN P, et al. Adjuvant chemotherapy following radical surgery for non-small-cell lung cancer;a randomized study on 70 patients[J]. Chin Med J (Engl), 2000, 113(7): 617-620.
[24] 王思愚, 戎铁华, 区伟, 等. Ⅲa-N```2`期非小细胞肺癌术后化疗随机对照研究结果[J]. Chin J Lung Cancer, 2006, 9(5): 346-352.
[25] BARLESI F, DODDO LI C, TORRE J P, et al. Comparative prognostic features of stage Ⅲa-N2and Ⅲb non-smallcell lung cancer patients treated with surgery after induction therapy [J]European Journal of Cardio-Thoracic Surgery,2005, 28(10): 629-634.
[26] 韦尉东, 王思愚, 林鹏, 等. ⅢB期非小细胞肺癌完全切除术后生存分析 [J]中国肺癌杂志, 2007, 6(2): 107-110.
[27] 王思愚, 吴一龙, 戎铁华, 等. Ⅲ期N2非小细胞肺癌外科治疗[J].中华肿瘤杂志, 2002, 24(6): 605-608.
[28] 林勇斌, 梁颖, 林鹏, 等. 288例手术切除的Ⅲa-N2期非小细胞肺癌患者的生存分析[J]. 中国肺癌杂志, 2009, 12(6): 587-590.
[28] 王洲, 刘相燕, 刘凡英, 等. N2肺癌根治术后肿瘤复发模式的临床分析[J]. 中国肿瘤临床, 2004, 31(13): 752-754.
An analysis of 5-year survival after pneumonectomy and adjuvant chemotherapy in lung cancer
LIANG Er-kang, CAO Zi-ang, ZHENG Jia-hao, TANG Jun, FU Yu-jie, TANG Jian, SUN Zhi-yong (Department of Thoracic Surgery of Renji Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200127, China)
CAO Zi-ang E-mail: dr_cao@163.com
Background and purpose: The resection rate may be improved by pneumonectomy in late stage cases of lung cancer, and adjuvant chemotherapy is one of the important treatment methods after lobectomy, however, whether the lung cancer patients may benefit from adjuvant chemotherapy after pneumonectomy is still controversial currently. This study was to observe 5-year survival of the cases who had been performed adjuvant chemotherapy after pneumonectomy, and evaluate the efficacy of treatment. Methods: From Jan.1998 to Dec.2006, 67 patients underwent pneumonectomy for lung cancer in our hospital, they were divided into two groups, the adjuvant chemotherapy group
four cycles chemotherapy (n=30), while the another group did not receive chemotherapy after operation (n=37). Patients were followed up for 5-year survival rate, the short- and long-term treatment efficacy were analyzed by SAS 9.13. Pathological type, TNM stage, side of pneumonectomy and other factors which may influence the survival rate are included in subgroup analysis. Results: The 1-, 3-, and 5-year survival rates were 79.76%, 53.58%, and 34.44% in adjuvant chemotherapy group, while 59.46%, 32.43% and 21.62% in group without adjuvant chemotherapy. The shortterm survival rate (3-year) was significantly higher in chemotherapy group than in control group (P<0.05), while the long-term survival rate had no significant difference between the two groups (P>0.05). Squamous carcinoma group, andⅢa group have the positive result in subgroup analysis. Conclusion: The adjuvant chemotherapy after pneumonectomy may improve short-term survival rate in lung cancer.
Pneumonectomy; Adjuvant chemotherapy; Lung cancer
10.3969/j.issn.1007-3969.2013.05.010
R734.2
:A
:1007-3639(2013)05-0375-07
2012-11-15
2013-03-15)
曹子昂 E-mail:dr_cao@163.com
