miRNA-196b过表达对K562细胞增殖、凋亡及survivin、Cox-2表达的影响
2013-06-09尹虹刘玥郑文岭宋艳斌马文丽
尹虹 刘玥 郑文岭 宋艳斌 马文丽
南方医科大学基因工程研究所,广东 广州 510515
miRNA-196b过表达对K562细胞增殖、凋亡及survivin、Cox-2表达的影响
尹虹 刘玥 郑文岭 宋艳斌 马文丽*
南方医科大学基因工程研究所,广东 广州 510515
背景与目的:BCR-ABL融合基因是慢性粒细胞白血病发病的分子病理基础,也是诊断慢性粒细胞白血病、观察疗效、评估预后等的有效指标。miRNA-196b在急性粒细胞白血病中低表达并对疾病的发展起主要作用。在慢性粒细胞白血病中miRNA-196b的靶基因为BCR-ABL,miRNA-196b过表达抑制BCR-ABL融合基因的表达。生存素(survivin)是BCR-ABL的一个下游基因,已在多种肿瘤中发现survivin与环氧化酶-2(Cox-2)协同调节细胞的增殖凋亡。本研究旨在探讨miRNA-196b过表达对K562细胞增殖、凋亡及survivin、Cox-2 mRNA表达的影响。方法:实验分为K562-196b组、空载K562-pLV组与K562组,采用CCK-8法检测细胞增殖;采用AnnexinⅤ-PE检测细胞凋亡;采用实时荧光定量PCR法检测Cox-2、survivin mRNA的表达情况。结果:miRNA-196b过表达可以明显抑制K562细胞增殖;K562-196b组细胞凋亡率显著高于K562组(P<0.05);miRNA-196b组中survivin基因显著低表达(P<0.05),Cox-2基因中无明显变化(P>0.05)。结论:miRNA-196b对K562细胞的增殖抑制和诱导凋亡有显著作用;miRNA-196b过表达可下调survivin基因的表达,为miRNA-196b作为慢性粒细胞性白血病的治疗靶点提供了依据。
miRNA-196b;K562细胞;细胞增殖;细胞凋亡
BCR-ABL融合基因所编码的具有络氨酸激酶活性的P210融合蛋白在慢性粒细胞白血病(chronic myelogenous leukemia,CML)的发生中起着重要作用[1],是研究治疗CML的关键所在。伊马替尼作为治疗CML的一线用药,其作用机制就是通过抑制BCR-ABL蛋白的自身磷酸化和底物磷酸化,使BCR-ABL阳性细胞的增生受到抑制或凋亡。但随着越来越多的耐药情况出现,需要寻找治疗CML的新方法或补充途径。
在我们之前的研究中,已经验证了miRNA-196b的靶基因为BCR-ABL,miRNA-196b过表达可下调BCR-ABL的表达。又有研究表明miRNA-196b在急性粒细胞白血病(acute myeloid leukemia,AML)中低表达[2],并且对混合淋巴细胞型白血病的发展起重要作用[3]。因此,推测miRNA-196b在CML的治疗中也有着重要的意义。
生存素(survivin)和环氧化酶-2(Cox-2)这两种细胞因子均可抑制细胞凋亡,并在肿瘤的形成中发挥重要作用。Survivin作为BCR-ABL的一个下游基因,以survivin为分子靶点的联合治疗策略是近来CML治疗的研究热点。Cox-2不仅能够促进细胞黏附,抑制细胞凋亡的发生,促进肿瘤侵袭和转移,还发现Cox-2高表达与白血病进展及预后不良有密切关系。miRNA-196b过表达抑制BCR-ABL融合基因,是否对survivin、Cox-2 mRNA的表达也有影响,值得深入研究。本实验用慢病毒介导的miRNA-196b处理K562细胞,检测miRNA-196b对细胞增殖、凋亡的影响,以及Cox-2、survivin癌症因子表达的变化,从分子水平探讨针对BCR-ABL的CML的治疗。
1 材料和方法
1.1 菌株、细胞及其培养
K562细胞293T细胞和大肠杆菌DH5α为本实验室保存[4]。K562细胞接种于含体积分数10%的胎牛血清,青霉素、链霉素各100 U/mL的RPMI-1640培养液中,置于37 ℃、CO2体积分数为5%的培养箱,饱和湿度下培养。每隔2~3 d换液传代。
1.2 主要试剂
慢病毒载体pLVTHM以及包装质粒均为本实验室保存[5];CCK-8试剂盒购于日本同仁株社;AnnexinⅤ-PE细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;限制性内切酶、MMLV-RT反转录试剂盒、DNA连接酶、DNA聚合酶和转染试剂LipofectamineTM2000购自Invitrogen公司;琼脂糖凝胶DNA回收试剂盒、PCR产物纯化试剂盒和质粒提取试剂盒购自美国Promega公司;实验所用引物由上海英俊公司合成。
1.3 慢病毒介导的miRNA-196b稳定表达K562细胞株的构建
以人外周血淋巴细胞cDNA文库为模板,通过采用PCR扩增长度为284 bp 的pre-miR-196b扩增片段,PCR产物切胶回收后再进行MluⅠ和ClaⅠ双酶切,与载体pLVTHM连接,连接产物转化大肠杆菌DH5α感受态细胞,在Amp抗性筛选平板上挑取单菌落,并培养鉴定。构建成功的重组载体命名为pLVTHM-miR-196b。重组质粒转染293T细胞制备慢病毒,病毒滴度测定后,将K562细胞接种到6孔板中,24 h后感染病毒,72 h用流式细胞仪分选GFP阳性的细胞,扩大培养,构建K562-196b稳定细胞株,同时设立空载体(pLVTHM)感染的K562细胞株为对照组,命名为K562-pLV细胞株。具体方法参照文献[5]。
1.6 实时荧光定量PCR(RT-qPCR)
细胞总RNA的提取过程参见文献[6],逆转录参照invitrogen的M-MLV逆转录试剂盒操作进行逆转录,得到cDNA,进行下一步反应。按照ABI 7500 Real-time仪器说明书,每一样本和基因同时做3个复孔,输出数据为复孔Ct值的平均值,统计时采用2-ddCt进行比较。引物见表1。反应体系为SYBR Premix Ex Taq Ⅱ(2×) 10 μL,ROX 0.4 μL,上、下游引物(10 μmol/L)各0.4 μL,模板cDNA 2 μL,ddH2O 6.8 μL。反应条件为95 ℃ 5 min;94 ℃ 15 s,60 ℃ 30 s,45个循环;72 ℃ 30 s;融解曲线。

表 1 RT-qPCR所使用的引物Tab. 1 Primers used for RT-qPCR
1.7 Western blot检测BCR-ABL蛋白
裂解细胞,提取总蛋白,根据申能博彩BCA法测定蛋白浓度试剂盒对蛋白进行定量后,进行SDS-PAGE凝胶电泳,以BCR-ABL和β-actin为一抗(1∶500稀释),二抗为相应的辣根过氧化物酶标记的IgG,电泳分离、转膜、显影及照相参见文献[6]方法操作。图片结果应用WO-9413B型凝胶成像系统自带软件Gelpro32分析目的条带平均灰度及背景灰度,前者减去后者作为统计分析数值。最后统计取值为其灰度值与相应内参灰度值比值。
1.8 CCK-8法检测细胞生长曲线
实验分K562-196b组、K562-pLV组,K562组和空白对照组4组,每组设3个复孔。每组细胞以2×107/L的密度接种于96孔板,每孔100 μL,每2~3 d换1次液。每隔24 h加入CCK-8液体10 μL,3 h后在多功能酶标仪上测定吸光度A450值,共测量7 d,绘制生长曲线。A=As-Ab,其中As为实验孔(含有细胞的培养基、CCK-8),Ab为空白孔(不含细胞的培养基、CCK-8)。
1.9 Annexin V-PE检测细胞凋亡
实验设K562组为对照组,K562-196b组、K562-pLV组为处理组。细胞处理48 h后,收集细胞,PBS重悬细胞并计数,取5×104重悬细胞,1 000×g离心5 min,弃上清液,加入195 μL Binding Buffer重悬细胞,加入5 μL Annexin V-PE,混匀后室温避光温育10 min,1 000×g离心5 min后收集细胞,弃上清液,将细胞重悬于0.5 mL 1×Binding Buffer,流式细胞仪进行检测。
1.7 统计学处理
应用SPSS 13.0版统计软件进行分析,采用ONEWAY ANOVA分析,并对各组之间数据进行两两比较(Scheffe法)。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 pLVTHM-miR-196b重组载体的鉴定
pLVTHM-miR-196b重组载体转化DH5α菌后,在Amp抗性筛选平板上挑取单菌落进行培养,提取质粒后进行双酶切鉴定和测序鉴定。结果显示,两条条带分别为11 085 bp(pLVTHM片段)和284bp(pre-miR-196b扩增片段)。B为pLVTHM-miR-196b测序结果,阴影部分与数据库获得的pre-miR-196b 84 bp片段一致(图1)。
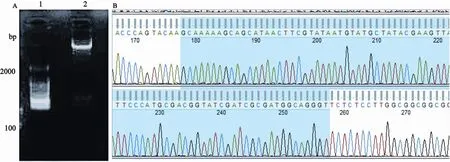
图 1 pre-miR-196b慢病毒表达载体pLVTHM-miR-196b的鉴定Fig. 1 Identification of the lentiviral expression vector pLVTHM-miR-196b
2.2 RT-qPCR验证感染病毒后miRNA-196b在K562细胞中表达增多
K562细胞转染慢病毒pLVTHM-miR-196b 48 h后收集细胞,提取总RNA,反转录得到第一链cDNA,并进行RT-qPCR反应,得到Ct值,采用2-ddCt表征各组之间miRNA-196b表达的倍数关系。其中U6为内参基因,K562组为对照组,K562-pLV为空载体组,hNC为正常人外周血有核细胞组。miRNA-196b的表达水平在K562-196b组中是K562组的10.32倍(P<0.05);hNC组是K562组的3.01倍(P<0.05);K562-196b组中miRNA-196b的表达水平高于hNC组,且差异有统计学意义(P<0.05);K562-pLV组与K562组差异无统计学意义(P>0.05)。结果证明转染成功,miRNA-196b在K562-196b细胞稳定表达(图2)。
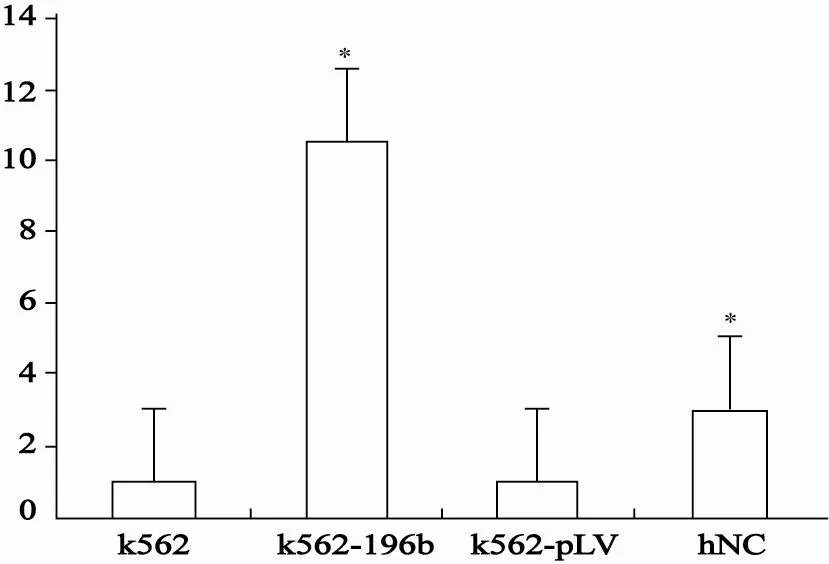
图 2 3组细胞miRNA-196b的相对定量结果Fig. 2 Relative expression of miRNA-196b in 3 groups
2.3 BCR-ABL融合基因在K562-196b组中表达降低
K562细胞转染慢病毒pLVTHM-miR-196b 48 h后收集细胞,分别提取总RNA和蛋白进行RT-qPCR和Western blot(图3)。β-Actin为内参基因,K562组为对照组,K562-pLV为空载体组。图3A为利用RT-qPCR通过计算2-ddCt得到BCR-ABL融合基因mRNA水平的相对表达量。K562组与K562-pLV组中BCR-ABL mRNA的表达基本一致;BCR-ABL mRNA在K562-196b组中表达低于对照组,约为对照组的0.5倍,差异具有统计学意义(P<0.05)。图3B为Western blot检测BCR-ABL融合蛋白的表达,K562组、K562-196b组与K562-pLV组的灰度值比值分别为0.896 42、0.639 87和0.778 28,BCR-ABL融合蛋白在K562-196b组的表达低于对照组,差异有统计学意义(P<0.05)。RT-qPCR检验结果与Western blot结果一致,证明BCR-ABL在K562-196b组中表达降低。

图 3 RT-qPCR和Western blot检测3组细胞中BCR-ABL mRNA及蛋白的表达Fig. 3 Expression of BCR-ABL mRNA and protein in three groups cells by RT-qPCR and Western blot, respectively
2.4 miRNA-196b过表达抑制K562细胞生长
每24 h向接种于96孔板的细胞悬液中加入CCK-8液体10 μL,37 ℃温育3 h后在多功能酶标仪上测定吸光度A450值,共测量7 d,绘制生长曲线(图4)。K562组与空载K562-pLV组细胞在第5、6天分别到达平台期,而K562-196b组细胞生长明显受到抑制且无平台期,证明miRNA-196b过表达对K562细胞生长有抑制作用。
2.5 miRNA-196b促进K562细胞凋亡
细胞培养48 h后收集3组细胞,按照AnnexinⅤ-PE细胞凋亡检测试剂盒说明书进行温育,经流式细胞仪检测,未经处理的K562细胞对照组、K562-pLV组与K562-196b组,细胞凋亡率分别为(4.37±0.44)%、(9.75±0.58)%、(21.42±1.08)%。K562-196b组细胞凋亡率均显著高于K562组(P<0.05),两两相比,K562-196b组细胞凋亡率显著高于K562-pLV组(P<0.05),K562-pLV组高于K562组(P<0.05)。

图 4 3组细胞的生长曲线Fig. 4 The growth curve of the 3 groups of cells
2.6 RT-qPCR检测Cox-2、survivin的表达
3组细胞提取总RNA和逆转录同前,β-actin为内参基因,Cox-2、survivin为目的基因,通过计算2-ddCt得到目的基因mRNA水平的相对表达量。与对照组相比,Cox-2基因在K562-196b组中无明显变化(P>0.05),Survivin基因在K562-196b组中表达降低,差异有统计学意义(P<0.05,图5)。
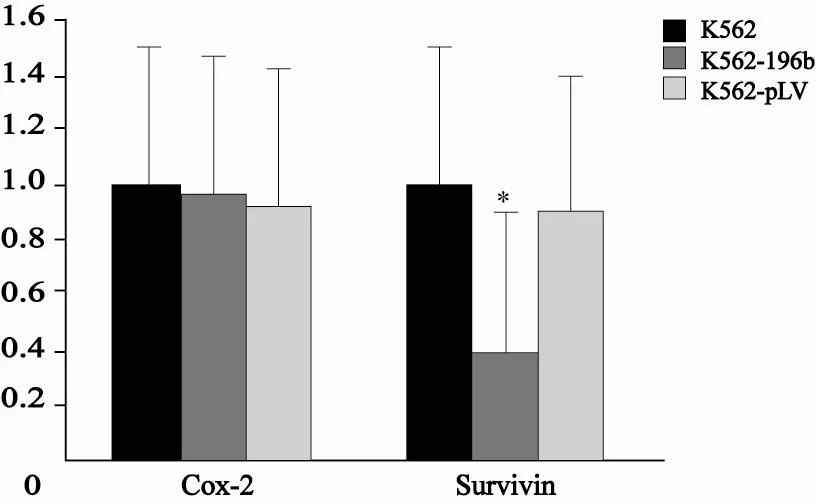
图 5 3组细胞中Cox-2、survivin的相对定量Fig. 5 The relative quantitaty of Cox-2 and survivin in 3 groups cells
3 讨 论
本研究发现,miRNA-196b过表达可以有效抑制K562细胞的生长,并诱导K562细胞的凋亡。这一结果提示miRNA-196b过表达对CML的治疗具有一定作用。但由于每个miRNA的靶基因一般不会只有1个,而每个靶基因又可能和多个miRNA相互作用,从而组成复杂的调控网络。为了更好地了解miRNA-196b对CML K562细胞的作用机制,我们选取了与肿瘤形成息息相关的survivin和Cox-2进行RT-qPCR检测。Survivin是人们最近发现的凋亡抑制蛋白家族的新成员[7],是一种独特的细胞凋亡抑制剂,在肿瘤的形成中发挥重要作用[8]。Ibrahim等[9]的研究中,AML患者与健康人相比,survivin超标达36.7%,提示survivin对白血病的生成和预后有重要意义。Carter等[10]也提出survivin是治疗白血病的潜在重要靶点,且研究证明,survivin是BCR-ABL激活的信号中的一个下游基因,以survivin为分子靶点联合应用BCR-ABL阻断剂是治疗CML的良好策略。Cox-2通过上调抗凋亡蛋白bcl- 2 抑制细胞凋亡[11],在恶性血液病的发生发展中有着重要作用。成志勇等[12]研究发现,CML患者慢性期及急变期细胞内Cox-2 mRNA表达明显高于正常对照,这一发现表明,Cox-2高表达与白血病进展及预后不良有密切关系。又有众多研究表明,在胃癌、肺癌、老年急性白血病等疾病中,survivin与Cox-2表达密切相关,发挥协同作用或survivin水平依赖于Cox-2的表达[13-15]。Guo等[16]的研究也发现Cox-2与survivin的表达密切相关,且核survivin低表达会促使肺鳞状细胞癌的抗凋亡和过度增殖,而Cox-2与细胞质survivin在肺鳞状细胞癌中的表达与低生存率、独立的预后标志以及潜在的治疗靶点相关。根据以上研究我们推测miRNA-196b过表达下调BCR-ABL融合基因,会导致survivin与 Cox-2表达下调。结合本实验RT-qPCR结果,我们发现miRNA-196b过表达可以下调survivin基因,却对Cox-2无影响,这与推测不符,进行如下分析。
Krysan等[14]证实的在非小细胞肺癌中survivin依赖Cox-2的调节,且survivin在Cox-2过表达细胞中稳定表达。Wang等[17]的研究确定了survivin是BCR-ABL信号通路的一个下游基因,且受到BCR-ABL融合基因的调控。BCR-ABL融合基因是miRNA-196b的靶基因之一,miRNA-196b过表达会下调BCR-ABL的表达,从而导致在miRNA-196b组中survivin基因含量显著低于对照组。然而,Cox-2的表达却没有如预期中协同survivin一同降低,而是与对照组基本一致,导致这一结果的原因,Li等[18]认为,miRNA-196b的其他靶基因,如HOXA9/MEIS1、FAS等基因的改变调控了Cox-2,使Cox-2的表达与K562组基本一致。
本研究通过miRNA-196b对CML K562细胞增殖和凋亡的影响,证明miRNA-196b可以抑制K562细胞的增殖并促进K562细胞的凋亡。通过比较K562-196b组与K562组中survivin和Cox-2表达水平的变化,发现miRNA-196b过表达可以下调survivin的表达,为miRNA-196b作为CML的治疗靶点提供了依据。
致谢:感谢广东省优秀人才引进项目对该研究的支持。
[1] 张济, 李君君, 颜家运, 等. 英国原位杂交在慢性粒细胞白血病BCR/ABL融合基因检测中应用及意义[J].实用医学杂志, 2012, 28(5): 825-827.
[2] GARZON R, VOLINIA S, LIU C G, et al. MicroRNA signatures associated with cytogenetics and prognosis in acute myeloid leukemia [J]. Blood, 2008, 111(6): 3183-3189.
[3] POPOVIC R, RIESVECK L E, VELU C S, et al. Regulation of miR-196b by MLL and its overexpression by MLL fusions contributes to immortalization [J]. Blood, 2009, 113(14): 3314-3322.
[4] 宋艳斌, 马文丽, 冯春琼, 等. 应用RNA干扰技术抑制K562细胞BCR-ABL基因表达及诱导细胞凋亡[J].基础医学与临床, 2005, 25(7): 620-623.
[5] LIU Y, SONG Y B, MA W L, et al. Decreased microRNA-30a levels are associated with enhanced ABL1 and BCR-ABL1 expression in chronic myeloid leukemia[J]. Leuk Res, 2013, 37 (3): 349-356.
[6] 危敏, 姜立, 王妮莎, 等. 水通道蛋白1基因过表达对K562细胞红系分化和增殖的影响[J].肿瘤, 2012, 32(7): 489-494.
[7] ALTIERI D C. Survivin and apoptosis control [J]. Adv Cancer Res, 2003, 88: 31-52.
[8] 陈志明, 王东军. 肿瘤治疗的新靶点survivin[J]. 海南医学, 2010, 21(22): 139-142.
[9] IBRAHIM A M, MANSOUR I M, WILSON M M, et al. Study of survivin and X-linked inhibitor of apoptosis protein (XIAP) genes in acute myeloid leukemia (AML) [J]. Lab Hematol, 2012, 18(1): 1-10.
[10] CARTER B Z, QIU Y, HUANG X, et al. Survivin is highly expressed in CD34 (+) 38(-) leukemic stem/progenitor cells and predicts poor clinical outcomes in AML [J]. Blood, 2012, 120(1): 173-180.
[11] 方志鸿. survivin在BCR/ABL转化白血病细胞中的表达调控、作用与治疗策略的研究[DB/OL]. http:// d.g.wanfangdata.com.cn/Thesis_Y1414251.aspx,2009-04-29/2012-12-17.
[12] 成志勇, 张昕, 王哲, 等. PTEN和COX-2在髓系白血病中的表达及作用机制探讨[J].中华检验医学杂志, 2012, 35(2): 165-169.
[13] 王滔明, 许建明, 胡乃中. Survivin、Cox-2和VEGF在胃癌中的表达及其与预后的意义[J].临床消化病杂志, 2007, 19(1): 35-39.
[14] KRYSAN K, MERCHANT F H, ZHU L, et al. Cox-2-dependent stabilization of surviving in non-small cell lung cancer[J].FASEB J, 2004, 18(1): 206-208.
[15] 王晔, 刘云鹏, 张敬东, 等. 老年性白血病Survivin、Cox-2蛋白的表达[J]. 中国老年学杂志, 2008, 28(5): 485-487.
[16] GUO Y K, LIM S J, YOUN W K. Expression of HuR, COX-2, and surviving in lung cancers;cytoplasmic HuR stabilizes cyclooxygenasa-2 in squamous cell carcinomas[J]. 2011, 5(24): 1336-1347.
[17] WANG Z, SAMPATH J, FUKUDA S, et al. Disruption of the inhibitor of apoptosis protein survivin sensitizes Bcr-ablpositive cells to STI571-induced apoptosis [J]. Cancer Res, 2005, 65(18): 8224-8232.
[18] LI Z, HUANG H, CHEN P, et al. miR-196b directly targets both HOXA9/MEIS1 oncogenes and FAS tumor suppressor in MLL-rearranged leukemia[J]. Nat Commun, 2012, 3: 688.
Effects of miRNA-196b overexpression on proliferation, apoptosis and survivin, Cox-2 expression of K562 cells
YIN Hong, LIU Yue, ZHENG Wen-ling, SONG Yan-bin, MA Wen-li (Institute of Genetic Engineering, Southern Medical University, Guangzhou Guangdong 510515, China)
MA Wen-li E-mail: 339093503@qq.com
Background and purpose: BCR-ABL fusion gene is considered to be the molecular pathological basis and an effective indicator for diagnosis, observation, prognosis, and monitoring of chronic myelogenous leukemia (CML). MiRNA-196b had low expression in acute myeloid leukemia and played an important role in the development of disease. BCR-ABL is the target gene of miRNA-196b in CML, miRNA-196b overexpression leaded to BCR-ABL down-regulation or silencing. Survivin is a downstream gene of BCR-ABL signal pathways. Various studies had showed that survivin and Cox-2 cooperative regulated of cell proliferation and apoptosis in variety of tumors. The purpose of this study was to investigate the effects of miRNA-196b overexpression on proliferation, apoptosis and surviving, Cox-2 mRNA expression of K562 cells. Methods: Three groups including K562-196b, K562-pLV and K562 control groups were set up in this study. The cell proliferation and apoptosis were measured by CCK-8 assay and Annexin V-PE, respectively. The expression of Cox-2 and survivin genes at the mRNA level were detected by Q-PCR. Results: The proliferation of K562 cells could be significantly inhibited by miRNA-196b overexpression; Compared of the three groups of apoptosis rate, K562-196b group was significantly higher than K562 group (P<0.05). The expression of survivin gene in miRNA-196b was donwregulated (P<0.05), but the expression of Cox-2 gene in miRNA-196b group had no significant difference (P>0.05). Conclusion: The miRNA-196b plays an important role in K562 cells proliferation inhibition and apoptosis; Overexpression of miRNA-196b can down-regulate survivin gene expression, and provide some basis for miRNA-196b as a therapeutic target for chronic myelogenous leukemia.
MiRNA-196b; K562 cells; Cell proliferation; Cell apoptosis
10.3969/j.issn.1007-3969.2013.05.004
R73-35
:A
:1007-3639(2013)05-0341-06
2012-12-18
2013-04-19)
广东省科技计划项目(No: 2012B031800135);广东省自然基金项目(No: S2011020003140)。
马文丽 E-mail:339093503@qq.com
