ERCC1蛋白检测指导晚期非小细胞肺癌个体化治疗的临床研究
2013-06-09高志强韩宝惠沈策金先桥董竞成万欢英唐洁沈洁顾爱琴姜丽岩
高志强韩宝惠沈策金先桥董竞成万欢英唐洁沈洁顾爱琴姜丽岩
1.上海交通大学附属胸科医院肺内科,上海 200030;
2.上海交通大学附属第六人民医院呼吸科,上海200233;
3.上海交通大学附属第一人民医院呼吸科,上海200080;
4.复旦大学附属华山医院中西医结合肺科,上海200040;
5.上海交通大学医学院附属瑞金医院呼吸科,上海200025
ERCC1蛋白检测指导晚期非小细胞肺癌个体化治疗的临床研究
高志强1韩宝惠1沈策2金先桥3董竞成4万欢英5唐洁2沈洁1顾爱琴1姜丽岩1
1.上海交通大学附属胸科医院肺内科,上海 200030;
2.上海交通大学附属第六人民医院呼吸科,上海200233;
3.上海交通大学附属第一人民医院呼吸科,上海200080;
4.复旦大学附属华山医院中西医结合肺科,上海200040;
5.上海交通大学医学院附属瑞金医院呼吸科,上海200025
背景与目的:核苷酸切除修复交叉互补组1(excision repair cross complementing 1,ERCC1)参与非小细胞肺癌(non-small cell lung cancer,NSCLC)铂类化疗药物的耐药发生。本研究旨在探讨ERCC1蛋白表达水平的检测在晚期NSCLC患者个体化治疗中的作用及其意义。方法:从2006年8月—2009年7月,共入组222例晚期(ⅢB-Ⅳ期)NSCLC患者。采用免疫组化方法检测ERCC1蛋白在患者肺癌组织的表达。按2∶1的比例随机分为个体化治疗组(n=147)及标准治疗组(n=75)。标准治疗组采用含铂化疗方案健择/顺铂或诺维本/顺铂。个体化治疗组中ERCC1蛋白高表达的患者采用非铂化疗方案健择/诺维本,ERCC1蛋白低表达的患者采用健择/顺铂或诺维本/顺铂化疗方案。主要观察指标包括有效率、总生存期及疾病进展时间。两组间比较采用χ2检验。1年生存率和生存期的比较采用Life table和Kaplan-meier方法分析。结果:随访数据截至2012年9月30日。标准治疗组的有效率为26.6%,个体化治疗组为27.2%,两组差异无统计学意义(P=0.931)。标准治疗组的1年生存率为40.0%,个体化治疗组为48.3%,两组差异无统计学意义(χ2=1.379,P=0.24)。标准治疗组的中位生存时间为10.2个月(95%CI:8.67~11.73个月),个体化治疗组为13.3月(95%CI:12.46~14.14个月),两组差异有统计学意义(P=0.041)。标准治疗组的疾病进展时间为4.8个月(95%CI:4.12~5.48个月),个体化治疗组的疾病进展时间为4.7个月(95%CI:3.88~5.52个月),两组差异无统计学意义(P=0.395)。结论:个体化治疗组的中位生存时间较标准治疗组有所延长,但ERCC1蛋白的检测指导晚期NSCLC的个体化治疗并未体现出有效率、生存期及疾病进展时间方面的优势,分子指标的检测能否指导临床合理选择化疗方案有待于更深入的临床研究加以解决。
癌,非小细胞肺;蛋白表达;个体化治疗;核苷酸切除修复交叉互补组
肺癌是全球发病率和病死率最高的肿瘤,其中80%~85% 为非小细胞肺癌(non-small cell lung cancer,NSCLC)。因缺乏有效的早期诊断手段,初诊时约75% 的患者已失去了手术时机,晚期 NSCLC 目前仍以联合化疗为主,但5年生存率不到15%[1]。大量的研究发现,影响NSCLC患者化疗效果及生存的主要原因是肿瘤细胞对抗癌药的耐药性。近年来的研究表明,肿瘤细胞DNA修复的异常及其相关基因的表达异常与肺癌耐药的产生存在密切关系[2],提示前瞻性地进行分子标志物检测有助于制订个体化治疗方案,可提高化疗疗效。
核苷酸切除修复交叉互补组1 (excision repair cross-complementing 1,ERCC1)参与NSCLC对铂类化疗药物的耐药发生,ERCC1的表达与NSCLC的化疗疗效及预后密切相关[3]。本研究探讨了ERCC1蛋白表达水平的检测在晚期NSCLC个体化治疗中的作用及其意义。
1 材料和方法
1.1 研究对象
以2006年8月—2009年7月上海交通大学附属胸科医院、上海交通大学附属第六人民医院、上海交通大学附属第一人民医院、复旦大学附属华山医院及上海交通大学医学院附属瑞金医院收治的既往未接受过化疗、无法手术切除的晚期(ⅢB-Ⅳ期)NSCLC患者为研究对象,患者均经气管镜活检或CT定位下穿刺活检证实病理组织学诊断,收集其病理标本及临床资料。共入选222例,男性135例,女性87例;年龄35~75岁,中位年龄60岁;鳞癌54例,腺癌137例,腺鳞癌10例,大细胞癌9例,未定型12例。全部患者均具有可测量的肿瘤病灶,参照国际抗癌联盟(UICC) 1997年TNM分期,ⅢB期83例,Ⅳ期139例。末次随访时间为2012年9月30日。
1.2 免疫组化
收集147例NSCLC纤支镜或肺穿刺活检标本,选择相应蜡块,连续石蜡切片厚4 μm。按EnVision法进行免疫组织化学法检测。石蜡切片常规脱蜡水化,pH为6.0枸橼酸加热抗原修复;3%H2O2阻断过氧化物酶;加入一抗(ERCC1鼠抗,按1∶80用TBS稀释,购自Abcom公司) 50 μL/片,4 ℃过夜;加入二抗50 μL/片,室温60 min;DAB显色5~10 min。各步骤间均用TBS缓冲液冲洗5 min×3次,苏木素衬染,烤干、封片。
免疫组化结果由2位资深病理学专家参照Wachters等[4]的标准独立判定,于400倍光镜下观察切片,ERCC1阳性染色定位于细胞核,镜下组织细胞结构清晰,细胞核有棕黄色颗粒沉着,且染色明显高于背景为阳性表达细胞。肿瘤细胞核不染色或染色阳性细胞数<10.0%判定为阴性(-),染色阳性细胞数≥10.0%判定为阳性(+)。以已知阳性切片作为阳性对照,以TBS缓冲液代替一抗作为阴性对照。
1.3 个体化治疗方案
按2∶1的比例随机分为个体化治疗组(147例)及标准治疗组(75例)。标准治疗组采用含铂化疗方案GP或NP。NP:诺维本25 mg/m2(第1、8天)+顺铂75 mg/m2(第1天),每28天为1个周期,GP:健择1 250 mg/m2(第1、8天)+顺铂75 mg/m2(第1天),每28天为1个周期。个体化治疗组中ERCC1蛋白高表达的患者采用非铂化疗方案GN:诺维本25 mg/m2(第1、8天)+健择1 250 mg/m2(第1、8天),每28天为1个周期;ERCC1蛋白低表达的患者采用含铂化疗方案GP或NP,NP:诺维本25 mg/m2(第1、8天)+顺铂75 mg/m2(第1天),每28天为1个周期,GP:健择1 250 mg/m2(第1、8天)+顺铂75 mg/m2(第1天),每28天为1个周期。
1.4 疗效评价
主要观察指标包括有效率(response rate,RR),总生存期(overall surival,OS)及疾病进展时间(time to progression,TTP)。按世界卫生组织(WHO)与国际抗癌联盟(UICC)标准判定为完全缓解(CR),部分缓解(PR),轻度缓解(MR),疾病稳定(SD)与疾病进展(PD)。近期客观有效为CR+PR+MR,受益为CR+PR+MR+SD,有效者应1个月后再检查确认。TTP为自治疗开始至肿瘤病灶出现进展的时间。OS为治疗开始至死亡或失访的时间。行为状态采用东部肿瘤协作组的ECOG-PS评分。
1.5 统计学处理
2 结 果
2.1 ERCC1蛋白在个体化治疗组NSCLC组织中的表达及各组患者的临床特征
免疫组织化学法检测了147例晚期初治NSCLC患者(个体化治疗组)的病理标本中ERCC1蛋白表达,75例为ERCC1蛋白高表达,72例为ERCC1蛋白低表达(图1)。标准治疗组及个体化治疗组患者的性别、年龄、体力评分、TNM分期、病理学分型及分化程度等详细临床特征(表1)。
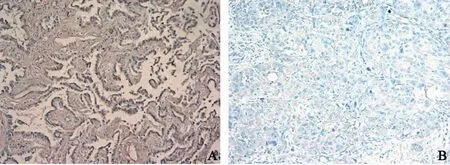
图 1 免疫组织化学染色检测ERCC1蛋白表达Fig. 1 Expression of ERCC1 in NSCLC tissues
2.2 两组的疗效比较
标准治疗组的有效率为26.6%,个体化治疗组为27.2%,差异无统计学意义(P=0.931)。标准治疗组的1年生存率为40.0%,个体化治疗组为48.3%,两组差异无统计学意义(χ2=1.379,P=0.24)。标准治疗组的中位生存时间为10.2个月(95%CI:8.67~11.73个月),个体化治疗组为13.3个月(95%CI:12.46~14.14个月),两组差异有统计学意义(P=0.041)。标准治疗组的疾病进展时间为4.8个月(95%CI:4.12~5.48个月),个体化治疗组为4.7个月(95%CI:3.88~5.52个月),差异无统计学意义(P=0.395,表2,图2)。

表 1 各治疗组患者的基线特征Tab. 1 Baseline patient characteristics according to treatment arm (n=222)
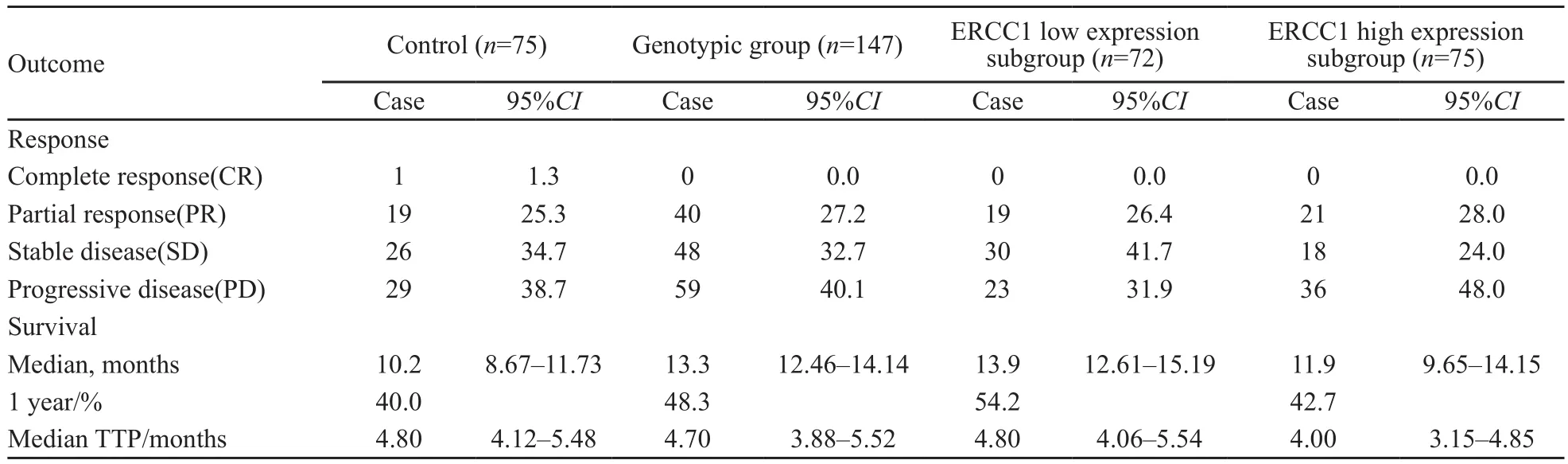
表 2 各治疗组患者的治疗效果Tab. 2 Outcome according to treatment arm

图 2 NSCLC患者的疾病进展时间及生存曲线Fig. 2 Time to progression and survival curves of NSCLC patients
3 讨 论
近年研究表明,细胞信号转导中相关因子的表达异常、肿瘤细胞DNA 修复的异常及其他相关基因的表达异常与肺癌耐药的产生存在密切联系[5],提示前瞻性地进行分子指标的测定是进行个体化治疗、提高化疗疗效的关键。ERCC1定位于19号染色体上,是核苷酸剪切修复家族中的一个重要成员,编码297个氨基酸的蛋白,与XPF形成异源二聚体,在DNA单链受损处的5’端进行剪切而发挥功能,ERCC1过表达可使停滞在G2/M 期细胞的损伤DNA得到迅速修复,导致其对顺铂耐药。
Ceppi等[6]检测了70例 NSCLC患者组织中ERCC1 mRNA的表达水平,结果发现低表达ERCC1 mRNA的患者其中位生存时间较长(17.3个月 vs 10.9个月,P =0.003 2),且在接受顺铂治疗的患者中,ERCC1的低表达水平是较长的生存期的重要预测指标( 23.0个月 vs 12.4个月,P =0.000 1)。Simon等[7]进行了一项前瞻性Ⅱ期研究,根据ERCC1和RRM1基因表达水平对晚期NSCLC进行选择性用药,其中ERCC1低表达者采用铂类化疗,ERCC1高表达者采用非铂方案化疗;完成治疗的60例患者有效率为44%,中位生存期为13.3个月,1年生存率为59%,明显优于标准含铂两联方案的效果。本研究结果显示,根据ERCC1蛋白表达情况选择化疗方案的个体化治疗组有效率(27.2%)略高于标准治疗组(26.6%),差异无统计学意义(χ2=0.681,P=0.931)。
Cobo等[8]根据ERCC1 mRNA表达进行了一项选择性应用铂类药物的多中心、随机Ⅲ期对照试验,在444例入组的Ⅳ期NSCLC患者中,按2∶1的比例随机进入试验组和对照组。对照组采用顺铂/多西他赛的方案,而试验组依据ERCC1 mRNA表达进行选择性用药,ERCC1低表达者仍用顺铂/多西他赛,而ERCC1高表达者选用多西他赛/吉西他滨的非铂化疗方案,主要终点指标为客观有效率。结果在可评价的患者中,试验组的有效率为50.7%,明显优于对照组39.3% (P=0.02),试验组中ERCC1低表达者有效率为53.2%,高表达者有效率为47.2%,均达到了主要研究终点。在作为次要终点指标的无进展生存期方面,试验组(6.1个月)也较对照组(5.2个月)延长。提示依据ERCC1 mRNA表达水平对铂类进行选择性用药优于非选择铂二联的传统治疗模式。但Cobo的研究中存在一些值得探讨的问题,比如研究设计方面,缺乏对照组中ERCC1 mRNA的表达与顺铂/多西紫杉醇方案的疗效之间关系的回顾性分析,因此无法判断对于ERCC1 mRNA高表达的人群,应用吉西他滨/多西他赛方案替代顺铂/多西他赛方案是否合理。
本研究采用免疫组化方法检测ERCC1蛋白在患者肺癌组织的表达。按2:1的比例随机分为个体化治疗组及标准治疗组,标准治疗组采用含铂化疗方案健择/顺铂或诺维本/顺铂,个体化治疗组中ERCC1蛋白高表达的患者采用非铂化疗方案诺维本/健择,ERCC1蛋白低表达的患者采用含铂化疗方案健择/顺铂或诺维本/顺铂。结果发现,个体化治疗组1年生存率(48.3%)较标准治疗组(40.0%)有所提高,但两组差异无统计学意义(χ2=1.379,P=0.24), 个体化治疗组的中位生存时间较标准治疗组有所延长(13.3个月vs 10.2个月),两组差异有统计学意义(P=0.041)。分析其原因,可能是由于本研究并未对患者的二线治疗进行控制, NSCLC患者病情进展后接受的二线治疗以及后续治疗(如靶向药物治疗等)的差异会对患者的生存期有较大影响。
虽然多项研究提示ERCC1蛋白表达水平能够预测铂类方案的疗效,但方法学简化带来的优势能否转化为临床实践的可行性有待前瞻性研究的证实。此外,各研究ERCC1表达的检测方法及ERCC1表达水平的高低划分标准不一致,限制了应用ERCC1等标志物进行选择性用药的临床实践,因此如何设置分子标志物高低表达划分点是应用标志物表达水平指导前瞻性个体化治疗的重要关键。
[1] RINALDI M, CAUCHI C, GRIDELLI C. First line chemotherapy in advanced or metastatic NSCLC [J]. Ann Oncol, 2006, 17(5): 64-67.
[2] ROSELL R, CECERE F, SANTARPIA M, et al. Predicting the outcome of chemotherapy for lung cancer [J]. Curt Opin Pharmacol, 2006, 6(4): 323-331.
[3] ROSELL R, SCAGLIOTTI G, DANENBERG K D, et al. Transcripts in pretreatment biopsies from a three-arm randomized trial in metastatic non-small cell lung cancer[J]. Oncogene, 2003, 22(23): 3548-3553.
[4] WACHTERS F M, WONG L S, TIMENS W, et al. ERCC1,hRad51,and BRCA1 protein expression in relation to tumour response and survival of stage Ⅲ/Ⅳ NSCLC patients treated with chemotherapy [J]. Lung Cancer, 2005, 50(2): 211-219.
[5] SEVE P, DUMONTET C. Chemoresistance in non-small cell lung cancer [J]. Curr Med Chem Anticancer Agents, 2005, 5(1): 73-88.
[6] CEPPI P, VOLANTE M, NOVELLO S, et al. ERCC1 and RRM1 gene expressions but not EGFR are predictive of shorter survival in advanced non-small cell lung cancer treated with cisplatin and gemcitabine [J]. Ann Oncol, 2006, 17(12): 1818-1825.
[7] SIMON G, SHARMA A, LI X, et al. Feasibility and efficacy of molecular analysis-directed individualized therapy in advanced non-small-cell lung cancer [J]. J Clin Oncol, 2007, 25(19): 2741-2746.
[8] COBO M, ISLA D, MASSUTI B, et al. Customizing cisplatin based on quantitative excision repair cross-complementing 1 mRNA expression: A phase Ⅲ trial in non-small-cell lung cancer [J]. J Clin Oncol, 2007, 25(19): 2747-2754.
Clinical research of individualized therapy in advanced non-small cell lung cancer guiding by detection of ERCC1 protein
GAO Zhi-qiang, HAN Bao-hui, SHEN Ce, JIN Xian-qiao, DONG Jingcheng, WAN Huan-ying, TANG Jie, SHEN Jie, GU Ai-qin, JIANG Li-yan (1.Department of Pulmonary Medicine, Chest Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 200030, China; 2. Department of Pulmonary Medicine, No.6 People's Hospital Affiliated to Shanghai Jiao Tong University; Shanghai 200233, China; 3. Department of Pulmonary Medicine, No.1 People's Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 200080, China; 4. Department of Integrated Traditional Chinese and Western Pulmonary Medicine, Huashan Hospital Affiliated to Fudan University, Shanghai 200040, China; 5.Department of Pulmonary Medicine, Ruijin Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China)
Background and purpose: Excision repair cross-complementing 1 (ERCC1) has been associated with cisplatin resistance. The study aimed to explore the role and clinical significance of detection of ERCC1 protein in individualized therapy of advanced non-small cell lung cancer (NSCLC) patients. Methods: From Aug. 2006 to Jul. 2009, 222 stage ⅢB/Ⅳ NSCLC patients were enrolled. The expressions of ERCC1 protein in advanced stage NSCLC tissues were qualitatively detected by immunohistochemical methods. Patients were randomly assigned in a 2∶1 ratio to either the individualized treatment group or the standard treatment group before ERCC1 assessment. Patients in the control arm
gemcitabine plus cisplatin or vinorelbine plus cisplatin. In the genotypic arm, patients with low ERCC1 levels received gemcitabine plus cisplatin or vinorelbine plus cisplatin, and those with high levels received gemcitabine plus vinorelbine. Main outcome measures include response rate, overall survival and time to progression. Differences between the groups were statistically analyzed by chi-square test. Survival differences were analyzed by temporal inspection and Kaplan-Meier survival curves. Results: Follow-up data was up to Sep. 30, 2012. Objective response was obtained by 20 patients (26.6%) in the standard treatment group and 40 patients (27.2%) in the individualized treatment group (P=0.931). One year survival rate was 40.0% in the standard treatment group and 48.3% in the genotypic arm (P=0.24). The median survival time was 10.2 months (95%CI was 8.67 months to 11.73 months) in the standard treatment group and 13.3 months (95%CI was 12.46 months to 14.14 months) in the individualized treatment group (P=0.041). The time to progression was 4.8 months (95%CI was 4.12 months to 5.48 months) in the standard treatment group and 4.7 months (95%CI was 3.88 months to 5.52 months) in the individualized treatment group (P=0.395). Conclusion: The median survival time has extended in the individualized treatment group. But individualized therapy in advanced NSCLC guiding by detection of ERCC1 protein has not reflected advantage in response rate, overall survival and time to progression. Additional studies are warranted to optimize detections of biomarkers in guiding rational clinical chemotherapy regimens.
Cancer, non-small cell lung; Protein expression; Individualized therapy; Excision repair crosscomplementing 1 (ERCC1)
10.3969/j.issn.1007-3969.2013.05.002
R734.2
:A
:1007-3639(2013)05-0328-06
2012-11-05
2013-03-22)
上海市科委科技发展基金项目(No:06DZ19501);上海市科委学科带头人计划项目(No:09XD1403500)。
韩宝惠 E-mail:xkyyhan@gmail.com
Correspondence to: HAN Bao-hui E-mail: xkyyhan@gmail.com
