CT引导下兔肺内VX2肿瘤的射频消融治疗
2013-06-09
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
CT引导下兔肺内VX2肿瘤的射频消融治疗
王英 李文涛 许立超 袁正
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:外科手术切除、放疗和化疗是治疗肺恶性肿瘤的主要方法,但对失去手术机会、肺内多发转移或放化疗失败的患者,积极探索新的治疗方法成为亟待解决的问题。近年来,射频消融作为肺恶性肿瘤新的治疗方法,受到广泛关注。本研究旨在观察CT引导下CelonLab射频仪治疗兔肺内VX2肿瘤的影像学表现、病理演变,评价治疗效果,进一步探索肺恶性肿瘤的射频治疗参数。方法:采用同轴套管针经皮穿刺的新方法建立兔VX2肺肿瘤模型。实验组27只予以射频治疗,对照组9只予以假性治疗。两组均于设定时间点行CT扫描,观察影像学表现。实验组18只于治疗后不同时间点随机处死,观察病理演变;其余9只待其自然死亡,评估疗效、计算生存期。对照组9只均待其自然死亡,计算生存期。结果:射频后即刻CT扫描见病灶周围磨玻璃影可伴内部空洞或小空泡。与病理HE染色切片对照发现,术后随访中CT增强扫描无强化不能完全除外肿瘤细胞残留。术后24 h大体解剖见病灶由中心向外周形成4条沿能量梯度分布的反应带:中央炭化或蒸发中心(电极穿刺针道),灰白色凝固性坏死带,棕红色出血带,粉红色充血渗出带。术后肿瘤病灶周围出现不同程度炎性反应,4周后基本吸收,最终残留厚壁纤维组织层包绕中央凝固性坏死及少量陈旧性出血。实验组待其自然死亡的9只中,完全缓解率78%。实验组与对照组生存时间分别为(38.0±5.9) d与(24.0±3.1) d,差异有统计学意义(t=2.634,P=0.018)。射频能量与病灶直径之间存在直线回归关系,回归系数的检验P=0.000,直线回归方程为Y^=-2.3372+1.4361X。结论:采用同轴套管针经皮穿刺法建立兔VX2肺肿瘤模型安全、迅速,短期内成瘤率高。射频消融治疗肺内肿瘤疗效确切,安全、微创,并发症少。术后射频区域有一个发展演变的过程,疗效评估可以术后1个月为新基线。射频能量与病灶直径之间存在直线回归关系。
VX2;肺肿瘤;CT;射频消融;病理转归
热疗是恶性肿瘤综合治疗中的重要组成部分。随着射频消融(radiofrequency ablation, RFA)设备的改进,RFA治疗原发性和转移性肺恶性肿瘤逐步得到认可,为肺恶性肿瘤的治疗提供了一种新方法[1]。本研究采用CT引导下射频消融治疗兔肺内VX2肿瘤,观察术后CT影像学表现及病理转归、评价术后疗效,进一步探索射频治疗参数,旨在从实验动物层面为人类肺恶性肿瘤的射频消融治疗提供支持与参考。
1 材料和方法
1.1 建立兔VX2肺肿瘤模型
3%戊巴比妥钠溶液(30 mg/kg)经耳缘静脉注射麻醉VX2荷瘤种兔,无菌操作摘取左大腿内侧皮下肿瘤,0.9%的NaCl溶液冲洗2次,取瘤体周边灰白色鱼肉样活性成分,剪切成1 mm³大小的组织块备用。实验兔40只术前禁食12 h,3%戊巴比妥钠溶液(30 mg/kg)耳缘静脉麻醉,仰卧位固定于手术台上。CT扫描(120 kV,100 mA,层厚3 mm)定位,避开骨性结构、较大的血管、支气管,计划最优进针路线,体表标记进针点,酒精消毒、铺巾。将同轴套管针按预定进针路线刺入右肺实质,CT扫描确定套管针位于肺实质内,拔出套管针针芯,无菌镊夹取备用组织块装入套管针鞘,插入针芯,轻轻推送针芯将组织块推入肺实质内,明胶海绵条封堵针道后拔出套管针,无菌纱布压迫穿刺点约30 s。术后3 d肌肉注射头孢唑林钠0.25 g/只,qd。术后CT扫描观察肺内肿瘤生长情况,待肿瘤直径长至10 mm左右即可用于射频消融治疗。40只实验兔建模时间平均(11±3.7) min,全部实验兔于麻醉后2~3 h苏醒,苏醒后进食、活动正常,无手术操作相关死亡。38只7~10 d内可见肺内软组织密度影,成瘤平均时间(8.0±1.3) d;肿瘤最大径8.1~15.5 mm,平均(10.9±1.9) mm;2只肺内未成瘤。肺内肿瘤为单发圆形或类圆形结节36只;单发不规则胸膜下结节伴同侧胸水1只,多发胸膜下结节1只(图1)。
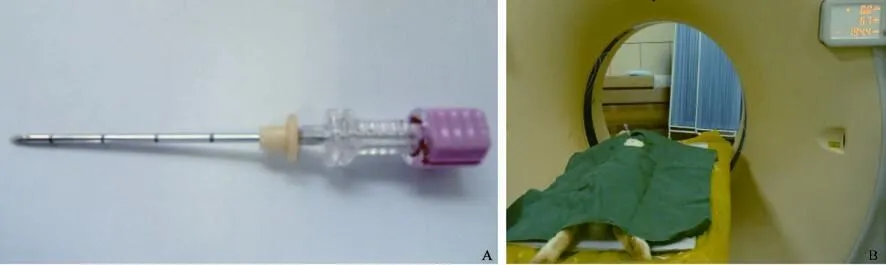
图 1 VX2 肺肿瘤模型的建立Fig. 1 Build the model of VX2 lung tumors
1.2 分组与射频治疗
为了排除混杂因素的干扰,便于射频术后的随访评估,本实验将36只肺内肿瘤为单发圆形或类圆形结节的实验兔纳入射频消融治疗的研究,实验组27只,予以射频消融治疗;对照组9只,予以假性治疗(只插入射频针,不予以消融)。射频发射器CelonLab POWER,冷循环泵CelonLabAquaflowⅢ,射频针型号T20,射频电极长度2 cm,最大输出功率20 w。术前准备与麻醉方法同前。CT扫描(120 kV,100 mA,层厚3 mm)并三维重建,明确病灶部位、与周围组织关系,避开骨性结构、较大的血管、支气管,计划最优进针路线,体表标记进针点,手术区域脱毛,酒精消毒、铺巾。将射频针按预定进针路线刺入病灶内,CT扫描确定射频针位于病灶中央,开启射频发射器及冷循环泵行射频消融治疗,射频结束后边消融针道边退针。拔针后CT扫描观察有无气胸、出血并发症,若气胸量超过10%,头皮针连接10 mL注射器抽吸胸腔内气体,再次CT扫描明确压缩肺已复张。术后3 d肌肉注射头孢唑林钠0.25 g/只qd。实验组27只,肿瘤最大径(10.5±2.7) mm,射频能量4.27~14.3 kj,平均(8.62±3.21) kj;射频时间9.5~20 min,平均(15.5±3.5) min。
1.3 射频术后随访评估
两组术后24 h,3 d,1、2、4、6周行CT扫描(平扫+增强),观察病灶及其周围组织的影像学表现;实验组术后24 h,3 d,1、2、4、6周分别随机处死3只,沿病灶周围1 cm切除,4%甲醛(浓度)固定、石蜡包埋、HE染色,制作病理切片,显微镜下分别采用4、10、100、400倍视野观察病灶及其周围组织的病理演变过程;其余9只待其自然死亡,制作病理切片(方法同上),评估疗效、计算生存期。对照组均待其自然死亡,计算生存期。
1.4 统计学处理
采用SPSS 13.0统计分析软件,统计方法采用t检验与直线回归分析,P<0.05为差异有统计学意义。
2 结 果
2.1 CT扫描
对照组假性治疗前后,肿瘤大小、密度无明显改变,沿针道可见少量出血,3~7 d内吸收;在随后的CT扫描观察中发现肿瘤生长不受影响,继续快速增长,晚期出现两肺播散、胸腔积液及远处转移。实验组射频后即刻CT扫描可见病灶周围磨玻璃影可伴内部空洞或小空泡(图2A);3~7 d周围磨玻璃影有所吸收,整个射频区密度趋于均一,高密度区较术前病灶本身范围增大,个别中央可见清晰的射频针道;第2~3周射频区开始回缩,范围较第1周缩小、密度增加,针道被充填,增强扫描可有强化;第4~6周射频区范围明显缩小,密度变化不明显,增强扫描无强化。
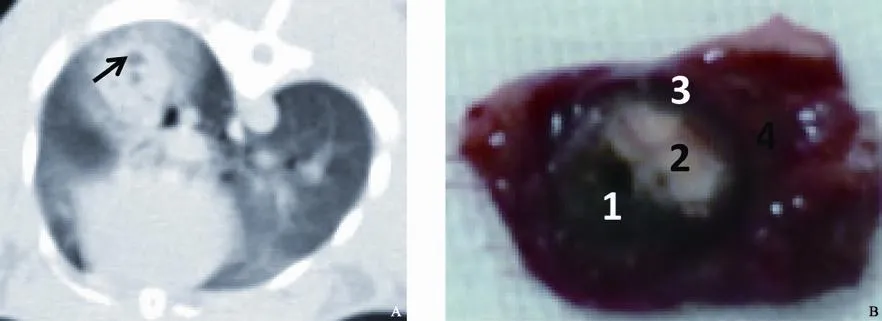
图 2 射频术后CT图像与大体解剖Fig. 2 The CT images and gross anatomy after RFA
2.2 大体解剖及病理
实验组射频术后24 h大体解剖可见中央裂隙样炭化或蒸发中心,外层灰白色凝固性坏死区,周围包绕棕红色出血带,出血带又被颜色稍淡的充血渗出带环绕,最外层为正常肺组织(图2B)。24 h~3 d,水肿带及周围见大量中性粒细胞及少量淋巴细胞浸润;1周左右水肿带有所吸收,并见大量淋巴细胞、浆细胞、嗜酸性粒细胞;2~3周出血带、水肿带逐渐吸收,胶原纤维大量产生;4~6周出血带、水肿带基本吸收,中心区域为残留的灰白色凝固性坏死可伴少量陈旧性出血,周围为厚壁纤维组织层,最外层为正常肺组织(图3)。
2.3 疗效评估
定义第6周 CT增强扫描无强化且病理切片射频灶边缘无肿瘤细胞残存为完全缓解,CT增强扫描有强化或射频灶边缘有肿瘤细胞残存为肿瘤进展。实验组待其自然死亡的9只中,完全缓解7只(78%),进展2只(22%)。实验组待其自然死亡的9只,生存时间为(38.0±5.9)d;对照组9只生存时间为(24.0±3.1)d,差异有统计学意义(t=2.634,P=0.018)。
2.4 射频能量与病灶大小的关系
射频能量与病灶直径之间存在直线回归关系,回归系数的检验P=0.000,直线回归方程为= -2.3372 + 1.4361 X。
2.5 并发症
术中5只出现气胸,头皮针经皮穿刺抽吸后复查CT,压缩肺复张;无血胸发生,肺实质出血未予处理,待其自行吸收。
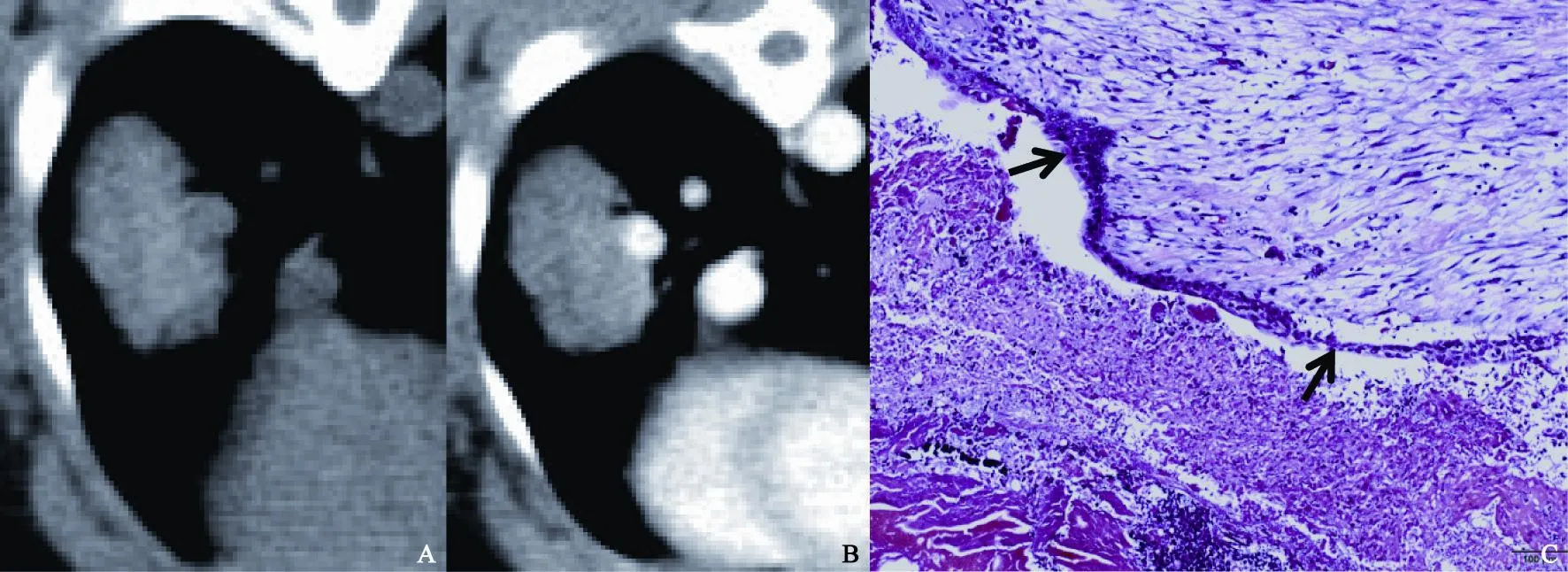
图 3 术后4周消融灶CT图像与病理HE染色(×400)Fig. 3 The CT images and tissue section with HE staining (×400) four weeks after RFA
3 讨 论
兔VX2肺癌模型的制作方法主要有细胞悬液注射法、组织块悬液注射法和组织块埋植法[2-5]。前两种方法将悬液直接注射到兔肺实质内,术中拔针时及拔针后伴随呼吸运动易致悬液沿针道溢出,造成广泛胸腔内种植。组织块埋植法采取开胸手术,该法成瘤率高,易形成单一局部肿瘤,但手术操作繁琐、对实验人员手术操作技能要求高,且容易发生气胸,而放置引流管又增加了感染的概率[4]。本研究采用CT引导下同轴套管针经皮穿刺法将VX2组织块接种于兔肺实质内来构建兔VX2肺癌模型。该方法成瘤率高(95%)、安全快捷、并发症低,可短时间内复制大批兔VX2肺癌模型进行相关研究;此外,该方法容易形成肺内单发肿瘤,较好地排除了混杂因素的干扰,便于进行射频术后影像学、病理学的观察及疗效评估。
RFA是一种发展迅速的热损毁技术,其原理为利用射频电极发出射频波使周围组织内的极性分子处于一种激发状态、产生高速震荡,将射频能转化为热能,从而将肿瘤区加热至有效治疗温度范围并维持一定时间而杀灭[6-7]。RFA较早主要用于原发性及转移性肝肿瘤的治疗[8]。2000年,Dupuy等[9]报道了3例RFA治疗肺部恶性肿瘤的研究。随后,Steinke等[10]在兔毗邻心脏的肺组织的消融中证实了其安全性。目前,RFA治疗原发性和转移性肺癌逐步得到认可,主要用于失去手术机会或不能耐受手术、多发、放化疗失败的肺恶性肿瘤患者[1,11-12]。
本实验采用CelonLab单电极射频仪,其特有的冷循环系统可以快速带走针尖的热量,从而避免了射频周围组织区域的炭化,作用持久温和;其缺点主要为手术费时、对大的病灶消融不彻底。由于兔肺容积较小,相应的肺内肿瘤的直径、体积较小,手术的操作空间较小,相比RF200、RITA、MEDSPHERE等多爪射频仪,CelonLab的优势为:①单电极射频针减少了对周围肺组织及重要脏器的损伤,射频能量可以持久缓慢地由电极向周围扩散;②对于不规则病灶,即使多次调整进针方向,出血量也较少,且主要沿穿刺针道分布,不容易干扰病灶周围情况的观察;③电极长度与肿瘤大小匹配较好,减少了过度消融或消融不彻底,有助于更好地进行影像学、病理学观察评估。
本实验采用的射频技术可在局部组织内产生90 ℃的高温[6],使组织严重脱水甚至炭化、局部压力增高产生微爆裂造成裂隙,CT扫描表现为小的空泡或空洞;肿瘤病灶本身因严重脱水而皱缩,射频能转化的热能对病灶周围组织的损伤形成出血带,出血较多时CT平扫表现为高密度环,病理可见大量红细胞聚集;射频微热加之肿瘤细胞破坏释放大量炎性介质,形成出血带外围的水肿渗出带,表现为病灶周围的磨玻璃影。继而炎性细胞聚集浸润整个射频区域融合成片并伴有纤维母细胞趋化聚集、增生并产生大量胶原纤维,此为组织修复过程[13]。最后坏死、出血及充血渗出逐渐吸收,残留中央凝固性坏死及少量陈旧性出血、周围厚壁纤维组织层。掌握射频前后影像学的发展演变对正确的疗效评估及区分术后残留、局部复发或肉芽组织形成具有重要意义。实验发现,术后1周左右,高密度射频区域大于原病灶范围但小于磨玻璃影范围。我们认为这是凝固性坏死、出血带和一部分炎性坏死共同导致的,这与Tominaga等[14]观点较为相近。射频区术后2~3周CT增强扫描仍可有强化,尤其病灶边缘的强化,术后残留、局部复发或肉芽组织形成,三者较难区分。Deandreis等[15]认为利用PET/CT,弥散、周边、均匀的FDG摄取多提示炎性反应,不均匀、局灶的浓聚多提示消融不彻底及复发。有研究认为轻度的延迟强化很可能是因为肉芽组织的血管形成[16]。本实验中,术后4周左右,肉芽组织已被纤维组织取代,此时若仍有病灶边缘的强化,高度提示术后残留或复发。术后整个射频区域是不断发展演变,疗效评估应以术后1个月为新基线。此外,实验发现术后4~6周即使CT增强无强化也并不能完全除外肿瘤细胞的残留,因为当只有单层或几层肿瘤细胞残留而没有形成新生血管时,增强扫描无强化。
本研究主要有以下不足:①由于目前尚没有专门用于动物实验的射频消融仪,本实验采用的射频电极与治疗的肿瘤相比较大,加之手术操作的空间有限,为治疗中肿瘤病灶的准确定位带来一定的困难,实验中部分病灶消融不彻底、局部复发可能与此有关,这也是很多研究者遇到的共同问题[17];②由于实验条件的限制,影像学仅采用CT观察随访。有研究者认为,增强CT在检测肺肿瘤射频术后残留方面不如肝脏肿瘤敏感,主要反应形态学的变化[18-19];Okuma等[20]发现术后3d,射频病灶在弥散加权成像(DWI)上即表现为信号强度减退和表观弥散系数(ADC)值的明显增加。因此,结合MRI、小动物PET/CT进行观察随访可能会取得更好的结果[16,20-21]。
[1] GILLAMS A. Radiofrequency ablation of lung tumors[J]. Cancer Imaging, 2012, 12(2): 361-362.
[2] 刘宇, 兰作平, 张福军, 等. 快速微创建立弥漫型兔VX2肺癌模型及其生物学行为研究[J]. 重庆医科大学学报, 2011, 36(9): 1025-1028.
[3] 石宝琪, 张强, 刘兆信, 等. 兔VX2肺癌模型的建立及MSCT观察[J]. 内蒙古医学杂志, 2010, 42(12): 1416-1418.
[4] 薛强, 屈谦, 杜永洪, 等. 兔VX2肺癌模型的建立及生物学特性观察[J]. 中华实验外科杂志, 2001, 18(5): 478-479.
[5] 胡小波, 曹建民, 许健, 等. 兔VX2肺癌模型的建立及评价[J]. 当代医学, 2009, 15(17): 348-349.
[6] 吉王明. 胰腺癌的局部消融治疗现状[J]. 中国医学工程, 2011, 19(4): 171-172.
[7] 张磊 ,钱国军. 原发性肝癌热消融治疗的方法与评价[J]. 肝胆外科杂志, 2011, 19(1): 73-75.
[8] SOLBIATI L. New applications of ultrasonography: Interventional ultrasound[J]. Eur J Radiol, 1998, 27: 200-206.
[9] DUPUY D E, ZAGORIA R J, AKERLEY W, et al. Percutaneous radiofrequency ablation of malignancies in the lung[J]. AJR, 2000, 174(1): 57-59.
[10] STEINKE K, ARNOLD C, WULF S, et al. Safety of radiofrequency ablation of myocardium and lung adjacent to the heart: an animal study[J]. J Surg Res, 2003, 114(2): 140-145.
[11] BAERE T, PALUSSIERE J, AUPERIN A, et al. Midterm local efficacy and survival after radiofrequency ablation of lung tumors with minimum follow-up of 1 year: prospective evaluation[J]. Radiology, 2006, 240(2): 587-596.
[12] LENCIONI R, CROCETTI L, CIONI R, et al. Response to radiofrequency ablation of pulmonary tumours: a prospective, intention-to-treat, multicentre clinical trial (the RAPTURE study) [J]. Lancet Oncol, 2008, 9(7): 621-628.
[13] BAERE T. Lung tumor radiofrequency ablation: Where do we stand? [J]. Cardiovasc Intervent Radiol, 2011, 34: 241-251.
[14] TOMINAGA J, MIYACHI H, TAKASE K, et al. Time-related changes in computed tomographic appearance and pathologic findings after radiofrequency ablation of the rabbit lung: preliminary experimental study[J]. J Vasc Interv Radiol, 2005, 16: 1719-1726.
[15] DEANDREIS D, LEBOULLEUX S, DROMAIN C, et al. Role of FDG PET/CT and chest CT in the follow-up of lung lesions treated with radiofrequency ablation[J]. Radiology, 2011, 258(1): 270-276.
[16] DUPUY D E. Image-guided thermal ablation of lung malignancies[J]. Radiology, 2011, 260(3): 633-655.
[17] 马连君, 程庆书, 刘锟, 等. 经皮穿刺射频消融治疗兔肺内VX2肿瘤[J]. 中国肺癌杂志, 2002, 5(2): 115-118.
[18] JIN G Y, LEE J M, LEE Y C, et al. Primary and secondary lung malignancies treated with percutaneous radiofrequency ablation: evaluation with follow-up helical CT[J]. AJR Am J Roentgenol, 2004, 183: 1013-1020.
[19] PALUSSIERE J, MARCET B, DESCAT E, et al. Lung tumors treated with percutaneous radiofrequency ablation: Computed tomography imaging follow-up[J]. Cardiovasc Intervent Radiol, 2011, 34: 989-997.
[20] OKUMA T, MATSUOKA T, AYAMAMOTO A, et al. Assessment of early treatment response after CT-guided radiofrequency ablation of unresectable lung tumours by diffusion-weighted MRI: a pilot study[J]. Brit J Radiol, 2009, 82(984): 989-994.
[21] HARADA S, SATO S, SUZUKI E, et al. The usefulness of pre-radiofrequency ablation SUVmax in 18F-FDG PET/CT to predict the risk of a local recurrence of malignant lung tumors after lung radiofrequency ablation[J]. Acta Med Okayma, 2011, 65(6): 395-402.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
CT-guided radiofrequency ablation of VX2 lung tumors in rabbits
WANG Ying, LI Wen-tao, XU Lichao, YUAN Zheng (Department of Radiology, Fudan University Shanghai Cancer Center, and Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032,China)
LI Wen-tao E-mail: liwentao98@126.com
Background and purpose: Surgical resection, radiotherapy and chemotherapy are main remedies for malignant lung tumors. However, to explore new therapies for patients ineligible for surgery, multiple metastases in lung and progressive with radiotherapy or chemotherapy is an urgent problem. Recently, radiofrequency ablation has attracted a wide spread attention as a new treatment for malignant lung tumors. In this study, we investigated CT-guided radiofrequency ablation of VX2 lung tumor in rabbits, with the aim to observe CT images and pathologic regression, to evaluate efficacy and to explore treatment parameters of RFA. Methods: Build the model of VX2 lung tumors in rabbits with a new method of CT-guided percutaneous puncture by coaxial trocar. The experimental group included 27 rabbits with RFA treatment, while the control group had 9 rabbits with false treatment. Two groups were performed CT scans at different time points to observe CT images. For the experimental group, 18 were killed at different time points to observe pathologic regression; while the rest was kept natural death, evaluating efficacy and calculated survival time. The control group had natural death and the survival time was calculated. Results: CT images taken immediately after RFA showed the lung tumor surrounded by ground-glass opacity (GGO), sometimes, with a cavity or smallvacuoles in the lesion. It couldn’t exclude the residual of tumor cells even without enhancement of CT scan according to pathological finding in the follow-up. Twenty-four hours after operation, in gross anatomy, the area of RFA showed four zones from inside to outside along power gradient: the carbonization or evaporation center, gray coagulation necrosis zone, red-brown hemorrhage zone and pink hyperemic exudate zone. There was some degree of inflammation pathologically around the lesion after operation, which was absorbed within four weeks mainly; eventually, left thickwalled fibrous tissue encysting coagulation necrosis and slightly remote hemorrhage. The rate of complete response of the experimental group was 78%. The survival time of the experimental group and the control group had significant difference (t=2.634, P=0.018), which was 38.0±5.9 d and 24.0±3.1 d, respectively. The linear regression equation between RF energy and the lesion size was Y^=-2.3372+1.4361X, with test of regression coefficient (P=0.000). Conclusion: The method of CT-guided percutaneous puncture by coaxial trocar to build the model of VX2 lung tumors in rabbits was safe and rapid, with high tumor formation rate. Our study showed not only safety, micro-invasion and low rate of complications but also definite efficacy of RFA for lung tumors. To evaluate efficacy, 1 month after operation could be the new baseline due to the development and succession of the RFA area. There was relationship of linear regression between RF energy and the lesion size.
VX2; Lung tumor; Computer tomography (CT); Radiofrequency ablation (RFA); Pathologic regression
10.3969/j.issn.1007-3969.2013.05.005
R734.2
:A
:1007-3639(2013)05-0347-06
2012-12-18
2013-03-15)
上海市科委基金项目(No:11nm0504000)。
李文涛 E-mail:liwentao98@126.com
