一种吡虫啉的酶联免疫快速检测试剂盒的研制
2013-06-05马寅生冯才伟贾芳芳
马寅生 冯才伟 贾芳芳 冯 静 杨 烁
(北京勤邦生物技术有限公司 北京 昌平 102206)
一种吡虫啉的酶联免疫快速检测试剂盒的研制
马寅生 冯才伟 贾芳芳 冯 静 杨 烁
(北京勤邦生物技术有限公司 北京 昌平 102206)
本文利用酶联免疫技术研制了一种快速检测吡虫啉残留的试剂盒,经过测试,该试剂盒对蔬菜、水果样本的检测限为20μg/kg,批内、批间相对标准偏差均小于10%。本研究的吡虫啉ELISA检测试剂盒能够应用于大量样品的现场检测,使用简便,结果准确、可靠。
吡虫啉 酶联免疫试剂盒 蔬菜 水果 快速检测
吡虫啉(IMI)是烟碱类杀虫剂,具有广谱、高效,害虫不易产生抗性,对人、畜、植物和天敌安全等特点,主要用于防治刺吸式口器害虫及其抗性品系[1,2]。目前,含IMI的农药产品已在120多个国家的140余种农作物上登记使用,应用范围涉及粮食、经济、果树、茶叶和蔬菜等[3]。然而,IMI的大量使用对环境造成了严重影响,同时畜禽因长期食用含IMI残留的植物,使其在体内富集,最后经食物链进入人体,危害人体健康。
从文献报道看,有关吡虫啉残留的检测方法主要集中于高效液相色谱法(HPLC)、气相色谱法(GC)、电化学分析法(EA)和免疫分析法(ELISA)4个方面。通过比较仪器法和快检方法在我国实际检测中所起到的作用,本研究着重建立一种检测蔬菜、水果样本中吡虫啉的酶联免疫吸附法,该方法的准确性高于一般的快速检测方法,检测程序及所需条件较仪器法更方便,尤其便于现场大量样本的检测,更适于中小企业对成本控制的需求。
1 材料与方法
1.1 材料与仪器
吡虫啉标准品购自北京标准物质研究中心,二甲基甲酰胺、牛血清白蛋白、碳酸盐、戊二醛、卵清蛋白、硼氢化钠等均购自北京百欣试剂公司,蔬菜、水果购自超市,酶标仪购自上海雷勃分析仪器有限公司,涡旋仪、均质器购自湖南湘立科学仪器有限公司。
1.2 方法
1.2.1 吡虫啉半抗原的制备 100ml二口瓶中加入吡虫啉0.25g,二甲基甲酰胺(DMF)1ml,水合氯化锡0.75g和乙醇10ml,氮气排空,控温65℃反应40min,反应液显褐色,薄层色谱(TLC)检测反应完全。处理:降温至室温,加乙酸乙酯50ml,加饱和碳酸氢钠水溶液调节至弱碱性,大量盐析出,乙酸乙酯40ml×2次萃取浑浊液,合并有机相,盐水洗涤,无水硫酸钠干燥,蒸干溶剂,得固体产物0.22g。
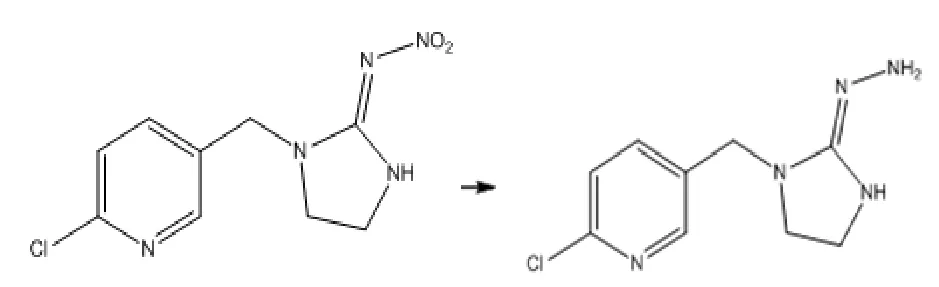
图1 吡虫啉半抗原合成路线图
1.2.2 抗原的制备 (1)免疫原制备—吡虫啉半抗原与牛血清白蛋白(BSA)偶联得到免疫原。取7mg半抗原,溶解于1ml DMF中;取0.1ml戊二醛水溶液加入半抗原溶液中,室温下搅拌24h,即可得到反应液A;称取牛血清白蛋白(BSA)30mg,使之充分溶解在2.7ml 0.1mol/L碳酸盐缓冲液(CB)(pH 9.6)中,将反应液A逐滴缓慢滴加到蛋白溶液中,并于室温下搅拌24h,用0.2ml 5mol/L的硼氢化钠水溶液还原反应4g,用0.01mol/L磷酸缓冲液(PBS) 4℃透析3d,每天换3次透析液,以除去未反应的小分子物质。(2)包被原制备—吡虫啉半抗原与卵清蛋白(OVA)偶联得到免疫原。取7mg半抗原溶解于1ml DMF中;取0.1ml戊二醛水溶液加入半抗原溶液中,室温下搅拌24h,即可得到反应液A;称取OVA 30mg,使之充分溶解在2.7ml 0.1mol/L CB(pH9.6)中,将反应液A逐滴缓慢滴加到蛋白溶液中,并于室温下搅拌24h,用0.2ml 5mol/L的硼氢化钠水溶液还原反应4h,用0.01mol/L PBS 4℃透析3d,每天换3次透析液,以除去未反应的小分子物质。
1.2.3 酶标板的制备 吡虫啉单克隆抗体及羊抗鼠抗抗体制备完成后,进行酶标板的制备。用包被缓冲液将包被原稀释成20μg/ml,每孔加入100μl,37℃避光孵育2h,倾去孔中液体,用洗涤液洗涤2次,每次30s,拍干,然后在每孔中加入200μl封闭液,37℃避光孵育2h,倾去孔内液体拍干,干燥后用铝膜真空密封保存。
1.2.4 试剂盒灵敏度和检测限试验 以标准曲线0浓度标准溶液吸光度值50%处所对应的药物浓度(IC50)来评价试剂盒的灵敏度。分别对20份蔬菜、水果空白样品进行检测,从标准曲线上查出对应于各百分吸光度值的浓度,以20份样本浓度的平均值加上3倍标准差表示检测限。
1.2.5 样本精密度和准确度试验 以回收率作为准确度评价指标,重复测定某一浓度样品的检测结果相对标准偏差(RSD%)作为精密度评价指标。计算公式为:回收率(%)=实际测定值/理论值×100%,其中理论值为样品的添加浓度;相对标准偏差RSD%=SD/X×100%,其中SD为标准偏差,X为测定数据的平均值。按100µg/kg、300µg/kg、500µg/kg三个浓度吡虫啉分别对蔬菜和水果样品进行添加回收测定,每个样品做4个平行,用三批不同试剂进行测定,计算样品的平均回收率及精密度。
2 结果与分析
2.1 半抗原合成鉴定结果
用核磁共振氢谱测定制备好的吡虫啉半抗原,如图2所示,4.7ppm左右的峰为咪唑啉环上的两个亚甲基信号峰,5.0ppm左右的峰为苄基信号峰,7.2-8.7ppm为氨基与芳环混合信号峰,说明目标半抗原合成成功。
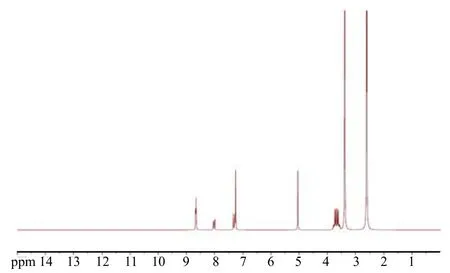
图2 吡虫啉半抗原核磁共振氢谱图
2.2 试剂盒灵敏度和检测限
按照常规方法测定试剂盒灵敏度,试剂盒标准曲线最低点为4μg/kg,标准曲线的范围为4~324μg/kg,IC50(50%抑制浓度)为12.9μg/kg;对20份样品进行检测,从标准曲线上查出对应于各百分吸光度值的浓度,以20份样本浓度的平均值加上3倍标准差表示检测限,结果得该方法对样本的检测限为20μg/kg。见图3。
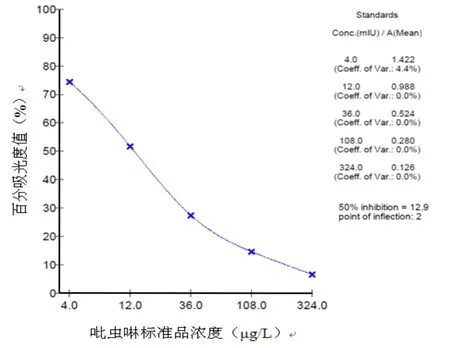
图3 吡虫啉标准曲线图
2.3 样本精密度和准确度试验
以100、300、500µg/kg三个浓度的吡虫啉分别对蔬菜和水果样品进行添加,平均回收率在83.5%~117.9%之间;批内、批间的相对标准偏差均小于10%。见表1、2。
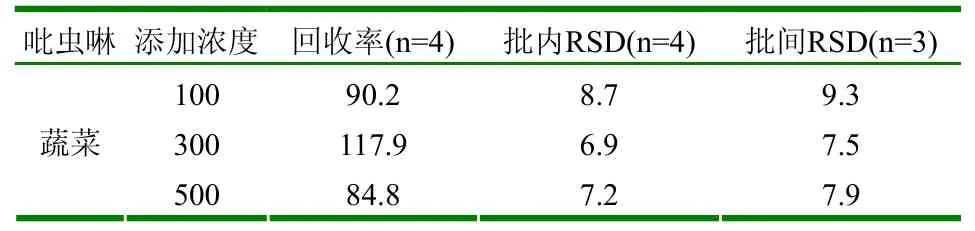
表1 蔬菜精密度及准确度试验 (μg/kg、%)
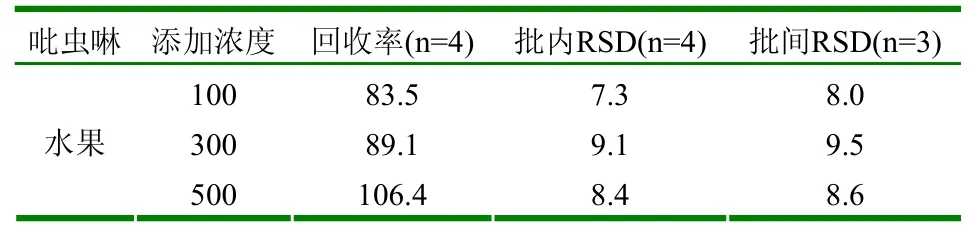
表2 水果精密度及准确度试验 (μg/kg、%)
3 讨论
目前,高效液相色谱法(HPLC)、气相色谱法(GC)、电化学分析法(EA)和免疫分析法(ELISA)是检测吡虫啉残留的主要方法。Placke and Weber曾经报道了运用HPLCUVD研究了IMI在植物中的残留量[4]。IshiiY等也采用HPLC-UVD检测技术研究了IMI在部分作物和土壤中的残留动态[5]。Fermandz Alba A R等用HPLC-DAD测定蔬菜中IMI残留量[6]。Erenchun N R等还采用HPLC-PRAD测定了土壤中的残留IMI及其主要降解物含量[7]。Fernadez Alba A R等应用HPLC-MS技术检测蔬菜中IMI残留量,得到了小于1.0 mg/kg的检出限[8]。有关IMI残留GC测定方法主要集中在GC-MS联用技术上,如NavalonA.等运用GC-MS测定蔬菜中IMI的残留量,得到了1.25~25mg/kg的线性检测范围和2.5mg/kg的检测限[9]。IMI残留的电化学分析方法报道较少,且其线性检测范围,检测限均不及色谱法。在IMI残留的免疫检测方法方面,Jae Koo Lee等报道了通过制备IMI-pAb,采用间接竞争ELISA检测苹果和水中的IMI残留,其检测限为5.0µg/L[10]。Zhixiong Li等报道了基于抗IMI多克隆抗体(IMI-pAb)的间接竞争ELISA,检测限是30ng/ml[11]。国内,郑尊涛等报道了IMI的间接竞争ELISA检测方法,最低检测限为1.2μg/L,该研究的下一步计划是研发试剂盒[12]。朱国念等在2005年制备了吡虫啉多克隆抗体,利用酶联免疫反应测定其检测限为1.1 µg/L[13]。本研究的吡虫啉ELISA快速检测试剂盒比起高效液相色谱法、气相色谱法以及电化学分析法更为简便;该试剂盒对蔬菜、水果样本的检测限为20μg/kg,虽然比起上述文献中的同类方法较高,但是此类文献并未开发出试剂盒,实际应用性有待加强;同时该试剂盒的操作时间仅需1.5h,即具有更适宜现场快速检测的优点。
目前,色谱法是公认的药物残留检测方法,但这类方法普遍存在着所需仪器昂贵、操作技术要求高、样品前处理繁琐和分析耗时长、检测成本高、不适于现场实时检测等问题。而药物残留免疫检测技术在残留样本检测过程中的复杂程度、速度、灵敏度、准确性、特异性、单位时间内样本分析容量、检测成本等方面与仪器分析法的比较优势突出,几乎克服了仪器分析法所表现出来的所有不足,近年来已经在食品质量安全检测中得到了越来越广泛的应用,逐渐被人们认可。
今天,人们对农产品安全呼声日益提高,农产品中农药残留的有效检测手段致关重要。国际上对农产品中吡虫啉最大残留量的规定日益严格,为更好地适应进出口贸易和保护人民的健康,开发农产品中IMI的残留快速检测技术势在必行。免疫学方法是当前药物残留检测的研究热点。如何使残留样本前处理程序更加简单、灵敏度更高、成本更低廉,是摆在我们面前亟待解决的重要问题。
[1] 剧晓青. 吡虫啉在茶叶和土壤中的降解动态研究[D]. 重庆: 西南大学, 2006: 15.
[2] 李广领, 姜金庆, 陈锡岭等. 吡虫啉残留酶联免疫吸附检测方法的建立[J]. 食品科学, 2011, 32(12): 228-233.
[3] 李广领. 吡虫啉残留免疫学快速检测技术研究[D]. 河南科技学院, 2010: 1.
[4] Plack F J and Werber E. Method of determining imidacloprid residues in plant materials[J]. Pflanzenschutz Nachr Bayer, 1993, 469(2): 109-182.
[5] Ishii Y, Kobor I, Araki Y, et al. HPLC determination of the new insecticide imidacloprid and its behavior in rice and cucumber[J]. J. Agric. Food Chem, 1994, 42: 2917-2921.
[6] Fernbndez Alba A R, Valverde A, Aguer A, et al. S. Determination of imidacloprid in vegetables by high-performance liquid chromatography with diode-arry detection[J]. J. Chromatogr. A, 1996. 721:97-105.
[7] Erenchun N R, Balugera Z G, Goicolea M A et al. Determination of imidacloprid and its major metabolite in soils by liquid chromatography with pulsed reductive amperometric detection[J]. J. Analytical Chimica Acta, 1997, 349(1-3): 199-206.
[8] Fernandez Alba A R, Tejedor A, Aguera A et al. Determination of imidacloprid and benzimidazole residues in fruits and vegetables by liquid chromatography-mass spectrometry after ethyl acetate multiresidue extraction[J]. J. AOAC Int, 2000, 83(3): 748-755.
[9] Navalon A, Gonzalez Casado A, Khattabi R et al. Determination of imidacloprid in vegetable samples by gas chromatography-mass spectrometry [J]. Analyst, 1997, 122 (6):579-581.
[10] Jae Koo Lee, Ki Chang Ahn, Oee Suk Park, etal. Development of an ELISA for the Detection of the Residues of the Insecticide Imidacloprid in Agricultural and Environmental Samples[J]. J. Agric. Food Chem, 2001, 49, 2159-2167.
[11] Zhixiong Li, Yingli Liu, Yuanming Sun, et al. Development of polyclonal antibody based enzyme linked immunosorbent assay for the analysis of the agricultural insecticide imidacloprid: food quality and safety[J]. Asia Pac J Clin Nutr, 2007, 16 (S1): 102-105.
[12] 郑尊涛. 杀虫剂吡虫啉和氟虫腈的酶联免疫吸附测定技术研究[D]. 杭州: 浙江大学, 2004: 42.
[13] 朱国念, 桂文君, 郑尊涛等. 吡虫啉人工抗原的合成与鉴定[J]. 中国农业科学, 2005, 38(3): 511-515.
S859.83
A
1007-1733(2013)05-0006-03
2013–04–15)
