肉鸡死胚中沙门氏菌的分离及血清学鉴定
2013-06-05赵玉梅青海省海南州兽医站813000范玉霞青海省牧科院西宁810000
赵玉梅 (青海省海南州兽医站 813000) 范玉霞 (青海省牧科院 西宁 810000)
试验研究
肉鸡死胚中沙门氏菌的分离及血清学鉴定
赵玉梅 (青海省海南州兽医站 813000) 范玉霞 (青海省牧科院 西宁 810000)
对大通县某鸡场孵化21d的42枚死亡鸡胚无菌采集心、肝、脾、肺等脏器,进行常规的细菌分离与培养,分离出9株沙门氏菌,阳性率为21.43%,并对分离到的菌株进行细菌学鉴定、血清型鉴定和动物试验。结果显示,此批死鸡胚中沙门氏菌的带菌率较高,应该引起有关部门的重视。
沙门氏菌 死胚 分离 血清学 鉴定
沙门氏菌是一种重要的革兰氏阴性,细胞内寄生的,形态、生化特性和抗原结构相似的人畜共患的肠道病原菌,其型别繁多,定型复杂[1]。目前,有关沙门氏菌的分类已有改进,依据新的分类方法,沙门氏菌可分为两个种,即S.enterica 和S.bongori[2],迄今为止全世界已经发现了2523个血清型,而我国发现的就有216种[3,4],而且还有新的血清型在不断地被发现。沙门氏菌在自然界中分布十分广泛,不但能引起家畜家禽及其他动物发生急性、慢性或隐性感染,而且在爬行冷血动物中的带菌现象也很普遍。除此之外,它还能通过污染食物导致人的食物中毒,对人类身体健康构成潜在的威胁[5,6,7]。中国是世界上养鸡最多的国家,多年以来,禽病一直是困扰我国养禽业的关键问题之一。目前我国禽病约有80余种,其中传染病占75.21%,非传染性疾病占24.79%[8],据估计我国家禽死亡损失年均约百亿元,鸡沙门氏菌病是由沙门氏菌属细菌引起的一种常见的肠道传染病。严重影响种蛋的孵化率、雏鸡存活率和鸡产蛋率,对畜禽业的发展影响很大[9],它是造成我国家禽成活率不高的一个主要原因。
目前,国内外学者已建立了多种快速检测沙门氏菌的方法,有ELISA、气相色普、生物发光技术、放射免疫测定法等高新技术及API、R-B、E-15等简易生化诊断技术[10,11,12]。这些方法虽能准确、快速地检测出沙门氏菌,但存在着耗时,耗力,检测成本高,且需要价格昂贵的仪器设备等特点,不宜于基层的推广应用。相比之下,传统的实验室分离培养、生化反应和血清学鉴定等常规方法,虽然也存在着费时费力等缺点,但常规的病原分离操作步骤比较简单、易行,实验结果比较可靠。
2009年3月在大通县某鸡场孵化21d的死胚数量增加,经剖检后可见卵黄囊发炎,卵黄均吸收不良,大多为黄绿色干酪样物质,肝脏肿大且有充血、淤血,十二指肠内有干酪样物质,为了初步摸清沙门氏菌在该场死胚中的感染情况,对采集的42死胚进行了常规的细菌分离、培养及血清学鉴定。
1 材料与方法
1.1 材料
1.1.1 样品来源 无菌采取大通县某鸡场肉鸡死胚中的心、肝、脾、肺等脏器,置4℃冰箱保存备用。
1.1.2 培养基 普通营养琼脂平板、麦康凯琼脂平板、S.S琼脂平板、普通营养肉汤及葡萄糖、麦芽糖、甘露醇、蔗糖、乳糖、MR、H2S、V-P、枸橼酸、尿素酶、靛基质、硝酸盐、三糖铁(TSI)等各种生化培养基。均由青海大学农牧学院动物医学系传染病实验室自制。
1.1.3 沙门氏菌诊断血清 沙门氏菌的163种诊断血清(批号:810003,购于卫生部兰州生物制品研究所)。
1.1.4 试验动物 健康昆明系小白鼠4只,15~16g/只(均购自于青海省地方研究所)。
1.2 方法
1.2.1 样品的采集及死鸡胚的剖检 将送检的死亡种蛋编号,分别用75%的酒精将种蛋外壳消毒后,打破蛋壳,取出胚胎,置于灭菌的平皿中,用酒精棉球涂擦胚胎胸腹部,再分别用灭菌的剪、镊剪开胸腹腔,依次采取心、肝、脾、肺等脏器,置4℃冰箱保存备用。最后再进行死胚病变的观察。
1.2.2 细菌的分离、纯化及染色镜检 将病料接种到营养肉汤中,37℃培养18~24h后用灭菌接种环勾取肉汤培养物分别接种于普通琼脂平板、麦康凯琼脂平板和S.S琼脂平板上,37℃培养18~24h后观察菌落形态,勾取1/3疑似菌落涂片,染色镜检,勾取G-菌落,在S.S琼脂平板上进行数次纯化培养,而后将分纯的细菌接种到普通斜面上,37℃培养18~24h后,置4℃冰箱备用。
1.2.3 生化鉴定 将分纯的9株疑似沙门氏菌菌株分别接种于葡萄糖、麦芽糖、甘露醇、蔗糖、乳糖、MR、H2S、V-P、枸橼酸、尿素酶、靛基质、硝酸盐、三糖铁(TSI)等各种生化培养基中,37℃培养24~48h后,观察其结果。
1.2.4 血清型鉴定 将分纯的9株疑似沙门氏菌分别用沙门氏菌A~F多价血清凝集,再用因子血清分型,操作步骤按沙门氏菌诊断血清操作说明书进行。
1.2.5 动物试验 分别勾取疑似沙门氏菌的菌株接种于4块普通营养琼脂平板上,于37℃培养18~24h后,用灭菌的生理盐水将其无菌洗下,制成菌悬液,用麦氏比浊管进行比浊,选取8×108个活菌/ml浓度,分别腹下注射4只小白鼠,0.2ml/只,同时用灭菌的生理盐水腹下注射2只小白鼠,作对照试验,观察结果。
2 结果
2.1 死胚病变
死鸡胚剖检后可见卵黄囊发炎,卵黄均吸收不良,大多数有黄绿色干酪样物质,肝脏肿大且有充血、淤血,十二指肠内有干酪样物质。
2.2 菌落形态及培养特性
9株分离菌在麦康凯琼脂平板上不生长;在S.S琼脂平板上形成无色或灰白色、圆形,半透明、表面光滑、湿润、隆起、边缘整齐的菌落;在普通琼脂平板上为圆形、隆起、光滑、湿润、无色、半透明、似露珠大小的菌落;普通营养肉汤均匀混浊。
2.3 生化鉴定结果
结果见表1。
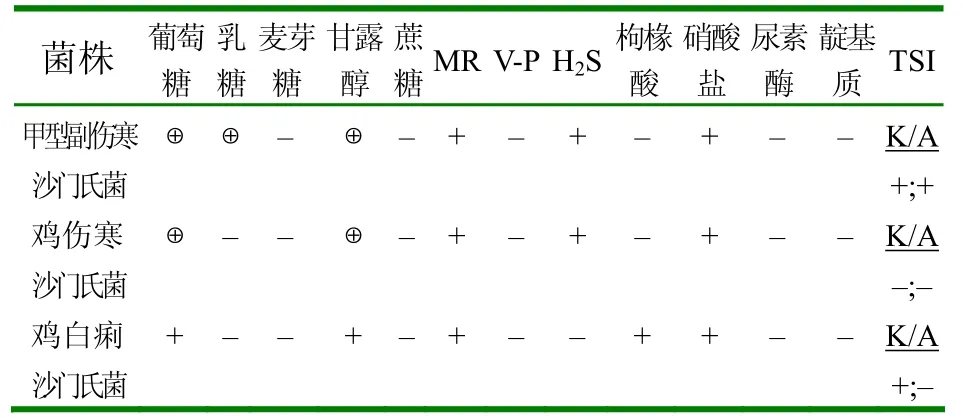
表1 生理生化试验结果
2.4 血清学鉴定结果
通过血清学鉴定,分离出5株甲型副伤寒沙门氏菌,3株鸡伤寒沙门氏菌,1株鸡白痢沙门氏菌。

表2 血清学鉴定结果 (%)
2.5 动物试验结果
试验组的4只小白鼠在24~36 h后内全部死亡,接种生理盐水的2只对照组小白鼠饲喂7d后仍健活。剖检死鼠可见到胸腹腔中有大量积液,肝脏肿大,边缘淤血,肠管出血,有的肠管部分淤血,脾脏出血,左右心室有部分淤血现象。无菌采取死亡小鼠的肝、脾等脏器触片、染色镜检,可观察到有革兰氏阴性杆菌,同时进行细菌的分离,分离到了与上述一致的革兰氏阴性小杆菌。
3 讨论
(1)从大通县某鸡场孵化的42枚死鸡胚中分离出9株细菌,所检死胚中沙门氏菌的带菌率是21.43%,结合死亡小白鼠的病理变化,认为细菌性因素很可能是造成鸡场孵化率降低的一个主要原因[13]。(2)通过血清学鉴定,分离出5株甲型副伤寒沙门氏菌,阳性率11.91%,3株鸡伤寒沙门氏菌,阳性率7.14%,1株鸡白痢沙门氏菌,阳性率2.38%。从结果来看,其中鸡伤寒沙门氏菌占分离菌株的33.33%;鸡白痢沙门氏菌占分离菌株的11.11%;甲型副伤寒沙门氏菌占分离菌株的55.56%,甲型副伤寒沙门氏菌为优势菌。(3)早在50年代中后期,Duguid等认为细菌的菌毛与致病性有关,菌毛可以与宿主细胞特异性受体结合,导致细菌与宿主细胞的粘连,构成细菌感染的开始。沙门氏菌常存在于鸡只的卵巢等生殖道和肠内容物中,可在种卵在形成过程中,由病菌经输卵管进入蛋内或在通过泄殖腔及孵化过程中蛋壳表面遭到污染[14]。一般带菌种鸡所产种蛋的带菌率可达20%~30%,不仅孵化率低,并有死雏和病雏。加之孵化场消毒工作不彻底等因素的影响,病原菌可污染孵化器、出雏器和育雏室,造成水平传播,直接和间接损失巨大。如果污染孵化器和出雏器,则孵化出来的幼雏就会被感染。因此种鸡场的孵化室、育雏室等所有器具要经常清洗消毒,育雏早期用药应选用高敏药物,并且要更换使用。加强对雏鸡、饲料和饮水的检查,鸡舍内的灰尘和病鸡,定期进行沙门氏菌监测检查和净化,确保卫生管理的效果和鸡场、鸡群的清净度[15,16]。减少沙门氏菌的感染及发病机率,从而提高孵化率。(4)沙门氏菌既可以水平传播,也可垂直传播。污染面积甚大,常致鸡终生感染,鸡沙门氏菌病包括鸡白痢,鸡伤寒,鸡副伤寒三个疫病,鸡白痢是由鸡白痢沙门氏菌引起,鸡伤寒是由鸡伤寒沙门氏菌引起,鸡副伤寒是由多种沙门氏菌引起[17,18,19]。鸡副伤寒可导致各种幼龄禽高发病率和高死亡率,感染了鸡副伤寒沙门氏菌的鸡群,其环境污染严重,应予及时进行消毒。其中人和各种动物对引起禽副伤寒的沙门氏菌均具有易感性,而来源于禽副伤寒的禽类产品常是导致人类沙门氏菌感染和食物中毒的重要原因之一[20],经常在欧美、日本等导致严重的社会公共卫生问题,也是我国禽肉和蛋制品难以出口的主要原因之一。另外,由于养禽生产单位为控制或净化禽沙门氏菌病,经常在饲料或饮水中加入各种抗生素,常导致耐药菌株的产生。1985年在欧美、1989年在日本,由沙门氏菌引起的食物中毒急剧增加。为此,1989年3月在瑞士召开了“关于防止鸡与蛋沙门氏菌污染”的世界卫生组织紧急会议,讨论食物中毒的原因和今后的预防对策。(5)在食品蛋所携带的微生物中沙门氏菌对人体最有害,是致病菌[21]。我国现行鲜蛋卫生标准,没有考虑鸡蛋所带的微生物数量,美国食品蛋卫生标准规定,带有沙门氏菌的食品蛋视为不合格产品,不能食用。所有食品蛋必须通过清洗消毒、保鲜处理,才能上市销售。也只有这样,广大消费者才能获得安全、卫生的食品蛋。此外孵化场将未孵化的种蛋以毛蛋的形式出售,而一些消费者又有食用毛蛋的习惯,无形当中增加了人类感染沙门氏菌的潜在危险性。(6)目前引起沙门氏菌感染的主要原因可能有以下几种:大多数中小型鸡场都是在原有家庭分散小群饲养基础上发展起来的,忽视了大群饲养后疫病防治工作的重要性;孵化场选蛋和种蛋消毒不严;鸡胚感染沙门氏菌比例较高,导致大量死亡,一部分带有沙门氏菌的鸡出壳后陆续发病,死亡增加;盲目引进种鸡;饲料配合不当;潜在疾病控制不力,致使沙门氏菌感染率增高,造成较大的经济损失。我国的禽病防治水平与世界发达国家相比还存在着差距,在我国加入WTO的今天,我国的禽病防治只有尽快地与国际接轨,建立有效的运行机制以符合我国实际的防治策略与措施,才能真正使我国养禽业走向世界。
[1] 张慧玲, 韦秀英. 安徽省沙门氏菌血清型分布[J]. 上海预防医学杂志, 2000, 12(6): 275-276.
[2] 张燕, 朱超. 我国沙门氏菌病和菌型分布概况[J]. 现代预防医学,2002, 29(3): 400-401.
[3] Popoff M Y,Bockemuhl J,Brenner F W. Supplement 2001(no. 44)to the Kauffmann-White scheme[J]. Res Microbiol,2001,152(10): 907-909
[4] Collette F. Rachel S,Linda L G,et al. Molecular analysis of the rfb Oantigen gene cluster of Salmonella enterica serogroup 0:6,14 and development of a serogroup-specific PCR assay [J]. Applied and Envirommental Microbiology,2003,69(10):6099-6105
[5] 况慧星,韦婷. 禽沙门氏菌的检测与防制[J]. 中国家禽, 2003, 25(4): 1-4.
[6] 张华. 动物性产品中沙门氏菌的危害及控制措施[J]. 中国动物保健, 2004. 8-10.
[7] 薛应照. 采取综合措施控制肉类的沙门氏菌病污染[J]. 卫生管理,2001,12(21):28-29.
[8] 王宏主编. 鸡病最新防治技术[M]. 沈阳: 辽宁科学技术出版社, 1996. 1-2.
[9] 赵静. 竞争排斥(CE)法防治鸡沙门氏菌感染的研究概况[J]. 中国兽医杂志,1997,23(10): 43-44.
[10] 李碧萍, 孙福泉, 林炳玲等. “四管法”快速检测沙门氏菌的研究[J]. 中国兽医杂志,1994,20(10): 10-11.
[11] 文其乙, 焦新安, 刘秀梵等. 直接ELISA检测沙门氏菌方法的建立及应用研究[J]. 中国兽医学报, 1995, 15(2): 105-110.
[12]冯同喜,王燕宁 ,张建芳等. PCR-反相杂交法检测沙门氏菌invA、invE 基因[J]. 西北国防医学杂志, 2000, 21(4): 303-304.
[13] 孙协军, 卢磊, 胡延娟等. 死胚内细菌的分离鉴定[J]. 畜牧与饲料科学, 2002(2): 57-59.
[14] 蔡宝祥主编. 家畜传染病学(第3版)[M]. 北京: 中国农业出版社, 1996. 55-61.
[15] 陆承平主编. 兽医微生物学(第3版)[M]. 北京: 中国农业出版社, 2001. 223-231.
[16] 邢攸荷. 饲料沙门氏菌污染的危害及防制举措[J]. 农村养殖技术,2004,19: 34-35.
[17] 沙莎, 孙裕光, 王琴. 我国鸡白痢沙门氏菌病诊断于防治研究概况[J]. 西南民族学院学报·自然科学版, 2003, 29(2): 190~195.
[18] 徐树强. 鸡沙门氏菌的分离鉴定及药敏试验[J]. 中国禽业导刊, 2002, 19(6): 15.
[19] 王淑芳, 刘一尘, 薛帮群等. 禽巴氏杆菌、大肠杆菌、沙门氏菌三联油乳灭活苗的研制及试用[J]. 动物医学进展,2004, 25 (1):113~115.
[20] 陆桂平, 王涛, 刘杰. 蛋鸡场沙门氏菌卫生对策[J]. 生产技术, 2002, 19(17): 32.
[21] 李晴云,杜华锐,蒋小松等. 鸡蛋微生物测定与分析[J]. 四川畜牧兽医, 2003, 5(30): 22-23.
S858.31
A
1007-1733(2013)05-0001-03
2013–03–04)
