不同盐度水淹胁迫对海滨木槿生理特性的影响
2013-06-04周和锋李会欣邵学新房聪玲叶小齐
周和锋,李会欣,邵学新,房聪玲,叶小齐,吴 明.
(1. 浙江省慈溪市林特技术推广中心,浙江 慈溪 315300;2. 中国林业科学研究院亚热带林业研究所,国家林业局杭州湾湿地生态系统定位研究站,浙江 富阳 311400)
海滨木槿(Hibiscus hamabo)原产我国浙江舟山群岛和福建沿海岛屿,根系发达,抗风力强,能耐短时期的水涝,能在pH 8.2、含盐量1.1% ~ 1.5%的滩涂泥土中正常生长,是典型的盐生植物,是华东沿海地区优良的海岸防风林树种[1]。我国海岸线面积广阔,但由于季节性积水及海水的侵入等原因形成了大面积处于荒芜和半荒芜状态的滩涂,严重影响了防护林的建设。水涝胁迫是滩地植物最常见的逆境胁迫因子之一[2],过多的水分造成土壤缺氧和光照不足,影响根系活力和光合生理,植物组织产生过量的活性氧自由基引发膜脂过氧化作用[3],而植物则通过内部生理代谢的变化适应淹水胁迫。近年来,有关树木如红树等耐水淹机制已有一些报道,而有关海滨木槿这方面的报道较少。本文通过分析海滨木槿内部抗氧化酶对地表水和海水胁迫的响应,探讨海滨木槿对水淹胁迫的生理适应机制,这对其在沿海防护林及河道沿岸生态绿化中的应用具有重要意义。
1 材料与方法
1.1 试验材料
试验选用的海滨木槿为预备试验中筛选出来的生长一致的1年生扦插苗,苗高约50 cm,地茎0.7 cm;实验设置高盐度和低盐度两种水淹胁迫类型。高盐度水为取自浙江杭州湾海域的海水,总含盐量为8.18 ‰,pH值8.17,基本离子与组成为:Na+10.62 g/kg,Cl-19.10 g/kg,Mg2+1.28 g/kg,Ca2+0.40 g/kg,K+0.38 g/kg。低盐度水为取自慈溪庵东镇地表水,总含盐量为3.71‰,pH8.70。
1.2 处理设置
试验于2009年7-9月在杭州湾湿地生态站实验大棚内进行。采用“双套盆法”[4],即将栽植苗木的花盆放于水泥池内,于2009年7月28日开始水淹,试验设置5个处理①ck:正常管理,土壤含水量为田间持水量的70%;②DA:用地表水处理,保持水层距盆土表面5 cm;③DB:用地表水处理,保持水层距盆土表面20 cm;④HA:用海水处理,保持水层距盆土表面5 cm;⑤HB:用海水处理,保持水层距盆土表面20 cm。定时补水,保持水面稳定。分别于水淹的第1天、第9天、第17天、第26天及复水(胁迫解除)后20 d取成熟叶片,每个处理设置3盆重复,每盆取5张叶片混合,进行相关生理指标测定,结果为3盆植物的测定平均值。
1.3 测定指标及方法
叶绿素含量采用乙醇-丙酮混合法提取[5];电解质渗出率的测定用电导率法;MDA含量的测定采用硫代巴比妥酸显色法;脯氨酸含量的测定采用茚三酮显色法;SOD活性的测定采用NBT(氮蓝四唑)光化还原法;POD活性的测定采用愈创木酚法[5]。
1.4 数据分析
试验数据用Microsoft Excel和SPSS 10.0软件分析,用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 不同盐度胁迫对海滨木槿叶绿素含量的影响

图1 水淹胁迫对海滨木槿叶片叶绿素含量的影响Figure 1 Effect of seawater and river water stress on chlorophyll content in H. hamabo
叶绿素含量是反映植物光合能力的重要指标[6],在一定程度上可反映植物的受害程度。由图1可知,海滨木槿在低盐度地表水胁迫初期,DA、DB处理的叶绿素含量相对ck有所下降,17 d后各处理的叶绿素含量下降程度更明显,胁迫第26天降至最低,仅为对照的87%、67%,复水(胁迫解除)第20天,各处理的叶绿素含量均高于对照。在高盐度海水胁迫下,各处理的叶绿素含量与地表水相比变化趋势一致,但下降程度较明显,在胁迫第26天,HA、HB处理的叶绿素含量分别是对照的 64%、53%,胁迫解除后,各处理的叶绿素含量有所上升。表明随着胁迫程度的加深和时间的延长,缺氧影响叶绿素的合成,叶绿素总量下降,而海水胁迫下叶绿素受伤害程度更明显。

图2 水淹胁迫对海滨木槿叶片MDA含量的影响Figure 2 Effect of seawater and river water stress on MDA content in H. hamabo
2.2 不同盐度胁迫对海滨木槿MDA含量的影响
MDA是细胞质膜过氧化的重要产物,会引起叶片的损伤,其含量的高低可以反应逆境胁迫下植物伤害程度的大小。从图2可知,随淹水时间的延长,地表水与海水胁迫下叶片MDA含量相比对照呈先上升后下降的趋势,且水淹程度越大变化趋势越明显[7]。方差分析表明,淹水第1天,地表水胁迫下各处理与对照差异不显著,海水胁迫下HA、HB处理的MDA含量与对照差异极显著,分别是对照的1.7、2.0倍;水淹 9 d,地表水胁迫下DA、DB处理的MDA含量与对照差异极显著,分别是对照的130%、127%,而海水胁迫下各处理与对照差异不显著;水淹胁迫的第17天,无论是海水还是地表水,各处理与对照差异均不显著;水淹后期,海水和地表水胁迫下各处理MDA含量均明显降低,DA、DB处理为对照的83%、94%,HA、HB处理仅为对照的79%、67%;复水后的第20天,地表水胁迫过的MDA含量与对照差异不显著,而海水胁迫过的仍与对照差异显著。
上述分析表明,与地表水相比,海水对海滨木槿叶片的伤害程度较大,且水淹程度越大,MDA含量越多,可能是由于在海水胁迫下,海滨木槿受到水淹和盐双重胁迫的影响。在水淹胁迫的初期,地表水胁迫下 MDA含量与对照差异不显著,说明此时还未对植物造成伤害,而海水胁迫下各处理的 MDA含量突然上升,表明植物对海水较为敏感,受害程度较大,膜系统受损。在地表水胁迫的第9天,MDA含量才开始积累。之后,随着水淹时间的延长,MDA含量明显降低且低于对照,这表明,海滨木槿可通过代谢机制降低过氧化物对膜伤害,这也是适应逆境的一种表现。
2.3 不同盐度胁迫对海滨木槿电解质渗出率的影响

图3 水淹胁迫对海滨木槿叶片电解质渗出率的影响Figure 3 Effect of seawater and river water stress on electrolyte leakagein H. hamabo
细胞膜是植物细胞内外物质和信息交流的界膜,具有选择性,任何对膜的伤害都将导致膜透性增大。水淹胁迫下,细胞膜透性能反映膜的稳定性,常被作为植物耐涝性指标之一[8]。如图3所示,随着水淹时间的延长,地表水胁迫下各处理的电解质渗出率与对照相比持续上升。在水淹的第26天达到最大,DA、DB处理的电解质渗出率分别是对照的1.51、1.72倍。表明随着水淹时间的延长,海滨木槿受害程度加大,电解质渗出率增加。海水胁迫下,在水淹的前9 d,各处理电解质渗出率与对照差异均不显著,说明在水淹的初期细胞膜还未发生明显的渗透作用,但随着水淹时间的延长,各处理的电解质渗出率近直线上升。到水淹的第26天,HA、HB处理与对照差异达到极显著水平,分别为对照的1.77、2.01倍,表明海水各处理对海滨木槿的伤害明显高于地表水胁迫。复水20 d后,各处理仍与对照差异极显著,表明此时还未完全恢复。
2.4 不同盐度胁迫对海滨木槿叶片中SOD活性的影响
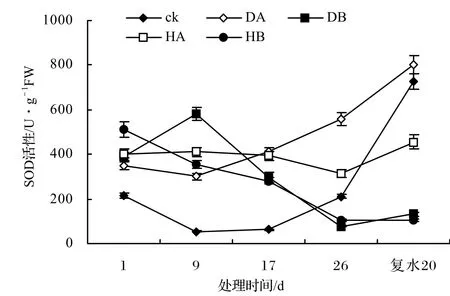
图4 水淹胁迫对海滨木槿叶片SOD活性的影响Figure 4 Effect of seawater and river water stress on activity of SOD in the leaves of H. hamabo
在正常情况下,细胞内自由基的产生和清除处于动态平衡状态,自由基水平很低,不会伤害细胞,当植物受到胁迫时,这个平衡就被打破,此时积累的自由基对植物细胞造成伤害,引起膜脂的过氧化,而细胞中清除氧的保护酶系统的存在和活性增强是细胞免于伤害的重要原因之一[10]。SOD是植物逆境生理中研究最多的一种酶,水淹胁迫对海滨木槿SOD活性的影响见图4,各处理的SOD活性表现出先升高后降低的趋势,对胁迫的反应比较一致,海水胁迫下的SOD变化趋势较明显。胁迫1 ~ 9 d,各处理的SOD活性都显著升高,DA、DB处理分别比对照升高了349%、769%,HA、HB处理分别比对照升高了601%、492%。胁迫17 ~ 26 d,各处理的SOD活性逐渐下降,但DA、HA处理仍高于对照,分别高出对照133%、32%,而DB、HB仅为对照的44%、47%。胁迫解除恢复20 d,各处理的SOD活性又有所回升。相比之下,SOD对海水胁迫的反应比对地表水胁迫更敏感。

图5 水淹胁迫对海滨木槿叶片POD活性的影响Figure 5 Effect of seawater and river water stress on activity of POD in the leaves of H. hamabo
2.5 不同盐度胁迫对海滨木槿叶片中POD活性的影响
POD在植物体内氧自由基清除系统中,起保护叶绿体细胞的作用,而且植物在胁迫反应中POD的变化比SOD表现得更加敏感[11]。如图5所示,地表水胁迫下,DA、DB处理的POD活性相比对照持续升高,胁迫第17天分别比对照提高14%、66%,胁迫第26天分别比对照提高42%、96%,在复水后的第20天,POD活性达到最高,分别高出对照46%、131%。可见,地表水胁迫下,海滨木槿始终保持较高的POD活性,对活性氧清除能力较高,且持续时间较长;海水胁迫下,各处理的POD活性与地表水相比,显著降低,在胁迫处理的前期,HA、HB各处理下的POD活性均低于对照,胁迫第17天仅为对照的71%、62%,胁迫处理的第26天,各处理的POD活性开始升高,为对照的150%、180%,复水20 d后各处理的POD活性与对照差异极显著。表明在海水胁迫下,植物受伤害程度较大,POD活性较低,而地表水胁迫下POD还保持较高的活力以清除过氧化氢对细胞的过氧化作用。
2.6 不同盐度胁迫对海滨木槿叶片中脯氨酸含量的影响
渗透调节能力的提高是植物抗性增强的重要机制之一[9],脯氨酸是最有效的渗透调节物质,无论哪一种逆境,植物体内都积累脯氨酸,保持原生质体与环境的渗透平衡和膜结构的完整。从图6可知,海滨木槿叶片中脯氨酸的含量,随着水淹时间的延长出现先下降后上升的趋势。在水淹胁迫的第 1天,DA、DB处理下的脯氨酸含量与对照差异显著,分别高出对照73%、103%。HA、HB处理下的脯氨酸含量与对照差异极显著,分别高出对照76%、592%,表明初始阶段海水胁迫使海滨木槿产生了应激反应。在水淹胁迫的第9天,各处理下的脯氨酸含量下降,均与对照达到极显著水平差异,脯氨酸含量成倍的增加可降低海滨木槿叶片渗透势,维持了细胞的膨压。但随着水淹时间的延长,脯氨酸含量开始下降,可能是由于胁迫时间的延长,阻碍了脯氨酸的合成。复水后20 d,各处理的脯氨酸含量与对照差异不显著,表明海滨木槿的受害程度开始减弱。
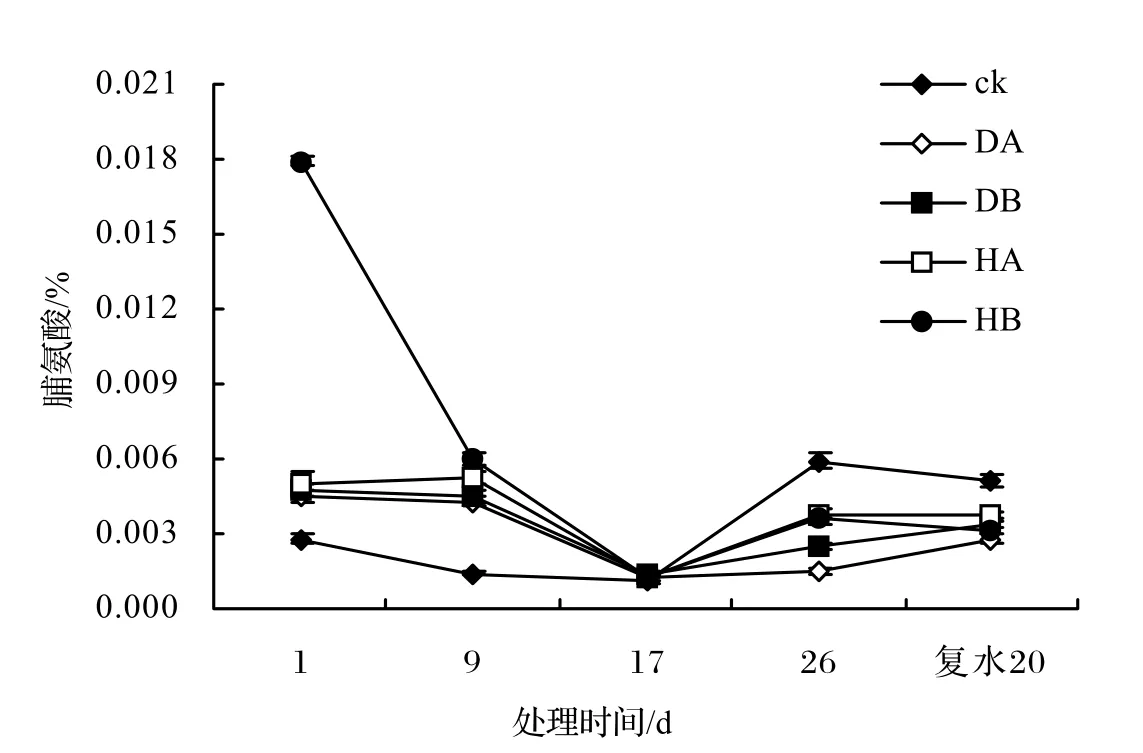
图6 水淹胁迫对海滨木槿叶片脯氨酸含量的影响Figure 6 Effect of seawater and river water stress on prol ine content in H. hamabo
3 结论与讨论
光合色素在光合作用的光能吸收、传递中起重要作用。叶绿素含量下降可以看成是植物受害后的重要生理指标,从其下降幅度,可以比较其受害程度[10]。本实验结果表明:随着水淹时间的延长,各处理的叶绿素总量降低,到胁迫第26天,地表水各处理的叶绿素含量为对照的 87%、67%,海水各处理的叶绿素含量仅为对照的 64%、53%,说明海水对海滨木槿的伤害较大。复水20 d后,各处理的叶绿素含量与对照相比均有所升高。
叶片中的电解质渗出率在水淹胁迫前期增幅不大,随着胁迫时间的延长开始大幅上升。随着水淹程度的加深和时间的延长,各处理的电导率与对照相比持续升高,且幅度较大。到水淹的第26天,HA、HB处理与对照差异达到极显著水平,分别为对照的1.77、2.01倍,而地表水相对较小。复水20 d后,各处理的电导率有所下降,但下降不太明显。而与之相对应的MDA含量变化不太明显,只是初期相对增加,之后与对照差异不显著,可能是由于叶片中的MDA含量的变化不能显示海滨木槿的受害程度[11]。
SOD和POD在水淹胁迫过程中变化趋势不一致,总体来看地表水胁迫下各处理的酶活性高于海水胁迫,可能由于海滨木槿受害较深,酶活性降低。DA处理中SOD活性先升高后降低,DB处理中到第17天SOD活性开始降低。而海水胁迫与地表水相比SOD酶活性较低,且持续时间较短。地表水胁迫下POD酶活性较高,且持续时间较长,海水胁迫下POD酶活性较低[12~13]。水淹处理期间,脯氨酸含量先增加后下降,说明在水分胁迫初期生成的渗透调节物质可以维持较强的渗透能力,以提高植株的适应能能力。说明,海滨木槿SOD和POD酶活性相对较强且持续时间长再加上渗透调节能力,这可能是耐短时间的水淹的原因之一。
[1] 俞慈英,徐树华. 海滨木槿的驯化及开发利用前景[J]. 林业科学研究,1999,12(2):210-213.
[2] 汤玉喜,刘友全,吴敏,等. 淹水胁迫下美洲黑杨无性系生理生化指标的变化[J]. 中国农学通报,2008,24(8):156-161
[3] 孙锦,李娟,郭世荣,等. 不同菠菜品种对海水胁迫的生理响应差异[J]. 西北植物学报,2008,28(4):703-744.
[4] 张晓平,王沁峰,方炎明,等. 淹水胁迫对浙江种源鹅掌楸光合特性的影响[J]. 南京林业大学学报(自然科学版),2007,31(3):136-138.
[5] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[6] 刘明,齐华,孙世贤,等. 水分胁迫对玉米光合特性的影响[J]. 玉米科学,2008,16(4):86-90.
[7] 孙锦,贾咏霞,郭世荣,等. 海水胁迫对菠菜(Spinacia olerancea)叶绿体活性氧和叶绿素代谢的影响[J]. 生态学报,2009,29(8):4 361-4 371.
[8] 王强,刘兆普,陈浩,等. 库拉索芦荟幼苗对海水胁迫的响应[J]. 植物生理学通讯,2007,43(3):549-550.
[9] 陈亚飞,杜国坚,岳春雷,等. 水分胁迫对普陀樟幼苗生长及生理特性的影响[J]. 浙江林业科技,2009,29(3):24-29.
[10] 肖强,郑海雷,叶文景,等. 水淹对互花米草生长及生理的影响[J]. 生态学杂志,2005,24(9):1 025-1 028.
[11] 罗祺,张纪林,郝日明,等. 水淹胁迫下10个树种某些生理指标的变化及其耐水淹能力的比较[J]. 植物资源与环境学报,2007,16(1):69-73.
[12] 曹兵,苏润海,王标,等. 水分胁迫下臭椿幼苗几个生理指标的变化[J]. 林业科技,2003,28(3):1-3.
[13] 钟雪花,杨万年,吕应堂,等. 淹水胁迫下对烟草、油菜某些生理指标的比较研究[J]. 武汉植物学研究,2002,20(5):395-398.
