氧气扩散传质对褐煤低温氧化反应影响的实验研究*
2013-05-30孟献梁刘亚菲褚睿智张中彩
孟献梁 刘亚菲 褚睿智 方 强 张中彩
(1.中国矿业大学化工学院,江苏省徐州市,221116;2.中国矿业大学煤矿瓦斯与火灾防治教育部重点实验室,江苏省徐州市,221116)
1 概述
褐煤在我国的储量较多,具有较多的非芳香结构和含氧基团,芳香核的环数较少,具有较大的孔隙率和较高的比表面积,且水分含量高、灰分大、易风化破碎,暴露于空气中极易氧化,属于易自燃的低阶煤。煤低温氧化是自燃的起始阶段,故其低温氧化的特性决定了自身的自燃性,褐煤低温氧化过程既包括较低温度时的物理吸附和化学吸附,同时还包括随着温度升高而逐渐加剧的化学反应。根据化学反应动力学原理,氧气的扩散传质直接影响煤样氧化过程的进度和程度,而温度和煤样的粒度对氧气传质过程和化学反应起着重要作用。
本文选取白音华褐煤为研究对象,以0.2~1.0 mm和1.0~2.0 mm这2个粒度下的2种煤样进行低温氧化实验,利用静态扩散双容积法测得氧气在煤体中的扩散系数,通过静态耗氧实验测得煤样在不同温度下的速率常数,重点考察了粒度和温度对氧气传质特性和煤样氧化特性的影响,旨在深入了解氧气传质特性与煤样氧化特性的关系,对丰富煤自燃理论具有重要意义。
2 实验步骤
2.1 煤样的制备
制得粒度为0.2~1.0 mm和1.0~2.0 mm的2种煤样,密封保存使煤样不被氧化。用低温氧化装置分别对2种煤样在50℃、70℃、90℃、110℃、130℃、150℃和170℃下氧化8 h,取出后密封置于干燥器中待用。
2.2 煤体中氧气扩散系数的测定
基于静态扩散双容积法,把待测试煤样装入煤样管中,与左右2个气室对接,关闭旋塞。密闭的A、B气室中分别充入氧气和氮气,使2个装置内压力平衡,之后使用GC9160气相色谱仪测得2个气室内气体的初始浓度,取两次平行样。打开旋塞扩散开始计时,之后每隔2 h取一次样,测得两气室内氧气浓度变化情况,煤氧扩散装置如图1所示。

图1 煤氧扩散装置示意图
2.3 煤样氧化反应速率常数的测定
称取上述2种粒度的原煤样各50 g置于反应瓶中,反应瓶置于程序升温箱内,煤样在50℃、70℃、90℃、110℃、130℃、150℃和170℃这7个温度点下分别氧化8 h左右,并用气相色谱仪测量反应瓶内氧气浓度随时间的变化情况。
2.4 煤样的孔隙特性和空隙率测定
采用美国麦克仪器公司生产的AUTOPORE 9500压汞仪,对原煤及50℃、90℃、130℃和170℃下4个氧化煤样进行压汞实验,得到煤样的孔隙率变化情况。煤样的扩散实验结束后,可由装填长度和质量等数据得到其空隙率,煤样的孔隙率和空隙率数据见表1。
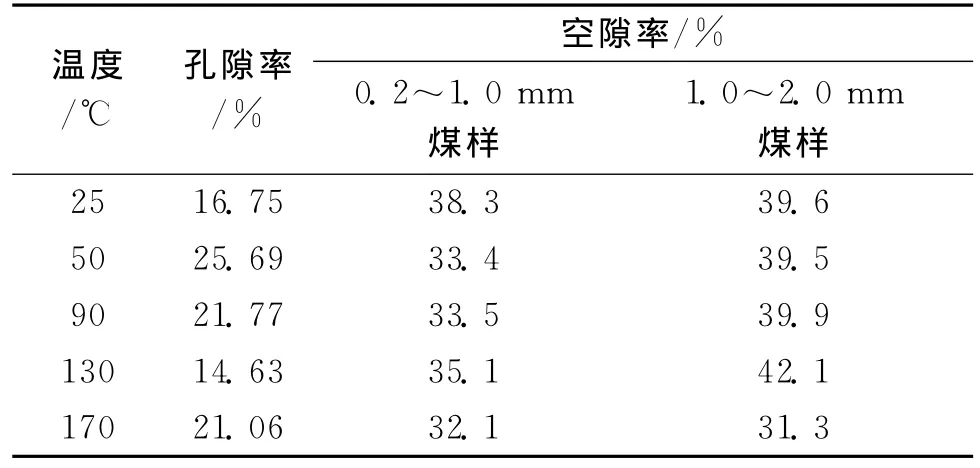
表1 煤样的空隙率和孔隙率数据
3 结果与讨论
3.1 煤体中氧气的等效扩散系数及其影响因素
根据静态双容积原理,在实验条件下任意时刻氧气的扩散过程为准静态,扩散通量为:
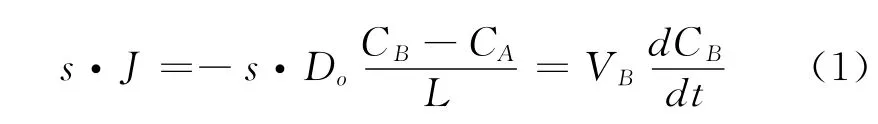
式中:s——煤样管的截面面积,m2;
J——氧气的扩散通量,mol/m2·s;
Do——氧气在煤体中的等效扩散系数,m2/s;
L——煤样管的长度,m;
VA、VB——A、B气室的体积,m3;
CA、CB——A、B气室内任意时刻氧气的浓度,mol/m3。
任意时刻两气室内氧气浓度与平衡浓度的关系如下:
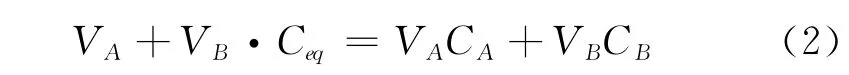
其中:

式中:Ceq——体系平衡时氧气的平均浓度,mol/m3;
C0A——A气室内氧气的初始浓度,mol/m3;C0B——B气室内氧气的初始浓度,mol/m3;
把式(2)和(3)整理,带入式(1),消去CA后,得:
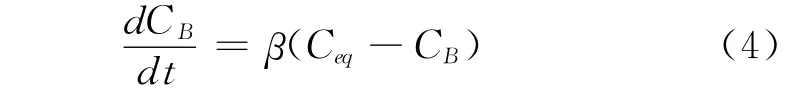

则通过测定一定时间内B气室内氧气浓度的变化规律,即可求得煤体中氧气的扩散系数为:

为了考察煤体在自然条件下(假设压力仍为常压)扩散时的实际温度对氧气扩散特性的影响,本文根据Maxwell-Gilliland公式对实验得到的扩散系数进行校正。(实验条件为常温常压,即T=25℃,p0=1.013×105Pa)
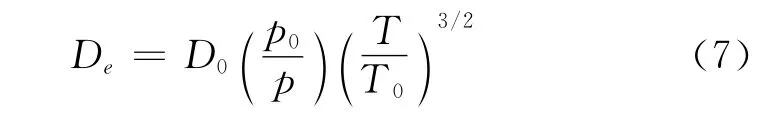
式中:De——自然条件下温度T时氧气在煤体中的等效扩散系数,m2/s。
依据上述煤低温氧化扩散传质规律,其氧气扩散系数计算结果见表2。
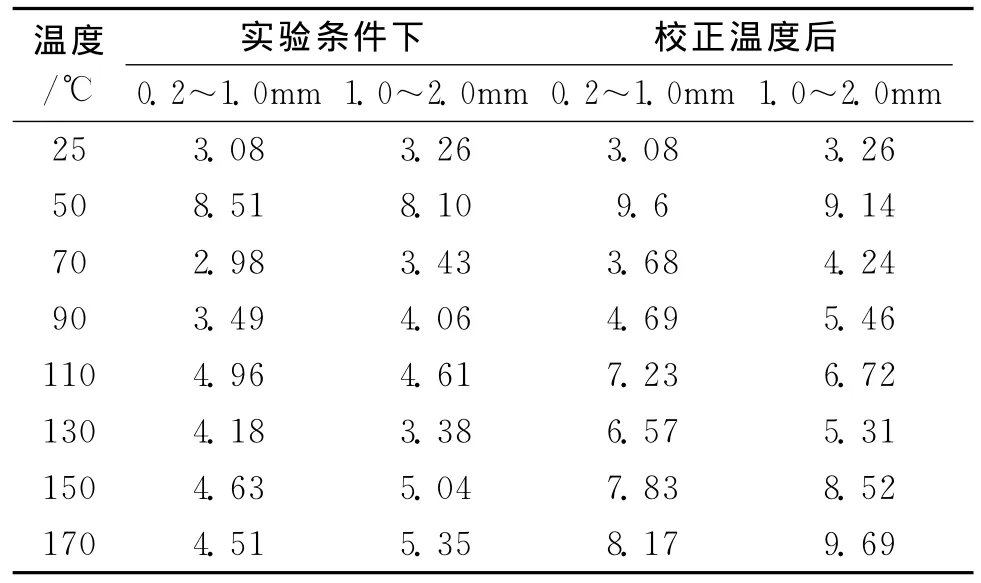
表2 不同粒度煤体中氧气等效扩散系数
对比表2经 Maxwell-Gilliland公式校正前后氧气的扩散系数,校正后的扩散系数与实验条件下测定结果基本一致,说明实验结果具有较高的精确度。
由表2可知,由于褐煤孔隙结构发达,温度在50℃时,孔隙内吸附的惰性气体向外逸出,使煤样的孔隙率增大,孔隙间的连通性也更好,故2种煤样的氧气扩散系数均达到最大。在70℃时2种煤样的扩散系数减小到与原煤的相差不大。温度在70~110℃时,扩散系数逐渐增大,随着温度升高,孔隙中的水分被大量蒸发。尤其在110℃时,0.2~1.0 mm煤样的扩散系数甚至大于1.0~2.0 mm煤样的扩散系数,原因是粒度较小的煤样传热更快更均匀,水分的蒸发使得孔隙更加发达畅通,更加有利于氧气的扩散。在130℃时,2种煤样的扩散系数均下降,原因是温度升高,煤体表面生成的氧化物质阻塞了部分孔隙,导致孔隙率下降到最小值,氧气扩散量减少。在150℃以后,2种煤样的扩散系数增加,这是因为温度持续升高,煤样稳定的结构可能发生破坏或部分坍塌,造成通道的扩大。当温度升高至170℃时,煤样的孔隙率增大,证明了这一结论。
相同氧化温度下,氧气在煤体中的扩散系数随着粒度的增大而增大。在50℃时,粒度小的煤粒传热均匀,煤孔隙内吸附的气体大量解析,同时蒸发出的水分能够快速释放到空气中,使更多的孔隙能够传输氧气,造成了小粒度煤样扩散特性优于粒度分布范围较宽的大粒度煤样。在110℃和130℃下,扩散系数变化的原因是粒度会影响到氧化反应进行的程度,相同氧化温度和氧化时间下,粒度越大,表面积越小,能够提供的反应位越少,造成反应相对滞后,新生成的氧化产物阻塞孔隙,阻碍了氧气的传递。
3.2 煤样低温氧化的动力学参数研究
煤氧之间的反应属于气固反应,可以表示为:煤+O2→Cm(g)+S(s),Cm和S分别表示生成的气体产物和固体产物。在计算中假设煤氧复合反应中煤表面的活性结构过剩,在任一温度下,只有一种化学反应起主导作用。通过测定反应装置内氧气浓度随着时间的变化规律,即可推导得到煤样在不同温度下的耗氧规律。

式中:vO2——耗氧速率,mol/(m3·s);
xA——t时刻反应装置内氧气的浓度,mol/m3;
t——反应时间,s;
n——反应级数;
k—反应速率常数。
对式(8)积分并整理,得
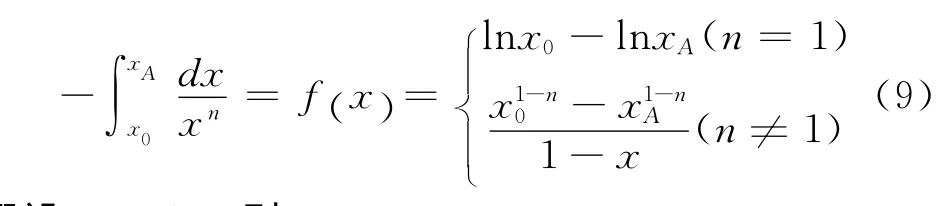

通过测定同一温度下不同时间的氧气浓度,利用Matlab软件对上式进行拟合,即可得出相应的反应速率常数k和反应级数n,若拟合结果的相关性系数较低,则说明反应级数为1,2种不同粒度煤样的反应速率常数和反应级数见表3和表4。
由表3和表4可以看出,2种煤样的速率常数随着温度的升高而增大,而煤样的反应级数均小于1。在50℃时,0.2~1.0 mm煤样的速率常数约为
假设n≠1,则1.0~2.0 mm煤样的2倍,由此可以说明低温时,煤样粒度越小表面积越大,可以提供的反应位越多,反应越容易进行。在70℃~110℃时,2种煤样的速率常数相差不大,表明这一温度段2种煤样的氧化反应受粒度的影响较小,而主要受温度的影响。在130~170℃时,0.2~1.0 mm煤样的速率常数急剧增大,而1.0~2.0 mm煤样急剧增大的温度点在150℃,由此可以表明随着温度的升高,氧化反应明显加快,而煤样经过110℃左右的化学键的断裂,生成了新的活性结构,利于反应进行。在150~170℃阶段,1.0~2.0 mm煤样的速率常增幅明显,这是因为煤样粒度越大,在前期的反应中受其空间结构限制,生成活性结构的时间滞后,因此,达到该阶段温度时,反应才加剧。
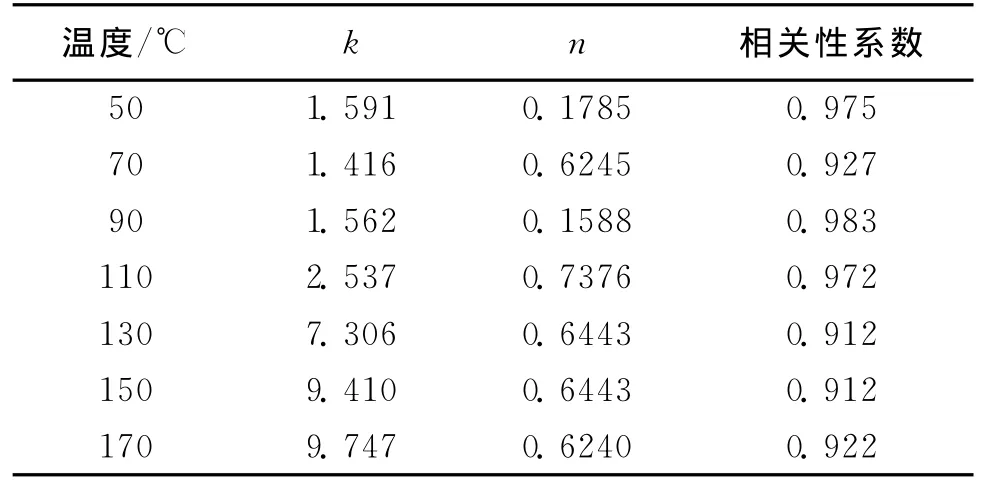
表3 0.2~1.0 mm煤样的反应速率常数(k)和反应级数(n)
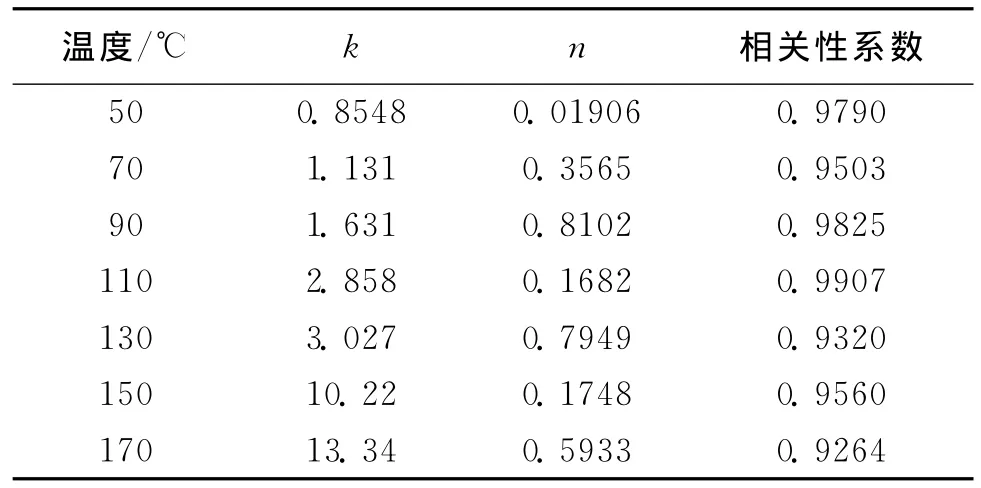
表4 1.0~2.0 mm煤样的反应速率常数(k)和反应级数(n)
3.3 煤样的扩散传质过程与低温氧化反应过程的变化规律
2种煤样的氧化反应速率常数随氧气等效扩散系数的变化规律见图2和图3,速率常数反映了氧化反应速率的大小,而扩散系数反映了氧气在煤体中的传质特性。根据图2和图3中表现出的规律,可以把褐煤低温氧化过程划分为3个阶段,第一阶段是50℃左右,吸附作用占主导地位,化学反应微弱,2种煤样的氧气扩散系数相同,小粒度煤样的化学反应比大粒度煤样的明显;第二阶段是70~110℃,化学反应逐渐加剧;第三阶段是130~170℃,化学反应剧烈进行。分别对图2和图3中第二阶段和第三阶段二者的关系进行了线性拟合,相关性系数均在0.95以上,表明二者呈线性关系,拟合结果见表5。

从表5可以看出,在第二阶段和三阶段内,煤样的化学反应速率均随着煤体中氧气扩散通量的增大而增大。第三阶段内拟合直线的斜率比第二阶段的大,说明煤样的氧化反应有缓慢氧化和快速氧化的分阶段特性。由于煤体在70~110℃内水分蒸发,且裂解反应逐渐加强,氧气浓度不是第二阶段化学反应的主要影响因素,而温度对其影响较大。第三阶段内,温度升高,氧化反应加剧,1.0~2.0 mm煤样的斜率大于0.2~1.0 mm煤样,表明在130~170℃内,1.0~2.0 mm煤样的氧化反应受氧气扩散通量的影响更为显著。
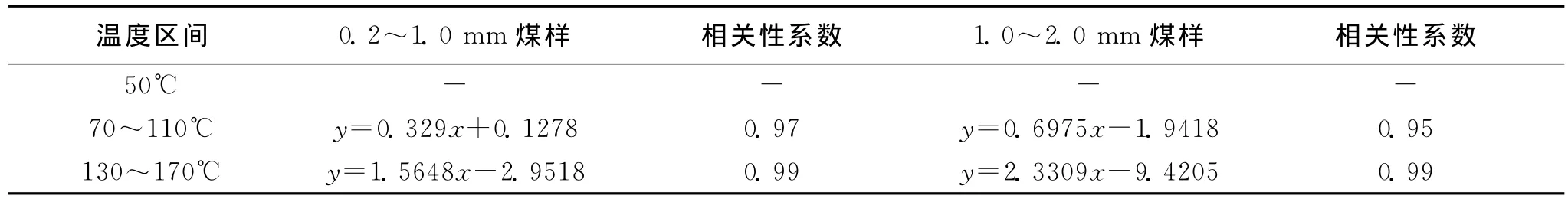
表5 D e与k关系拟合结果
4 结论
(1)通过静态扩散双容积原理,测得不同粒度的氧化煤样的氧气扩散系数,并应用 Maxwell-Gilliland公式对实验结果进行校正,得到自然条件下氧气在煤体中的等效扩散系数,扩散系数随粒度的增大而增大,随温度的增大而成一定变化规律。
(2)利用静态耗氧实验获得煤样低温氧化动力学参数,2种煤样的反应速率常数呈现较好的规律性,反应级数均小于1。
(3)根据低温氧化过程氧气扩散系数和速率常数的关系,将褐煤低温氧化过程化分为3个阶段:一是在50℃左右,吸附作用和缓慢的化学反应并存,扩散系数较大而反应速率较低,扩散占主要影响;二是在70~110℃,化学反应加速,温度对反应速率的影响较大;三是在130~170℃,化学反应剧烈进行,氧气浓度成为影响反应速率的主要因素。
[1]徐精彩.煤自燃危险区域判定理论 [M].北京:煤炭工业出版社,2001
[2]邓军,徐精彩等.松散煤体中氧气扩散系数的实验研究 [J].中国矿业大学学报,2003(2)
[3]Ashley Hull,Jennifer L.Lanthier et al.The role of the diffusion of oxygen in the ignition of a coal stockpile in confined storage [J].Fule,1997(10)
[4]Wang H.Theoretical analysis of reaction regimes in low-temperature oxidation of coal [J].Fuel,1999(9)
[5]夏清等.化工原理 [M].天津:天津大学出版社,2005
[6]何学秋,聂百胜.孔隙气体在煤层中扩散的机理[J].中国矿业大学学报,2001(1)
[7]胡道和.气-固反应 [M].北京:中国建筑科学出版社,1986
[8]王娜,朱书全等.宝日褐煤低温干馏特性及产物性质研究 [J].中国煤炭,2010(5)
