MCC、Survivin、P73和RhoA在大肠癌中的表达及意义
2013-05-30王玲玲赵海丰宋丽娜师庆红郭宏华何成彦
王玲玲,高 申,孙 莉,赵海丰,宋丽娜,师庆红,王 海,郭宏华,何成彦
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林大学第二临床学院,吉林 长春130041;3.佳木斯大学附属第一医院)
大肠癌是一种常见的消化道恶性肿瘤,是多种致癌因素共同作用发生的恶性病变。在全世界范围内,大肠癌是第三大恶性肿瘤,其病死率占全部癌症的第二位[1]。大肠癌的发生发展与基因的异常表达密切相关,涉及ras、myc等原癌基因的激活和APC、MCC、P53、P73等抑癌基因的失活。随着分子生物学的快速发展,关于大肠癌发生发展的机制和肿瘤标记物的研究进展迅速。本研究针对大肠癌组织、癌旁组织和健康对照三组样本,选取MCC、Survivin、P73和RhoA等四种基因进行检测,探讨以上指标与大肠癌发生发展的关系,为大肠癌发病机制的研究提供相关依据。
1 材料和方法
1.1 对象 选取吉林大学第二医院就诊的大肠癌患者癌组织和癌旁10cm以外的正常组织作为检测对象,癌组织均经病理检查证实为Dukes A期;对照组为20例取自因腹部外伤时的健康人的正常结肠组织。所有病例均签署知情同意书,并经医院伦理委员会审校批准。
1.2 方法
1.2.1 RNA提取 取100mg组织样品,加入1 ml的TRIZOL试剂,匀浆。匀浆后样品于15-30℃孵育5min,加入0.2ml的氯仿,振荡15秒,15-30℃孵育2-3min;4℃,12 000r/min离心15分钟。RNA沉淀:将水相转移到新离心管中,加入0.5ml的异丙醇,混匀后15-30℃孵育10min;4℃,12 000 r/min离心10min。移去上清液,加入1ml的75%乙醇,清洗RNA沉淀,振荡;4℃,7 500r/min离心5分钟。在空气中干燥RNA沉淀5-10min。加入无RNA酶的水,反复吹打几次,55-60℃孵育10 min,获得的RNA溶液保存于-70℃。
1.2.2 RNA质量检测 采用变性琼脂糖凝胶电泳来观察RNA的质量。其具体步骤如下:将1g琼脂糖溶于72ml水中,冷却至60°C,加入10ml的10×MOPS电泳缓冲液和18ml 37% 甲醛溶液;灌制凝胶板,胶凝后取下梳子,将凝胶板放入电泳槽内,加足量的MOPS电泳缓冲液;取5μl RNA,加等体积的2×甲醛上样染液,再加入少量EB;上样,在5–6V/cm电压下电泳至溴酚兰指示剂进胶至少2-3 cm;紫外透射光下观察并拍照,28S和18S核糖体RNA的带非常亮而浓,上面一条带的亮度大约是下面一条带的2倍。
1.2.3 cDNA合成 按以下条件配制反应液:buffer 2μl,上游引物(TAKARA公司设计)0.2μl,下游引物(TAKARA 公司设计)0.2μl,dNTP 0.1 μl,逆 转 录 酶 MMLV(TAKARA 公 司)0.5μl,DEPC水5μl,RNA模版2μl,混匀,6 000rpm 瞬时离心。混合液在加入逆转录酶MMLV之前先70℃干浴3分钟,取出后立即冰水浴至管内外温度一致,然后加逆转录酶0.5μl,37℃水浴60分钟;取出后立即95℃干浴3分钟,得到cDNA溶液,保存于-80℃待用。
1.2.4 实时荧光定量 PCR SYBR Green 1染料(TAKARA公司)10μl,上游引物F 0.5μl,下游引物R 0.5μl,dNTP 0.5μl,Taq酶1μl,模板DNA 5 μl,ddH2O 32.5μl,总体积 50μl;混匀,6 000rpm瞬时离心,于Real time PCR仪上进行扩增反应。反应程序设定:第一步:93℃2min,第二步:93℃1 min,55℃ 1min,72℃ 1min,40个循环,第三步:72℃7min。PCR反应完后,取PCR产物跑2%琼脂糖凝胶电泳,并加DNA Ladder作为参考,溴化乙锭染色,检测PCR产物是否为单一特异性扩增条带;用软件分析数据,记录反应体系中荧光信号的强度CT值,以GAPDH为内参,2-△△CT法计算各基因相对表达量。引物序列见表1。
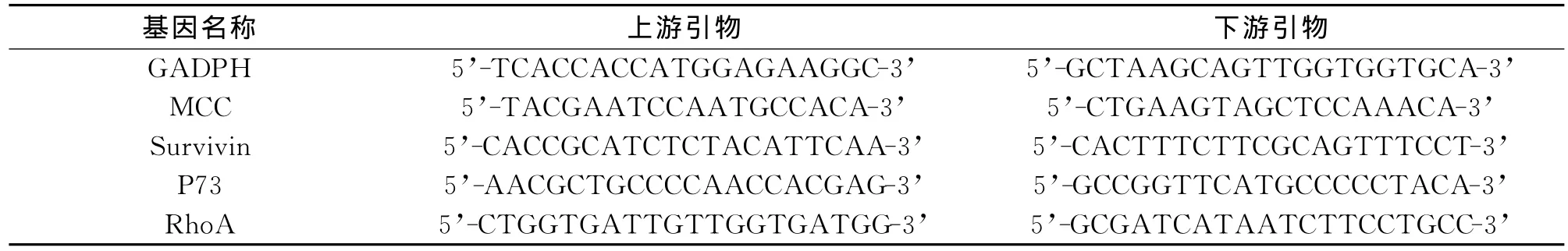
表1 MCC、Survivin、P73、RhoA和内参基因引物序列
1.3 统计学分析 每组数据以均数±标准差(x—±s)表示,将P<0.05设为显著性差异的标准。采用SPSS 13.0软件进行单因素方差分析。
2 结果
MCC、Survivin、P73和RhoA在大肠癌组织中的表达均显著高于癌旁组织和健康人结肠组织(P<0.01),而在癌旁和健康对照组中表达变化不大;4种基因在癌组织、癌旁组织和健康对照组中的表达情况见图1。

图1 Real time PCR检测 MCC、Survivin、P73和RhoA在大肠癌中的表达
3 讨论
MCC基因编码829个氨基酸,是1991年由Kinzler等人发现的,其与早期直结肠癌有密切关系。Fukuyama等[2]在研究锯齿状结肠癌时,发现MCC可能是一个潜在的肿瘤抑制因子,它可以抑制Wnt/β-连锁蛋白信号转导通路。近年来,关于MCC突变的研究较多,其突变发生于大肠癌早期[3];有学者发现,MCC基因在大肠癌及癌旁组织的突变率与正常组织差异有统计学意义,而癌组织与癌旁之间差异无显著性[4]。本研究显示,MCC在大肠癌组织中的表达显著高于癌旁及健康对照组,而癌旁与健康对照之间表达无统计学意义。根据MCC突变及表达情况,我们可以了解到其在大肠癌发生发展过程中发挥重要作用。Surivin基因长度14.5kb,含有4个外显子、3个内含子;Surivin是凋亡抑制蛋白家族成员之一,可以抑制细胞凋亡、促进肿瘤增殖、诱导血管生成。Surivin分布具有组织特异性,在正常成人组织的表达仅见于胸腺、睾丸和分泌期的子宫内膜;在大多数肿瘤组织中有高表达,包括肺癌、乳腺癌、胃癌、膀胱癌、食管癌、骨肉瘤和淋巴瘤[5]。Survivin与肿瘤的发生发展密切相关,有望成为肿瘤治疗的新靶点[6]。P73基因是Kaghad等在1997年发现的,定位于1p36.2-36.3,与P53在结构和功能上有相似性。P73过表达能够激活P53的靶基因,可以诱导细胞凋亡[7]。P73高表达预示临床预后较差,提示其在肿瘤发生过程中起到促进肿瘤进展的作用。Rho家族主要包括 Rho(A、B、C)、Rac和cdc42三个亚家族,其中RhoA在肿瘤的发生发展过程中发挥重要的作用。有学者对小鼠骨癌模型进行研究时发现,RhoA参与癌性骨痛的发展过程[8]。还有学者研究发现,在乳腺癌患者体内RhoA不仅表达高,而且与埃兹蛋白的表达机制有关,为肿瘤的治疗提供了新的靶点[9]。
本研究结果显示,MCC、Survivin、P73和RhoA在癌组织高表达,表明它们在大肠癌的发生发展过程中起重要作用。随着分子生物学技术的迅猛发展,相信我们会对越来越多的基因促进大肠癌发生发展的机制有更深一步的了解,从而为大肠癌发病机制和基因干预治疗的进一步研究奠定理论依据和实验基础。
[1]Koh Miura,Wataru Fujibuchi,Michiaki Unmo.Splice isoforms as therapeutic target for colorectal cancer[J].Carcinogenesis,2012,33(12):2311.
[2]Ryuichi Fukuyama,Roxana Niculaita,Kwok Peng,et al.Mutated in Colorectal Cancer,a Putative Tumor Suppressor for Serrated Colorectal Cancer,Selectively Represses β-catenin-Dependent Transcription[J].NIH-PA Author Manuscript,2008,27(46):6044.
[3]黄 萍.大肠癌相关基因改变的研究进展[J].国外医学卫生学分册,2003,30(1):44.
[4]朱理玮,章志翔,王鹏志,等.大肠癌中 MCC和APC基因突变检测及临床意义[J].中华实验外科杂志,1999,16(3):201.
[5]Waliqorska-Stachura J,Jankowska A,Wasko R,et al.Survivinprognostic tumor biomarker in human neoplasms-review [J].Ginekol Pol,2012,83(7):537.
[6]Thilo Sprenger,Franz Rodel,Tim Beissbarth,et al.Failure of downregulation of surviving following neoadjuvant radiochemotherapy in rectal cancer is associated with distant metastases and shortened survival[J].Clinical Cancer Research,2011,17(6):1623.
[7]Ramadan S,Terrinoni A,Catani MV,et al.p73induces apoptosis by different mechanisms[J].Biochem Biophys Res Commun,2005,331:713.
[8]Hang LH,Shao DH,Chen Z,et al.Spinal RhoA/Rho Kinase Signaling Pathway may Participate in the Development of Bone Cancer Pain[J].Basic Clin Pharmacol Toxicol,2013,Mar 22.doi:10.1111/bcpt.12069.[Epub ahead of print].
[9]Ma L,Liu YP,Zhang XH,et al.Relationship of RhoA signaling activity with ezrin expression and its significance in the prognosis for breast cancer patients[J].Chin Med J(Enql),2013,126(2):242.
