不同促排方案对PCOS患者ART妊娠结局的影响
2013-05-30王小飞马晓玲殷丽学张学红
王小飞,马晓玲,周 燕,殷丽学,张学红
(兰州大学第一医院生殖医学中心,兰州 730000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种常见的且病因较为复杂的异质性内分泌及代谢异常所致疾病,在临床上主要表现为月经稀发、无排卵、多毛、痤疮、肥胖、高雄激素血症、高胰岛素血症以及胰岛素抵抗(insulin resistance)等。PCOS在育龄期妇女中的患病率约为5% ~10%,占无排卵性不孕的 50% ~70%[1-2]。但迄今为止,PCOS的发病机制仍不明确,目前多数学者都倾向于该疾病为基因相关性疾病,是一种多基因作用的遗传[3],很可能是由某些致病基因与各种环境因素,饮食因素等共同作用引起[4-5]。PCOS是生育期妇女不孕的主要原因之一,即使能够成功受孕,早期流产率也较高。文献报道接受体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的PCOS 患者的早期流产率在20% ~30%[6]。本文回顾性分析了不同促排方案对PCOS患者妊娠结局的影响,以期为临床上对PCOS患者的促排方案提供依据。
1 资料和方法
1.1 研究对象 选择2008年6月至2010年6月在我院行IVF-ET助孕的150例PCOS患者。诊断依据2003年鹿特丹会议诊断标准[7]:①偶发排卵或无排卵;②临床或生化指标提升高雄激素血症病排除其它可能致病的因素,如先天性肾上腺增生、分泌雄激素肿瘤、Cushing综合征等;③卵巢多囊样改变:B型超声检查示每个切面有≥12个直径2~9 mm的卵泡和(或)卵巢体积增大>10 ml,符合其中两项者即可诊断为PCOS。
1.2 研究方法
1.2.1 分组方法与用药 本研究中收集因PCOS行IVF-ET助孕150例,其中17例(包括中重度卵巢过度刺激综合征15例、宫腔积液1例、内膜因素1例)取消移植。
150例均采用GnRH-a长方案,于前次月经周期的黄体中期肌注GnRH-a进行降调节,当垂体达到降调节标准(子宫内膜厚度≤5 mm,血清 E2<50 pg/ml,双侧卵巢的窦状卵泡直径 ≤5 mm)开始使用促性腺激素(gonadotropin,Gn),Gn的使用剂量根据患者年龄、基础窦状卵泡数、既往治疗对药物的反应及盆腔情况等来决定,按照其在促排期间所使用方案不同分为四组:A组:递增方案是从低剂量开始,逐渐增加用药剂量,直至选择出对Gn最敏感的少数几个卵泡,再以维持剂量使之生长发育直至成熟。B组:递减方案是以较高的剂量启动一批卵泡的生长,然后通过逐渐减量降低Gn的水平,使得对药物最敏感的卵泡继续生长,不敏感的卵泡发生闭锁,而达到卵泡选择的目的。C组:Coasting方案使用Gn(75~225U)起始促排后,当卵泡直径≥11~12 mm,并根据卵泡的生长情况及激素水平的变化停药一段时间(约1~3 d),待血E2≤2 000 pg/ml,约1/3左右卵泡发生闭锁后,再次启动促排(或经多次Coasting后)直至卵泡成熟。D组:恒量方案,即促排过程中没有更改过用药剂量,直至卵泡成熟。
1.2.2 控制性超排卵(controlled ovarian hyperstimulation,COH)过程 所有患者均按照本研究各组中的不同的促排方案促排,当至少有3个主导卵泡直径达16 mm以上时,当晚肌注绒毛膜促性腺激素(chorionic gonadotrophin,HCG)5 000 ~10 000U(丽珠制药公司),34~36 h行阴道超声引导下的取卵术,IVF/ICSI受精后72 h行胚胎移植,且自取卵日开始给予黄体酮60~80 mg/d(浙江仙琚制药公司)肌注支持黄体功能。
1.2.3 妊娠结局的评定 胚胎移植16日测晨血清β-HCG,阳性者于移植后4周B型超声检查妊娠囊确定临床妊娠。
1.2.4 主要评价指标 记录患者行COH时的降调节剂量、降调天数、促排天数、Gn总量、总治疗天数、获卵数、胚胎数、移植胚胎数、可移植胚胎率、临床妊娠率、流产率、卵巢过度刺激综合征的发生率等。
1.2.5 统计学方法 所得数据采用SPSS 16.0软件包进行统计分析。计量资料采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况比较(表1) 四组间在年龄和不孕年限指标的比较上均差异无显著性(P>0.05)。C组FSH水平明显低于A组和B组,差异有统计学意义(P<0.05)。各组LH、E2和PRL水平比较差异无显著性(P>0.05)。A组、C组患者雄激素水平明显高于B、D两组,差异有统计学差异(P<0.05)。A组患者BMI水平高于 B、C两组,差异有显著性(P<0.05)。见表1。
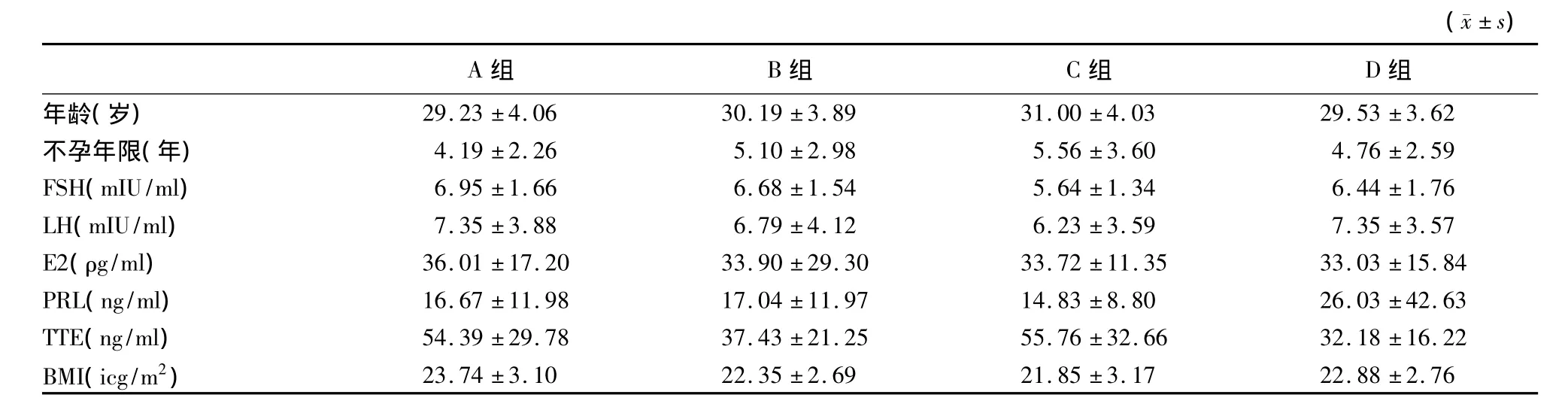
表1 各组患者一般情况
2.2 各促排方案用药和治疗时间比较(表2) 递减方案降调剂量小于递增方案及Coasting方案,Gn总量递增方案也明显高于其它三组,差异均有统计学意义(P<0.05)。见表2。A组、C组总治疗天数和促排天数均明显多于B、D两组。
2.3 各组获卵、胚胎及妊娠结局(表3) 各组间获卵情况比较差异无显著性;各组在胚胎数量,移植胚胎数及可移植胚胎率方面差异无显著性;四组间妊娠率比较:恒量方案>Coasting方案>递减方案>递增方案,但组间比较差异无统计学意义。

表2 各促排方案治疗剂量和时间比较
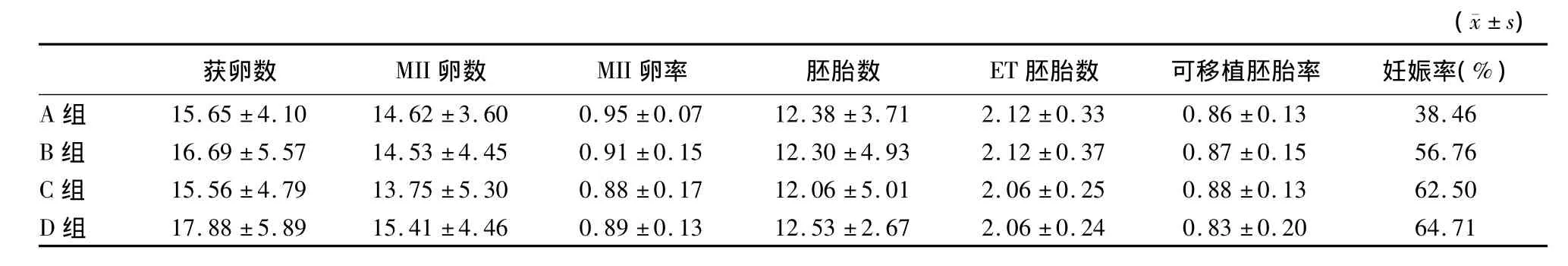
表3 各组获卵、胚胎及妊娠结局比较
2.4 各组间中重度OHSS的发生率比较 Coasting方案>递减方案>恒量方案>递增方案,见表4。
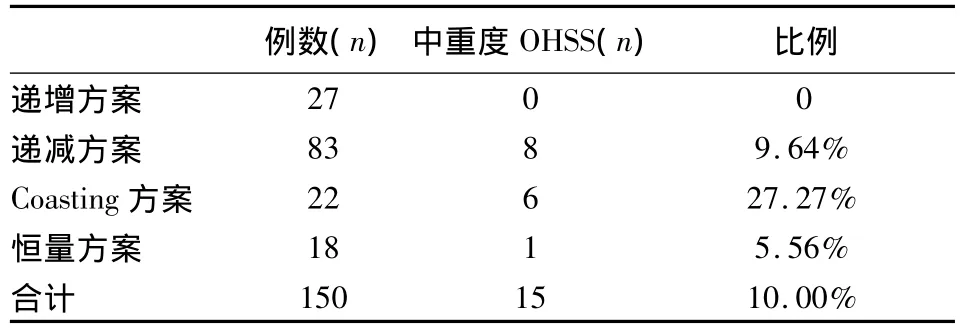
表4 各组中重度OHSS情况比较
3 讨论
随着辅助生殖技术的不断发展,PCOS患者特别是顽固性的PCOS不孕患者,大都需要通过IVFET的方式获得自己的后代,但是这类患者不同于一般行IVF-ET的患者,由于其对促性腺激素反应的阈值很窄,在临床上进行超促排卵过程中很容易造成大批卵泡的发育,从而导致卵巢过度刺激综合征(ovarian hyperstimulate syndrome,OHSS)的发生;并且由于体内较高的雌激素水平,高LH水平导致卵子质量和胚胎质量下降以及内膜容受性的降低,又或者因该类患者对超促排卵的药物反应不良致周期取消等,进而使周期取消率升高[8]。对PCOS患者的超促排卵一直是一个比较棘手的问题,因此寻找一个最佳的促排方案显得尤为重要。
本研究结果显示,递增方案组患者的BMI较之递减方案和Coasting方案组来说较大,一般来讲,BMI越大,GnRH-a降调节剂量和促排卵中所需Gn的量越大,我们的实验结果亦发现递增方案组Gn-RH-a降调节剂量和Gn用量都明显高于递减方案和Coasting方案两组。
递增方案与递减方案和恒量方案相比较促排时间较长,这可能与该方案由于评估不是十分准确,使该组患者起始促排剂量较小,与其他几组相比,在卵泡生长的前期发育较慢,进而使得总促排时间延长,而Coasting方案之所以治疗时间较之递减方案和恒量方案也有所延长,则是因为该组患者在卵泡起始阶段生长过快,当停止用药1~3 d后,再次启动促排,这一“休眠”过程使得促排总时间亦有所延长。此外从我们的研究中还可以发现Coasting方案组的妊娠率与其他组比较并没有下降,这与 Delvigen等[9]的研究相一致。
Delvigen认为Coasting疗法不影响卵子及胚胎的质量,Coasting疗法组与正常对照组的卵子质量和胚胎评分结果相似,Isazav等[10]报道75例需接受供卵行IVF-ET的患者,根据卵子的来源分为二组,其中38例患者接受的卵子来源于Coasting疗法捐赠者(研究组),37例患者接受的卵子来源于正常捐赠者(对照组),结果:二组患者有相似的成熟卵子数目和临床妊娠率(P>0.05),从而排除了Coasting疗法对卵子质量的影响。但研究结果也提示Coasting疗法持续时间的长短与临床治疗的效果相关,若Coasting持续时间较长(>4 d),则会降低卵子和胚胎的质量,进而降低临床妊娠率和种植率。
我们发现与恒量方案递增方案相比较在BMI等基本指标上并无明显差异,但恒量方案组Gn的用量却远远少于递增方案,且促排时间明显缩短,妊娠率却高于递增方案。这可能与我们对衡量方案组的病人的评估较为准确,在促排过程中患者激素水平的波动小,使得卵子的质量较好有关。
OHSS是超促排卵过程中常见的且较为严重的并发症之一,严重者会影响到胚胎移植甚至危及生命。目前有关OHSS的发病机制尚不明确,大部分学者认同促排过程中患者出现的高雌激素状态是引发OHSS的主要因素,而PCOS患者是OHSS发生的高危人群。文献报道,在促排卵治疗和IVF-ET过程中,OHSS 总体发生率为 23.3%[11]。本研究中OHSS的发生率约10%,递增方案组中发生OHSS的比率最低,其次是恒量方案组、递减方案组和Coasting方案组。Lee等报道:Coasting疗法后重度OHSS的发生率为20%(4/20),其原因可能与方法操作有关,这4例患者均为血清E2稍有下降,未降至正常范围时即开始hCG的注射[12]。另外还可能与起始剂量有关,起始剂量越大,即使在促排过程中减少用药量,其发生OHSS的可能性也相对较高,但还需更多的样本量来进一步加以证实。
PCOS患者早期流产发生率较高的观点已经得到大部分学者的认同,文献报道,PCOS患者行IVFET获得妊娠后的早期流产率高达20%~35%。但在研究中我们发现各组间相比较早期流产发生率没有显著性差异,且总的早期流产率为 10.96%(8/73),这可能因为我们所有患者治疗前,均予以二甲双胍和(或)达英-35和(或)去氧孕烯炔雌醇片等预处理,在一定程度上调整了PCOS患者的代谢紊乱状态,有效的预防了PCOS患者在获得妊娠后的早期流产[13]。
PCOS患者促排卵治疗的特点是卵巢募集增加,小卵泡过多,而促排卵方案最好是限制过多卵泡发育,减少药费支出,尽量获得单优势卵泡发育成熟发育,减少OHSS的发生。本研究结果表明对于PCOS患者,应该在促排前充分评估其卵巢功能,在一定的范围内适当的提高起始促排剂量,并不增加患者的经济负担和治疗时间,并能获得相对较好的治疗结局。在促排过程中严密监测卵泡的生长情况,尽量避免OHSS的发生。
[1]姚元庆.多囊卵巢综合征的内分泌变化及临床意义[J].中国实用妇科与产科杂志,2002,18(7):3-5.
[2]周庆娥,李艳萍,刘冬娥.多囊卵巢综合征超促排卵与宫腔内受精[J].中国现代医学杂志,2001,11(11):44-45.
[3]郭海燕,赵晓明,高敏芝.多囊卵巢综合征与相关基因多态性的研究进展[J].生殖与避孕,2009,29(5):319-323.
[4]Dumesic D A,Abbott D H.Polycystic ovary syndrome and its development origins[J].Rev Endocr Metab Disord,2007,8(2):127-141.
[5]Franks S,McCarthy M.Genetics of ovarian disorders:polycystic ovary syndrome[J].Rev Endocr Metab Disord,2004,5(1):69-76.
[6]Arredondo F,Noble L S.Endocrinology of recurrent pregnancy loss[J].Semin Reprod Med,2006,24(1):3-9.
[7]The RotterdaMESHRE/ASRM-sponsored PCOS Consenaus Workshop Group.Revised 2003 consensus on diagnostic criteria and long-terMhealth risks related to polycystic ovary syndrome(PCOS)[J].HuMReprod,2004,19(1)41-47.
[8]SIristatidis C S,Maheshwari A,Bhattacharya S.In vitro maturation in subfertile women with polycystic ovarian syndrome undergoing assisted reproduction[J].Cochrane Database Syst Rev,2009:CD006606.
[9]Delvigene A,Kostyla K,Murillo D,et al.Oocyte quality and IVF outcome after coasting to prevent ovarian hyperstimulation syndrome[J].Int J Fertil Womens Med,2003,48(1):25-31.
[10]Isaza V,Garcia-Velasco J A,Aragones M,et al.Oocyte and embryo quality after coasting:the experience froMoocyte donation[J].HuMReprod,2002,17(7):1777-1782.
[11]曹泽毅,主编.中华妇产科学[M].北京:人民卫生出版,2000:2000-2357.
[12]Lee C,Tummon I,Martin J,et al.Does withholding gonadotrophin administration prevent severe ovarian hyperstimulation syndrome[J].HuMReprod,1998,13(5):1157-1158.
[13]罗 璐,王 琼,周灿权,等.达英-25联合二甲双胍预治疗对多囊卵巢综合征患者早期流产的影响[J].生殖与避孕,2009,29(9):609-612.
