云母对NSAIDs相关性小肠黏膜损伤COX-2及HSP70表达的影响
2013-05-25史久煜浙江省宁波市鄞州人民医院消化科宁波315040
史久煜 浙江省宁波市鄞州人民医院消化科 宁波 315040
吕 宾 浙江中医药大学第一附属医院消化科
云母对NSAIDs相关性小肠黏膜损伤COX-2及HSP70表达的影响
史久煜 浙江省宁波市鄞州人民医院消化科 宁波 315040
吕 宾 浙江中医药大学第一附属医院消化科
目的:研究NSAIDs相关性小肠黏膜损伤COX-2及HSP70表达,探讨云母对小肠黏膜的保护机制。方法:24只SD大鼠,随机分为对照组、模型组、云母组,每组8只。模型组和云母组每天予双氯酚酸钠溶液7.8mg/(kg·d)剂量灌胃,制备大鼠NSAIDs相关性小肠黏膜损伤模型,云母组每天造模前予云母液120mg/(kg·d)剂量灌胃。灌胃给药5天后处死大鼠,进行大体形态观察,肠黏膜损伤指数(CMDI)及病理Chiu氏评分;免疫组化法检测小肠黏膜COX-2及HSP70表达。结果:与对照组比较,模型组CMDI、Chiu氏评分及COX-2、HSP70表达水平明显升高(P<0.01)。而云母组CMDI、Chiu氏评分及COX-2表达水平较模型组有明显下降(P<0.01),HSP70水平更进一步升高(P<0.01)。结论:NSAIDs相关性小肠黏膜损伤与COX-2及HSP70表达有关,云母可抑制损伤小肠黏膜COX-2表达,同时增强HSP70表达,从而对小肠黏膜起到保护作用。
大鼠 肠黏膜损伤 NSAIDs双氯酚酸钠 云母 COX-2 HSP70
非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)是一类具有抗炎、镇痛作用的药物,临床应用极为广泛,但在服用时可引起胃肠黏膜损伤。药用云母为白云母,主要成分为二氧化硅和氧化铝。《中华药海》[1]记载云母“截疟止痢、止血敛疮和温虚补肾”。《中国矿物药图鉴》[2]记录“主下痢肠癖,补肾冷”。文献[3]报道,云母具有选择性吸附作用和加强消化道黏膜屏障保护作用。本实验通过测定NSAID相关性小肠黏膜损伤COX-2及HSP70的表达,探讨云母的肠黏膜保护作用。
1 实验材料
1.1 动 物 雄性SPF级Wistar大鼠共24只,体质量280~300g,饲养于浙江中医药大学实验动物中心,实验动物使用许可证号:SYXK(浙)2008-011。
1.2 药物及试剂 双氯酚酸钠肠溶片(商品名:扶他林,国药准字H11021640,北京诺华制药有限公司生产),云母粉(产地河北,购于浙江中医药大学第一附属医院中药房)分别用0.9%生理盐水配置成0.78mg/ mL、12mg/mL浓度的均匀溶液,并参照成人口服常规剂量折算成大鼠灌胃用量。HSP70 RB-080PO、COX-2 RB-9072PO为兔来源的多克隆抗体(美国labvision Neomarkern公司产品),山羊抗兔IgG抗体-HRP多聚体(Lot:00001360),DAB显色液(DAKO,Lot:00029661)。
2 实验方法
2.1 大鼠肠黏膜损伤模型建立 24只大鼠完全随机分为对照组、模型组和云母组,每组8只,适应1周后开始实验。对照组予0.9%生理盐水1mL/(100g· d)剂量灌胃,后两组予双氯酚酸钠溶液7.8mg/(kg· d)剂量灌胃,制备小肠黏膜损伤模型,共5天。其中云母组在每次双氯酚酸钠溶液灌胃30min前,先予云母溶液按120mg/(kg·d)的剂量灌胃保护。
2.2 标本制备 灌胃5天结束后,禁食不禁水,于次日腹腔注射5%丙戊酸钠溶液麻醉大鼠,将其仰卧固定于手术台,沿腹部正中切开,分离小肠组织,沿肠系膜纵轴剪开,用冰生理盐水冲洗净,肉眼观察大体形态,取病变最明显处组织置于10%中性甲醛溶液固定,常规石蜡包埋、切片。
2.3 检测指标
2.3.1 一般情况和大体形态 观察大鼠在实验过程中有无死亡(死亡大鼠进行尸解查明原因),精神状态,活动情况,食欲,大便(有无血便、腹泻、大便次数增多等)和体质量改变等情况。取小肠黏膜组织肉眼观察大体形态并进行肠黏膜损伤指数(CMDI)评分,评分标准[4]:0分:无损伤;1分:轻度充血、水肿,表面光滑,无糜烂或溃疡;2分:充血水肿,黏膜粗糙呈颗粒状,有糜烂或肠黏连;3分:高度充血水肿,黏膜表面有坏死及溃疡形成,溃疡最大纵径<1.0cm,肠壁增厚或表面有坏死及炎症;4分:在3分基础上溃疡最大纵径>1.0cm,或全肠壁坏死。
2.3.2 病理组织学检测 取病变较明显的小肠黏膜包埋切片,HE染色,镜下评价病变黏膜,并进行Chiu氏[5]法评分:0分:正常;1分:绒毛顶端上皮下间隙增宽;2分:绒毛顶端上皮下间隙进一步扩大,绒毛尖端上皮抬高与固有膜剥离;3分:绒毛上皮成块脱落;4分:上皮完全脱落,仅有固有膜;5分:固有膜层崩裂,出现出血与溃疡。
2.3.3 COX-2及HSP70表达测定 操作步骤:石蜡切片,二甲苯脱蜡、无水乙醇、95%、80%、70%乙醇至水化;蒸馏水洗;抗原修复:COX-2、HSP70采用高温高压修复(0.01M柠檬酸缓冲溶液,pH:6.0),时间为100s;馏水洗,PBS 5min×3次;3%H2O2阻断内源性过氧化物酶10min;PBS洗5min×3次;滴加适当比例稀释的一抗,4℃过夜。(COX-2 RB-9072PO工作浓度1:75;HSP70 RB-080PO工作浓度1:50,均为兔来源的多克隆抗体,用PBS代替一抗为实验空白对照);PBS冲洗,5min×3次;滴加山羊抗兔IgG抗体-HRP多聚体(Lot:00001360),37℃孵育40min;PBS冲洗,5min×3次;DAB显色液(DAKO,Lot:00029661)显色1~3min,显微镜下控制反应,自来水冲洗终止反应;Harris苏木素液复染细胞核1min,95%、100%乙醇脱水,二甲苯透明,中性树胶封片。高倍显微镜(10×20)下观察,计分标准:①阳性染色细胞数占视野细胞总数的多少计分为A:无阳性染色细胞为0分;阳性细胞百分数<25%为1分;25%~50%为2分;>50%为3分。②按着色细胞染色强度计分为B:细胞呈阴性染色为0分;染色弱,阳性细胞呈淡黄色为1分;染色中等,阳性细胞呈棕黄色为2分;染色强,阳性细胞呈棕褐色为3分。以A+B值作为判断结果,进行统计分析。
2.4 统计学方法 使用SPSS16.0软件处理数据,采用秩和检验,以P<0.05为差异有统计学意义。
3 实验结果
3.1 一般情况和大体形态观察 实验期间对照组大鼠一般情况良好,体质量无减轻,无腹泻、血便,无死亡,精神、活动正常,解剖示肠黏膜正常,无充血水肿糜烂等。模型组大鼠于灌胃第1、2天出现惊恐,烦躁不安等症状;第3天开始大鼠精神极度萎靡,活动减少,食欲明显减退,毛发杂乱,大便变稀,体质量减轻10~20g不等,至灌胃第4、5天,陆续有大鼠死亡,分别死亡2只和3只,尸检显示小肠黏膜多处重度糜烂坏死及肠穿孔粘连,考虑肠穿孔死亡。余存活模型组大鼠解剖示小肠黏膜明显充血水肿、糜烂,但未见肠穿孔。云母组大鼠精神状况较正常组稍差,活动,食欲一般,大便正常,体质量未见明显变化,实验期间无大鼠死亡。解剖示小肠黏膜较完好,仅见轻度充血水肿。三组大鼠胃黏膜大体形态均未见充血水肿糜烂等损伤。各组大鼠小肠黏膜损伤指数(CMDI)评分比较,模型组CMDI评分较对照组明显升高(P<0.01),云母组大鼠CMDI评分均较模型组有明显下降(P<0.01)。见表1。
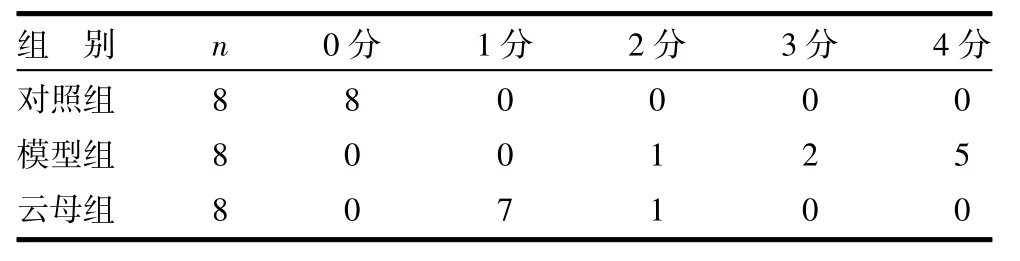
表1 各组大鼠小肠黏膜损伤指数评分比较 只
3.2 病理观察 高倍镜(10×20)下观察所有大鼠胃黏膜未见明显病理变化。对照组大鼠小肠黏膜正常,无充血水肿糜烂等;模型组大鼠小肠黏膜上皮细胞层部分变性坏死、脱落,充血糜烂,炎症细胞浸润;云母组大鼠小肠黏膜较完好,轻度充血水肿。各组大鼠小肠黏膜病理Chiu氏评分比较,其中模型组小肠黏膜病理Chiu评分较对照组明显升高(P<0.01),云母组小肠黏膜病理Chiu评分较模型组明显降低(P<0.01)。见表2。
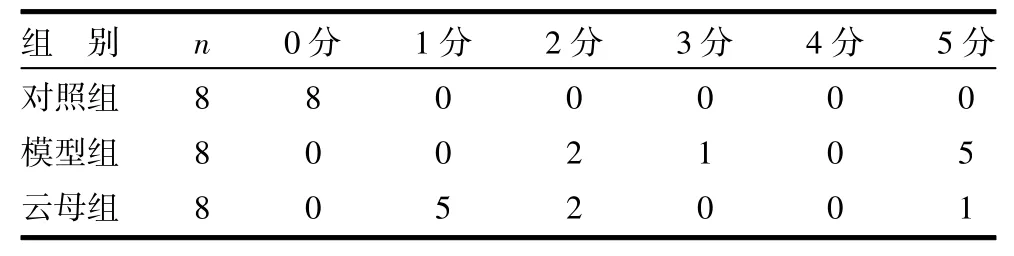
表2 各组大鼠小肠黏膜病理Chiu氏评分比较 只
3.3 云母对COX-2表达的影响 显微镜下观察阴性细胞核呈蓝色,阳性为黄色或黄棕色。其中COX-2主要以在肠组织的上皮细胞胞浆内表达为主,但固有层内的炎症细胞也有少量表达,HSP70的表达主要在肠组织的上皮细胞和固有层内的炎症细胞,阳性定位于细胞浆或胞核内。与对照组比较,模型组COX-2表达水平明显增强(P<0.01),云母组COX-2表达水平较模型组明显下降(P<0.01)。见表3、图1(插页)。
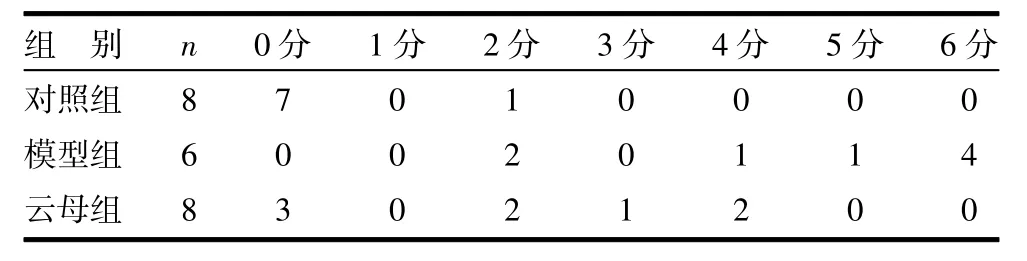
表3 各组大鼠小肠黏膜组织COX-2表达比较 只
3.4 云母对HSP70表达的影响 造模后大鼠小肠黏膜HSP70表达较对照组明显增强(P<0.01),而云母组小肠黏膜HSP70表达进一步增强(P<0.01)。见表4、图2(插页)。
4 讨论
由于检查手段的限制,以往对NSAIDs引起的小肠黏膜损害了解较少。随着胶囊内镜(VCE)和双气囊小肠镜(DBE)的不断普及,人们发现,小肠较胃十二指肠更易受到NSAIDs的损害。Graham等[6]对慢性NSAIDs服用者行胶囊内镜(VCE)检查发现有高达71%的患者发生了小肠损伤。本实验发现经双氯酚酸钠溶液造模后的大鼠胃黏膜未见损伤,而小肠黏膜损伤明显。

表4 各组大鼠小肠黏膜组织HSP70表达比较 只
COX-2在大多数细胞中低水平表达,甚至无法检测到,但在许多病理情况下能急剧增加,被认为是一种可诱导酶,其产生跟炎症和癌症等有关。通过环氧合酶(COX)合成多种前列腺素和白三烯等炎症介质,产生红、肿、热、痛、充血、水肿、炎症细胞浸润等炎症表现,影响肠管液体的转运、肠管活动、调节免疫,使炎症反应放大或持久化[7]。在鼠和人的病变肠黏膜中均发现COX-2表达异常,尤其在溃疡边缘明显增多[8-9]。Hendel等[10]在结肠炎患者中发现,肠上皮细胞的COX-2上调,并且活动期患者明显高于非活动期患者。目前认为,COX-2主要参与病理过程,病理状态下,炎症处COX-2表达急剧增加,尤其是在急性炎症反应中起主要作用。但也有研究认为,COX-2并非有理论上的严格界限,可能对维持黏膜完整性也发挥了作用。Reuter等[11]在鼠实验性结肠炎组织中发现COX-2水平增加及前列腺素合成增多,同时还发现经选择性COX-2抑制剂处理的动物肠黏膜病变加重,甚至发生穿孔或死亡。本实验发现双氯酚酸钠溶液灌胃后的大鼠肠黏膜COX-2水平较对照组明显增高(P<0.01),死亡率极高(5/8),而经云母治疗后肠黏膜损伤情况明显好转,COX-2表达明显下降(P<0.01),且无1例发生死亡,提示COX-2与肠黏膜损伤程度相关。据此认为COX-2在肠黏膜损伤的作用机制中主要参与诱导炎症反应,从而导致肠黏膜的病理损害,而云母可抑制其表达,减轻炎症反应,增强肠黏膜保护作用。
热休克蛋白(heat shock proteins,HSPs)是生物体(或离体、培养细胞)在不良环境因素作用下所产生的一组具有高度保守性的应激蛋白,它普遍存在于整个生物界,几乎所有的细胞均能合成。正常情况下,HSP70表达很低,在病理状态下表达会增强,起自我防御作用。研究表明,哺乳动物细胞HSP70的表达主要受转录水平的调控,在非应激条件下HSF(热应激转录因子)是以单体形式存在,应激后HSF单体的空间构象发生改变,暴露出疏水重复序列,使HSF单体聚集成具有DNA结合能力的三聚体。在应激状态下,HSF与变性蛋白竞争结合HSP70,当变性蛋白增多时,游离的HSF也增加,从而诱导HSP70的合成,直至HSP70的含量足够结合HSF,使HSF处于抑制状态。HSP70作为HSP家族中最保守最主要的一组蛋白质,在保护肠黏膜上皮细胞方面具有重要的作用[12-14]。Galois等[15]采用基因转染方法,使巨噬细胞过度表达HSP70,然后应用内毒素分别刺激转染和未转染的细胞,结果发现HSP70能明显抑制iNOS、TNF-α等细胞因子的释放,减轻炎症反应,从而起到保护细胞的作用。Jayakumar等[16]报道肠黏膜屏障损伤引起内毒素血症时,HSP基因缺乏的鼠死亡率及血促炎细胞因子水平明显高于正常鼠。本实验发现云母也能促进肠黏膜HSP70的表达,增强肠黏膜保护作用。有关HSP70的研究已成为分子生物学的热点之一,且逐渐为治疗提供了新途径[17]。总之,HSP70的细胞保护作用现已经得到多数实验的支持,因而在保护肠黏膜的治疗中诱导细胞HSP70的表达是值得期待的方向。
综上所述,云母能抑制损伤小肠黏膜COX-2的表达,同时增强HSP70的表达,从而促进肠黏膜的愈合,这可能是云母保护肠黏膜屏障的重要机制之一。
[1]杨松年.中国矿物药图鉴[M].上海:上海科学技术文献出版社,1995.
[2]冉先德.中华药海[M].哈尔滨:哈尔滨出版社,1993:261.
[3]管俊芳,陆琦,周湖云,等.天然矿物材料在医药产业中的应用及开发[J].矿产与地质,2002,16(1):34.
[4]Millar AD Rampton DS,Chander CL,et al.Evaluating the antioxidant potential of new treatments for inflammatory bowel disease using a rat model of colits[J].Gut,1996,39(3):407-415.
[5]Chiu CJ,Scott HJ,Gurd FN,et al.Intestinal mucosal lesion in low-flow states[J].Arch Surg,1970,101(4):484-488.
[6]Graham DY,Opekun AR,Willingham FF,et al.Visible smallintestinal mucosal injury in chronic NSAID users[J].Clin Gastroenterol Hepatol,2005,3(1):55-59.
[7]Dong WG,Lu SP,Yu BP,et al.Ameliorative effects of sodium ferulate on experimental colitis and their mechanisms in rats[J].World J Gastroenterol,2003,9(11):2533-2538.
[8]Kargman S,Charleson S,Cartwright M,et al.Characterization of prostaglandin G/H synthase 1 and 2 in rat,dog,monkey,and human gastrointestinal tracts[J].Gastroenterology,1996,111(2):445-454.
[9]Mahida YR,Beltinger J,Makh S,et al.Adult human colonic subep-Ithelialmyofibroblastsexpressextracellular matrix protein and cyclooxygenase-1 and-2[J].Am J Physiol,1997,273(6):G1341-G1348.
[10]Hendel J,Nielsen OH.Expression of cyclooxygenase-2 mRNA in active inflammatory bowel disease[J].Am J Gastroenterol,1997,92(7):1170-1173.
[11]Reuter BK,Asfaha S,Buret A et al.Exacerbation of inflammation associated colonic injury in rat through inhibition of cyclooxygenase-2[J].JClin Invest,1996,89(9):2076-2085.
[12]Ropeleski MJ,Tang J,Walsh-Reitz MM,et al.Interleukin-11-induced heat shock protein 25 confers intestinal epithelial-specific cytoprotection from oxidant stress[J].Gastroenterology,2003,124(5):1358-1368.
[13]Kojima K,Musch MW,Ropeleski MJ,et al.Escherichia coli LPS induces heat shock protein 25 inintestinal epithelial cells through MAP kinase activation[J].Am J Physiol Gastrointest Liver Physiol,2004,286(4):G645-G652.
[14]Ohkawara T,Nishihira J,Takeda H,et al.Protective effect of geranylgeranylacetone.on trlnitrobenzene sulfonic acidinduced colitis in mice[J].Int J Mol Med,2006,17(2):229-234.
[15]Galois SL,Etienn ES,Grossi NL,et al.Dose-response relationship for exercise on severity of experimental osteoarthritis in rats:a pilot study[J].Osteoarthritis Cartilage,2004,12(10):779-786.
[16]Jayakumar J,Suauki K,Sammut IA,et al.Heat shock protein 70 gene transfection protects mitochondrial and ventricular fucnction against ischemia-reperfusion injury[J]. Circ-Res,2004,95(4):433-440.
[17]Westerheide SD.Morimoto RI.Heat shock response modulators as therapeutic tools for diseases of protein conformation[J].Journal of Biology Chemistry,2005,280(39):33097-33100.
Effects of Mica on COX-2 and HSP70 of NSAIDs-induced small intestinal damage
SHI jiuyu,LV bin.Yinzhou People's Hospital,Ningbo(315040),China
Objective:To study the effect of mica on the expression of COX-2 and HSP70 in non-steroidal anti-inflammatory drugs(NSAIDs)-induced small intestinal damage and to approach the protective mechanism of mica.Methods:Twenty-four rats were randomly divided into control group,model group,and mica group,8 rats in each group.With the exception of rats in control group,all rats were intragastrically administered with diclofenac sodium(7.8 mg/kg)for 5 days to establish the model of NSAIDs-induced small intestinal damage.The rat in mica group were given daily intragastric administration of mica(120mg/kg)before administration of diclofenac sodium.All rats were killed on day 5.At that time,the colonic mucosal damage index(CMDI)and Chiu score were evaluated and the expression of COX-2 and HSP70 were measured by biochemical and immunohistochemical methods.Results:Compared with control group,the rat in model group had significantly increased CMDI,Chiu score,and COX-2 and HSP70(P<0.01).Mica treatment resulted in significantly decreased CMDI,Chiu,and COX-2,but more activities of HSP70 in comparison with model group(P<0.01).Conclusion:NSAIDs-induced small intestinal damage was related to the expression of COX-2 and HSP70,and mica may offer protective effects against the damage by decreasing the expression of COX-2 and increasing the expression of HSP70.
rats intestinal damage NSAIDs diclofenac sodium mica COX-2 HSP70
2013-08-01
吕宾,E-mail:Lvbin@medmail.com.cn
