糖尿病血糖波动模型致大鼠海马体的炎性损伤
2013-05-22蔡月琴李守业徐志伟寿旗扬李昌煜
王 辉,蔡月琴,李守业,徐志伟,刘 琼,寿旗扬,李昌煜
(1.浙江中医药大学,杭州 310053;2.浙江医学高等专科学校,杭州 310053)
糖尿病(diabetes mellitus,DM)是由各种致病因子作用于机体导致胰岛功能减退或胰岛素抵抗等继而引发的一系列代谢紊乱综合征。近年来,糖尿病中枢神经系统(CNS)并发症引起了人们的关注,表现为海马区的神经炎性反应和神经元损伤,造 成 认 知 功 能 障 碍[1,2]。 海 马 区 又 名 海 马 体(hippocampus),分别位于左右脑半球,是学习、记忆以及空间定位的重要解剖基础和神经中枢。长期高血糖是导致糖尿病慢性并发症的重要危险因素,但糖尿病慢性并发症的发生和发展不仅与血糖升高有关,更与血糖波动幅度增大密切相关。血糖波动性越大慢性并发症的发生率越高,预后越差[3,4]。体外实验证实,细胞外葡萄糖浓度的上下波动比持续高糖浓度对细胞的危害更大[5]。且血糖波动可加重对大鼠海马区神经元的凋亡[6]。
本研究采用链脲佐菌素(STZ)30 mg/kg制备SD大鼠糖尿病模型和持续高血糖模型,并错时腹腔注射给予葡萄糖0.375 g/kg和皮下注射胰岛素1 U制备糖尿病血糖波动大鼠模型。通过对大鼠的一般生理学和血液生化指标检测,验证各组模型;同时检测大鼠海马体中 IL-1β、IL-2、IL-6、IL-8、TNF-α等炎性因子mRNA的表达及其对学习、空间记忆功能的影响,综合评价糖尿病血糖波动模型大鼠海马体的炎性损伤程度,揭示血糖波动对中枢神经系统的影响。
1 材料和方法
1.1 实验动物及饲养条件
6~8周龄雄性 SPF级SD大鼠60只,体重160~180 g,由上海西普尔必凯实验动物有限公司提供[SCXK(沪)2008-0016]。温度(20 ±2)℃,相对湿度50% ~60%,光照12 h明暗交替,饲养于浙江中医药大学动物实验研究中心[SYXK(浙)2008-0115]。
1.2 实验试剂与仪器
1.2.1 实验试剂:超短效胰岛素诺和锐(YP50503,丹麦诺和锐);链脲佐菌素 (20110703-3,Sigma进口分装);血糖试纸(451289,德国罗氏);RNAiso plus、RT-PCR反转录试剂盒和SYBR green荧光定量试剂均购自 TaKaRa公司;高脂饲料:蔗糖 10%、蛋黄10%、猪油10%、胆固醇0.5%、基础饲料69.5%,由江苏省协同医药生物工程有限公司提供。
1.2.2 实 验 仪 器:荧 光 定 量 PCR 仪 (Bio-Rad,IQ5),生物安全柜(Thermo),微量核酸测定仪(Thermo,Nano-drop),定 性 PCR 仪 (Bio-Rad,PTC200),全自动生化分析仪(Hitachi,7020)
1.3 动物实验
1.3.1 糖尿病动物制备与筛选:雄性大鼠60只适应性饲养1周,将其随机分为正常对照组(N)15只和造模组(M)45只,普通饲料饲养6周,所有大鼠自由饮食、饮水。6周后,所有大鼠禁食不禁水16 h,造模组按30 mg/kg体重尾静脉注射浓度1%的STZ,正常对照组注射等量柠檬酸缓冲液。造模1周后,禁食不禁水16 h,测空腹血糖,挑选血糖值 15.0 mmol/L~20.0 mmol/L的成模大鼠。
1.3.2 血糖波动模型制作:将成模大鼠随机分为3组:糖尿病模型组(M)、血糖波动组(MF)15只、持续高血糖(MS)组,每组各10只。以高脂饲料喂养(蔗糖10%、蛋黄10%、猪油10%、胆固醇0.5%、基础饲料69.5%)。正常对照组(N)、糖尿病模型组(M):给予腹腔注射生理盐水0.375 g/kg.d体重作为对照,并于注射后30 min测量血糖,连续6周。糖尿病持续高糖组(MS):定时给予腹腔注射250 g/L葡萄糖溶液 0.375 g/kg.d体重,造成 1 d中血糖值高于正常血糖值的波动模型,使其血糖值在正常血糖和高血糖间漂移,注射后30 min测血糖,连续6周。糖尿病血糖波动组(MF):定时给予腹腔注射250 g/L 葡萄糖溶液0.375 g/kg.d体重,错时30 min后给予腹腔注射超短效胰岛素类似物诺和锐,造成1 d中血糖值大幅度波动模型,使其血糖值在高血糖和低血糖间反复漂移,注射后30 min测血糖,连续6周。
1.4 指标观察及标本收集
1.4.1 体重测定:每周测定一次大鼠体重。
1.4.2 生化指标:用全自动生化检测仪测定大鼠血清 Glu、TG、LDL-C 和 HDL-C。
1.4.3 海马组织 IL-1β、IL-2、IL-6、IL-8、TNF-α 的mRNA检测:海马组织剥离:将各组大鼠给予10%水合氯醛腹腔注射麻醉后,快速断头取出脑组织,去掉小脑,沿两侧大脑半球连接处将大脑半球切开,剥离出海马,漂洗去血,立即冻于液氮中[7]。
总RNA提取:取海马组织提取总RNA,操作按照RNAiso Plus(Total RNA提取试剂)说明书进行。实验过程所用 RNase free枪头、1.5 mL RNase free离心管购自美国Axygen公司。
RNA逆转录为cDNA:将已提取的总RNA反转录为cDNA,反应操作在冰上进行。按照逆转录试剂盒PrimeScriptTM RT reagent说明书配置RT反应液,将反转录反应体系加到无RNase的PCR管内,反转录反应条件:37℃ 15 min,85℃ 5 s。反应结束后,将cDNA保存于-20℃冰箱备用。
Real time RT-PCR:将 cDNA用实时荧光定量PCR仪进行扩增,反应操作在冰上进行,按照荧光定量试剂盒SYBR Premix Ex TaqTMII(Perfect Real Time)说明书配置扩增液,并设置阴性对照。大鼠IL-6、TNF-a、IL-8、IL-1β 和 IL-2 荧光定量 PCR 引物序列由生工®生物工程(上海)有限公司设计并合成,各引物序列如下:
将反转录反应体系加到用于荧光定量反应的8联管内,扩增反应条件如下:
预变性:95℃ 3 min;48个循环(95℃ 10 s,60℃30 s);溶解曲线:从55℃开始,每 30 s升高 0.5℃,直到95℃,循环1次。
所有反应信息资料由 Bio-Rad iQ5 PCR仪收集,Ct值通过计算机软件来测量和计算,转录水平通过公式 2-△△CT计算。
1.4.4 行为学检测(Morris水迷宫):在血糖波动模型建立后第6周进行水迷宫实验,每只动物每天训练2次,共训练5 d。(1)定位航行实验:用于检测大鼠的空间定位和记忆能力,第1天上、下午各训练1次,入池位置为站台所对象限及所邻象限,于象限边1/2弧度处头朝池壁入水。120 s内未找到站台者,将其引至站台,放置30 s,引导其学习与记忆。第2~5天重复上述操作,若120 s内仍不能找到站台,则以120 s计算,不再进行引导。从第2天开始,记录找到平台所用时间(逃避潜伏期)。(2)空间探索实验:在第5天进行,撤除平台,将大鼠从定位航行实验的象限边 1/2弧度处头朝池壁入水,记录大鼠60 s内在无平台水迷宫中穿越平台所在位置的次数和在平台所在象限游泳距离。此测试可用于检测大鼠对平台位置的记忆。

表1 实时荧光定量PCR引物序列Tab.1 Primer sequence used in the real time quantitative polymerase chain reaction
1.5 统计学处理
2 结果
2.1 大鼠一般状况和体重变化
N组和大鼠精神状态良好、毛色光亮、摄食摄水量正常、自主活动无异常;MF和M组MS组大鼠出现典型的糖尿病“三多一少”(多食、多饮、多尿、消瘦)症状,竖毛无光,蜷缩拱背。表2结果显示,实验前各组大鼠体质量无显著性差异(P>0.05);血糖波动造模第6周时,M组、MS组及MF组大鼠体质量显著低于 N组(P<0.01),M 组、MS组及 MF组之间在1%极显著水平下无差异(P>0.01)。
2.2 大鼠造模后血液生化指标变化
表3结果显示,尾静脉注射 STZ 1周后,M组、MS组、MF组的 Glu、TG、LDL-C 都有显著性的提高(P <0.01),HDL-C 显著性下降(P <0.01)。其中,M组、MS组、MF组之间各指标差异都无显著性(P>0.05),提示不同糖尿病模型之间的一致性和可比性。模型各组血糖值在 15.0 mmol/L~20.0 mmol/L之间,证明大鼠糖尿2型病模型建立成功。
2.3 大鼠海马组织中细胞炎性因子mRNA的表达
图1、2结果显示,与正常组比较,各模型组海马组织的 IL-1β、IL-6、IL-8 以及 TNF-α 均呈现显著性变化(所有 P<0.05),组间 IL-2水平差异则无显著性(P>0.05)。其中,血糖波动模型 MF组 IL-1β 水平的变化最大,达到极显著水平(P<0.01),亦显著高于M组和 MS组水平(P<0.01);M组、MS组中IL-6水平相比正常 N组有显著升高(P<0.01),MF组虽有升高,但未呈显著性变化(P>0.05);各模型组IL-8水平比N组均有显著提高(P<0.05);TNF-α水平在血糖波动模型MF组中上升最多,呈极显著变化(P<0.01),该水平显著高于 M组和MS组(P<0.01)。尽管 IL-2水平在各组间无统计学上的显著差异,仍可见血糖波动模型MF组中表达水平最低。各指标相关生理学意义将在讨论部分具体论述。
表2 各组大鼠体质量变化情况(±s,n=10)Tab.2 Variation of body weight in the rats groups(±s,n=10)
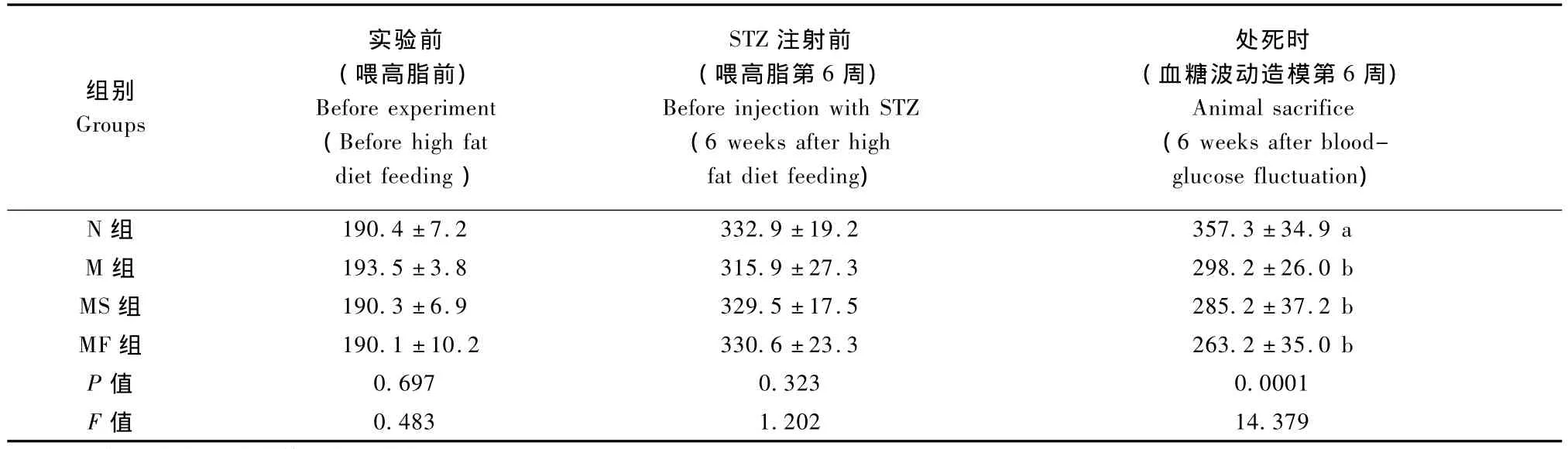
表2 各组大鼠体质量变化情况(±s,n=10)Tab.2 Variation of body weight in the rats groups(±s,n=10)
注:不同字母代表统计学差异有显著性:P<0.01Note:Different letters represent significant difference,P <0.01.
组别Groups处死时(血糖波动造模第6周)Animal sacrifice(6 weeks after bloodglucose fluctuation)N 组 190.4 ±7.2 332.9 ± 19.2 357.3 ±34.9 a M 组 193.5 ±3.8 315.9 ± 27.3 298.2 ±26.0 b MS 组 190.3 ±6.9 329.5 ± 17.5 285.2 ±37.2 b MF 组 190.1 ±10.2 330.6 ± 23.3 263.2 ±35.0 b P 值 0.697 0.323 0.0001 F值实验前(喂高脂前)Before experiment(Before high fat diet feeding)STZ注射前(喂高脂第6周)Before injection with STZ(6 weeks after high fat diet feeding)0.483 1.202 14.379

表3 注射STZ后大鼠血液生化指标Tab.3 Blood biochemical indexes of the rats after injection of streptozoticin
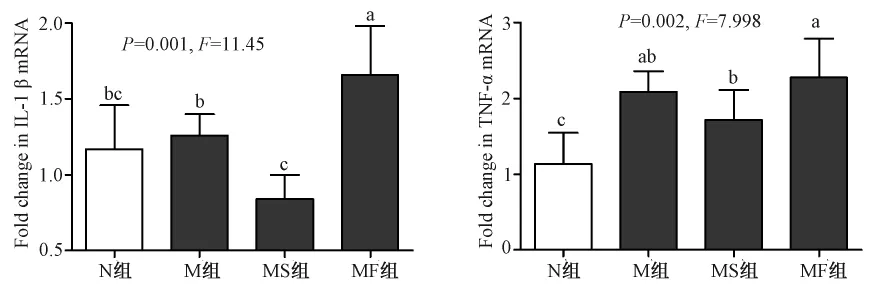
注:不同字母代表统计学有显著性差异:P<0.05,P<0.01。图1 各组大鼠海马体中炎性因子IL-1β、TNF-α的mRNA表达水平(n=10)Note:Different letters represent significant difference,P <0.05,P <0.01.Fig.1 mRNA expression of inflammatory factors IL-1β and TNF-α in the rat hippocampus of each group(n=10)
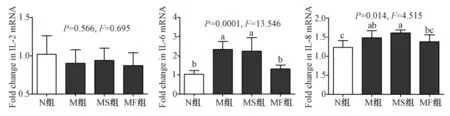
注:不同字母代表统计学有显著性差异:P<0.05,P<0.01。图2 各组大鼠海马体中炎性因子 IL-2、IL-6和IL-8的mRNA表达水平(n=10)Note:Different letters represent significant difference,P <0.05,P <0.01.Fig.2 mRNA expression of inflammatory factors IL-2,IL-6 and IL-8 in the rat hippocampus of each group(n=10)
2.4 大鼠海马体功能的变化
通过Morris水迷宫实验对各组大鼠空间定位和记忆功能的变化进行检测。如图3显示,M组、MS组、MF组的逃避潜伏期、经过平台的次数以及在平台象限内的游泳距离与N组相比均呈极显著提高(所有P<0.01)。其中血糖波动模型MF组的逃避潜伏期和过平台次数显著高于M组和MS组(P<0.01),提示 MF组空间定位和记忆功能受损最严重。平台象限内的游泳距离在三种糖尿病模型组间差异无显著性(P>0.05)。

注:不同字母代表统计学差异有显著性:P<0.01。图3 各组大鼠逃避潜伏期时间和空间探索经过平台位置次数及在平台象限游泳的距离(±s,n=10)Note:Different letters represent significant difference,P <0.01.Fig.3 The escape latency,number of rats passing hidden platform and the swimming distance in the quadrant of hidden platform of the rats in various groups(±s,n=10)
3 讨论
高血糖对糖尿病患者血管的病理损害主要有两种方式,即慢性持续性高血糖与波动性高血糖[8,9]。研究表明血糖波动幅度越大,糖尿病慢性并发症的发生率越高、预后越差[4]。Eric等研究也认为,相对于空腹血糖来说餐后血糖的急性波动更能预测动脉粥样硬化的发生、发展[10]。目前关于糖尿病血糖波动动物模型的研究较少,本实验模拟临床实际情况,设计出餐后高血糖并注射胰岛素诱导大鼠血糖波动。
本实验先对SD大鼠尾静脉注射30 mg/kg STZ诱导2型糖尿病模型,实验结果显示M组、MS组、MF组的血糖值、总胆固醇及低密度脂蛋白都有显著性提高,而高密度脂蛋白显著性下降。同时对各组模型大鼠进行生理学和行为学观察,未见明显酸中毒或脱水症状。表明2型糖尿病大鼠模型建立成功,伴有脂代谢异常。再通过每天2次错时注射葡萄糖和胰岛素造成大鼠血糖剧烈波动建立糖尿病血糖波动模型。该模型的血糖值均在血糖仪可测范围,具有重复性高,操作简便等优势。然而与正常组大鼠相比,各模型组大鼠的海马组织经HE染色,病理学特征上差异无显著性,这可能与本实验造模时间较短有关。
祖国医学将糖尿病归属“消渴”范畴。其发病与体质、嗜食肥甘、外感邪毒、劳欲过度、情志内伤有关,造成阴精亏损、瘀毒内生。近期研究表明,糖尿病是一种先天性免疫和慢性炎症反应性疾病,是由于高血糖、脂代谢异常等对血管刺激引起体内炎症因子的大量产生。其炎症反应可归属于中医的内生瘀毒。本实验表明,各糖尿病模型大鼠海马组织均产生了不同程度的炎性反应,炎性因子 IL-1β、TNF-α、IL-6、IL-8 等 mRNA 水平显著改变,将引起海马体的炎性损伤。IL-1β和TNF-α作为两种重要的细胞因子,在中枢神经系统由星形胶质细胞和小胶质细胞及神经元产生,参与神经-免疫-内分泌网络的调控[11]。其中,IL-1β 过表达可激活 HPA 轴导致下丘脑分泌促肾上腺皮质激素释放因子 CRF,后者通过增加神经兴奋性而造成海马区缺血损伤;大量分泌的IL-1β具有可以通过多个环节介导神经毒性作用,导致脑损伤与神经元死亡,包括诱导黏附分子的表达、诱导白细胞的浸润、促进NOS的合成、诱导氨基酸和自由基的产生、以及启动多种细胞因子级联反应[12];IL-1β能引起神经胶质细胞神经元网络结构和功能的损伤,从而导致内侧颞叶癫痫[13,14];IL-1β 还能提高 N-甲基-天门冬氨酸受 体(NMDAR)的活性和NR1(NMDAR1亚基)mRNA的表达,或增加细胞内Ca2+浓度而激活Ca2+依赖蛋白酶,促进兴奋性脑损伤[15]。TNF-α在神经炎性反应和脑损伤中也起到重要作用,能通过改变血脑屏障完整性,使血源性免疫细胞因子进入脑脊液激活小胶质细胞,从而释放更多的炎性因子加重炎性损伤[16];进一步能通过抑制前列腺素合成促使星形胶质细胞释放谷氨酸,同时抑制星形胶质细胞对谷氨酸的再摄取,加重谷氨酸介导的兴奋毒性[17];还可作用于神经元导致Caspase的激活,引起神经元凋亡。本实验中,血糖波动模型MF组IL-1β和TNF-α的mRNA相较其他组表达量最高,具有统计学意义(图1),提示血糖波动能造成更严重的海马体炎性损伤。有研究表明,海马体内炎性细胞因子尤其是IL-1β和TNF-α表达增多会引起进行性认知功能损害,与海马内神经突触功能及与认知功能有关的神经递质受损有关[18,19]。据此,本研究应用 Morris水迷宫对产生海马体炎性反应的不同糖尿病模型组大鼠进行检测,结果发现炎性反应最严重的血糖波动模型MF组的空间定位和记忆功能受损最严重(图3),进一步说明 IL-1β 和 TNF-α 等细胞因子在血糖波动的情况下将造成更严重的海马体功能损伤。此外,IL-6和IL-8的异常表达也是介导海马体炎性损伤以及空间记忆功能受损的重要因素,而本实验中血糖波动模型并未比其他糖尿病模型引起该细胞因子的更高表达,说明血糖波动通过IL-6和IL-8引起的炎性损伤与普通糖尿病以及持续高糖模型的效果相接近。IL-2在各糖尿病模型组中未见显著异常表达,提示该细胞因子未参与相关炎性损伤过程。
上述实验证明,相较急性高血糖和慢性持续性高血糖而言,波动性高血糖对大脑海马体造成的炎性损伤更为严重,可能引起癫痫、痴呆等神经退行性并发症。因此,临床应重视并优化糖尿病患者的长期治疗方案,避免波动性高血糖的发生,提高糖尿病患者的生活质量和生存周期。
[1]Sunil KK,Lalit KM,Sruti J,et al.Neuropsychiatric screening in type 2 diabetes mellitus[J].Indian J Endocrinol Metab,2012,16(Suppl1):S37-S40.
[2]Insa F,Naveed S,Paul W,et al.Association of N-terminal probrain natriuretic peptide with cognitive function and depression in elderly people with type 2 diabetes[J].PLoS One,2012,7(9):e44569.
[3]Rondi MK,Rachel MH,Brad DB,et al.Increasing blood glucose variability heralds hypoglycemia in the critically ill[J].J Surg Res,2011,170(2):257 -264.
[4]Klonoff DC.Continuous glucose monitoring:roadmap for 21st century diabetes therapy[J].Diabetes Care,2005,28:1231 -1239.
[5]Kaznowska-Bystryk I,Gorynska A,Solski J.Evaluation of metabolic control in patients with type 2 diabetes[J].Wiad Lek,2011,64(3):170-175.
[6]李伟,孙娟,殷松楼,等.血糖波动对糖尿病大鼠海马神经元凋亡相关蛋白表达的影响[J].基础医学与临床,2009,29(10):1065-1069.
[7]于丹,王哲,王健,等.眼针对脑缺血再灌注损伤72小时大鼠海马组织ICAM表达的影响[J].解剖科学进展,2012,18(1):1-7
[8]Ulrike H,Joanna W,Reinhard K,et al.Real-time continuous glucose monitoring in critically illpatients:a prospective randomized trial[J].Diabetes Care.2010,33(3):467 -472.
[9]Silvio EI, RichardMB, JohnBB, etal.Management of hyperglycemia in type 2 diabetes:a patient-centered approach:position statement of the American Diabetes Association(ADA)and the European Association for the Study of Diabetes(EASD)[J].Diabetes Care,2012,35(6):1364 -1379.
[10]Johnson EL.Glycemic variability:Too often overlooked in type2 diabetes?[J].Faor Pract.2010,59(8):E1 -8.
[11]Koistinaho M,Kettunen MI,Goldsteins G,et al.Beta-amyloid precursor protein transgenic mice that harbor diffuse A beta deposits but do not form plaques show increased is chemic vulnerability:Role of inflammation[J].J Proc Natl Acad Sci USA,2002,99(3):1610-1615.
[12]Chao CC,Hu S,Eerhlich I,et al.Interleukin-1 and tumor necrosis factor-α synergistically mediate neurotoxicity:involvement of nitric oxide and of N-methyl-D-aspartate receptors[J].Behav Immun,1995,9:355 -365.
[13]Ravizza T,Rizzi M,Perego C,et al.Inflammatory response and glia activation in developing rathippocampus after status epilepticus[J].Epilepsia,2005,46(Suppl 5):113 -117.
[14]Vezzani A,Baram TZ.New roles for interleukin-1 beta in the mechanisms of epilepsy[J].Epilepsy Currents,2007,7(2):45-55.
[15]Viviani B,Bartesaghi S,Gardoni F,et al.Interleukin-1 beta enhances NMDA receptor-mediated intracellular calcium increase through activation of the Src family of kinases[J].J Neuro sci,2003,23(25):8692-8700.
[16]Xu J,Fan G,Chen S,et al.Methyl prednisol one inhibition of TNF-α expression and NF-κB activation after spinal cord injury in rats[J].Mol Brain Res,1998,59:135.
[17]McCoy MK,Tansey MG.TNF signaling inhibition in the CNS:implications for normal brain function and neurodegenerative disease[J].J Neuroinflammation,2008,5(2):45.
[18]Defraigne JO,Princemail J,Larbuisson R,et al.Cytokine release and neutrophil activation are not prevented by hepairincoated circuits and a protein in administration[J].Ann Thorac Surg,2000,69(1):1084 -1091.
[19]Lynch MA.Interleukin-1 beta exerts a myriad of effects in the brain and in particular in the hippocampus:analysis of some of these actions[J].Vitam Horm,2002,64(1):185-219.
