小丛红景天多糖含量测定及生物学活性研究
2013-05-17王莉,赵桦,徐皓
王 莉,赵 桦,徐 皓
1陕西理工学院生物科学与工程学院,汉中723000;2甘肃农业大学生命科学技术学院,兰州730070
小丛红景天[Rhodiola dumulosa(Franeh)S.H.Fu]为景天科红景天属植物,又名凤尾七、风尾草、凤凰草、香景天[1]。它是一种民间常用的药用植物,是陕西省地道药材“七药”之一。药理学研究证明红景天具有抗缺氧、抗疲劳、抗微波辐射、抗毒、抗癌、抗老化、抗不良刺激、活血化淤等功效[2]。
一些研究表明多糖不仅是生物体必不可少的成分,而且还具有多种生理机能,如真菌多糖具有抗病毒、抗凝血、降血脂、抗肿瘤、免疫调节、延缓衰老等多种生物学活性,已被开发成多种药物和功能性食品添加剂。大量研究表明中药材多糖具有多种生理活性,如增强免疫功能、抗肿瘤作用、抗氧化、抗衰老、消化系统保护等[3-5]。研究表明,中药红景天的红景天多糖具有特殊的生理活性和药理作用,对抗辐射、抗疲劳、抗病毒、提高免疫力、抗癌、降血糖、抗缺铁性贫血、抗肺炎性哮喘、抗氧化、抗菌以及冷冻保存精子保护等方面均有作用[6]。目前对小丛红景天化学成分的系统研究报道较少[7,8],对小丛红景天多糖的研究尤其是多糖的含量测定及抗氧化活性方面的报道甚少。本实验采用秦巴山区产小丛红景天为材料,重点分析研究其多糖类化合物的含量及体外抗氧化活性,深入了解小丛红景天药材中有效成分的基本情况,为该药材的综合开发利用提供科学依据。
1 材料与仪器
1.1 实验材料
实验用药材小丛红景天(凤尾七)为景天科植物小丛红景天[Rhodiola dumulosa(Franch.)S.H.Fu]的干燥根茎,均购自陕西汉中中药材市场,并经汉中药检所彭强主任药师鉴定。
1.2 仪器与试剂
1.2.1 仪器
AB204-型电子分析天平(梅特勒);HH-4型电热恒温水浴锅(北京科伟仪器有限公司);UV-2550紫外分光光度计(日本岛津);KQ-5200DE型数控超声波清洗器(昆山市超声仪器有限公司);722-光栅分光光度计(上海分析仪器总厂)。
1.2.2 试剂
无水乙醇(国产分析纯)、硫酸亚铁(国产分析纯)、30%双氧水(国产分析纯)、磷酸氢二钠(国产分析纯)、磷酸二氢钠(国产分析纯)、邻菲啰啉(国产分析纯)、2,2-二苯基-1-苦基苯肼(DPPH)(Sigmaaldrich公司);叔丁基对苯二酚(TBHQ,色谱纯),Sigma-aldrich公司;抗坏血酸(Vc)、纯净水。2 g/L的蒽酮硫酸溶液(精密称取蒽酮0.2 g溶于100 mL浓硫酸中,现配现用)。
2 实验方法
2.1 小丛红景天中多糖提取及精制
2.1.1 提取流程
50℃烘干药材→粉碎过24目筛→乙醚索氏提取脱脂→95%乙醇回流提取(去除单糖、低聚糖、苷类及生物碱等干扰成分)→抽滤→所得滤渣按一定料液比进行超声浸提→抽滤→滤液水浴浓缩→加入乙醇,使乙醇含量达到80%以上静置过夜→抽滤,回收乙醇→所得沉淀依次用无水乙醇、丙酮、无水乙醚洗涤→挥干溶剂后,50℃烘干,得到粗多糖。
2.1.2 精制流程
称取1.0 g粗多糖,用100 mL纯净水溶解,加入一定量的10%三氯乙酸,振荡后冷藏静置12 h,离心15 min(3500 rpm),合并滤液且减压浓缩至适量体积,加入无水乙醇使其含醇量达80%以上,静置过夜,抽滤,洗涤,干燥,得去蛋白多糖。
2.2 小丛红景天多糖含量测定
采用蒽酮-硫酸法测定植物多糖含量[9]。
2.2.1 标准曲线的建立
精密称取烘至恒重的无水葡萄糖25 mg,置于500 mL容量瓶中,用无离子水溶解并定容至刻度,即配成50μg/mL的标准溶液。
分别精密吸取0.4、0.8、1.2、1.6、2.0 mL 储备液置于试管中,加入1 mL蒸馏水,再分别加入10 mL 2 g/mL的蒽酮–硫酸试剂(冰水浴中),摇匀,沸水浴15 min,取出后于冰水浴中冷却至室温。在620 nm处测吸光度,以吸光度A为纵坐标,葡萄糖质量浓度C(μg/mL)为横坐标,绘制标准曲线。
2.2.2 样品溶液制备
称取小丛红景天药材粉末10.00 g,以乙醚为溶剂,45℃索氏提取仪去脂至乙醚为无色;药渣挥干乙醚,置于圆底烧瓶中,用95%的乙醇90℃回流2 h;抽滤,所得滤渣按一定料液比加蒸馏水,超声波浸提(按一定的超声功率、提取温度、提取时间、提取次数浸提),抽滤,滤液水浴浓缩,加入乙醇,使乙醇含量达到80%以上,直到不再产生新的沉淀为止,静置过夜;抽滤,回收乙醇,所得沉淀依次用无水乙醇、丙酮、无水乙醚洗涤;挥干溶剂后,50℃烘干,得到粗多糖。精密称取粗多糖粉末10 mg,于100 mL容量瓶中,用无离子水溶解并定容至刻度,备用。
2.2.3 小丛红景天多糖含量测定方法学考察
2.2.3.1 稳定性
精密吸取1 mL样品溶液于试管中,参照2.2.1同样显色操作处理,测定吸光值A,考察同一样品在135 min内的吸光值稳定性(n=3)。吸光值在0~105 min中内较为稳定,其平均值为0.265,RSD为0.8%,证实样品在105 min内稳定性良好。
2.2.3.2 精密度
精密吸取1 mL供试液于试管中,按照2.2.1测定方法测定其吸光值,连续测定6次,考察实验精密度性。吸光值平均值为0.263,RSD为0.3%,显示实验精密度良好。
2.2.3.3 重现性
按照供试液制备方法制备小丛红景天多糖供试品溶液6份,按照2.2.3.1测定方法测定其吸光值测定其吸光值,考察实验重性。吸光值平均值为0.264,RSD值为1.0%,表明实验的重现性好。
2.2.3.4 加样回收率
精密吸取已知多糖含量供试液5份,溶液中加入一定量的对照品。按照2.2.3.1测定方法测定其吸光值,连续测定5组数据进行分析,结果如表1所示,小丛红景天多糖的平均回收率为97.76%,RSD为0.56%。

表1 回收率实验(n=5)Table 1 Results of recovery tests(n=5)
2.2.4 小丛红景天多糖含量检测
精密吸取1mL样品溶液于试管中,参照2.2.1同样显色操作处理,测定吸光值A。根据葡萄糖标准曲线可计算小丛红景天多糖的浓度C(小丛红景天多糖浓度以葡萄糖浓度计)和多糖含量。
多糖含量(%)=[(C×N×V)/m2×1000]×m1/M
式中:C为样品液中多糖的质量浓度(μg/mL);N为稀释因子;V为样品液的体积(mL);m1为粗多糖质量(g);m2为测量时所取的粗多糖质量(mg);M为样品质量(g)。
2.3 小丛红景天多糖的体外抗氧化活性
2.3.1 对羟自由基(·OH)清除率的测定
采用邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基。取0.75 mmol/L的邻二氮菲溶液1.0 mL,加50 mmol/L 的磷酸盐缓冲液(pH7.4)1.5 mL,加 0.75 mmol/L 的 FeSO4溶液 1.0 mL,加0.01%的H2O21.0 mL,每加一管立即混匀,最后以纯净水补充总体积至10.0 mL。多糖溶液及Vc溶液清除·OH的作用,依上法分别加入不同浓度的多糖和Vc溶液2.0 mL后再加入0.01%的H2O2。反应液37℃反应1 h,于536 nm处测吸光度A。未损伤管为不加H2O2及多糖溶液或Vc溶液,损伤管只加H2O2溶液[10]。按照以下公式计算对羟自由基(·OH)的清除率。
清除率(%)=(A样品-A损伤)/(A未损伤-A损伤)×100%
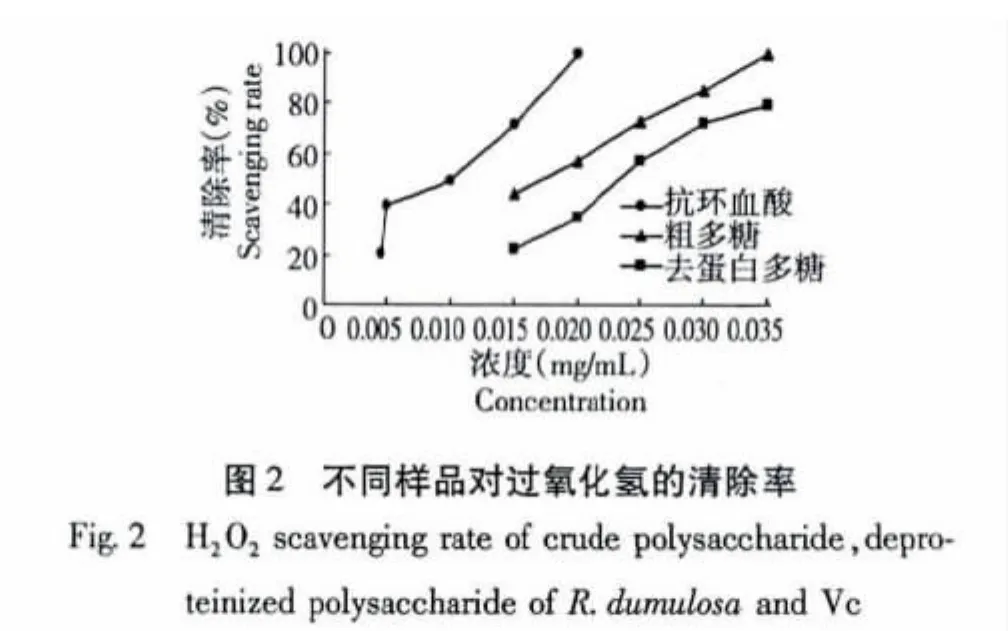
2.3.2 对过氧化氢(H2O2)清除率的测定
加入由50 mmol/L的磷酸盐缓冲液(pH7.4)配制的5 mmol/L的H2O2溶液2.8 mL,再加入不同浓度的多糖和Vc溶液1.0mL,用纯净水补齐至10.0 mL,室温放置10 min后,于波长230 nm处测定吸光度值A,对照为不加多糖或者Vc溶液[11]。按照以下公式计算过氧化氢(H2O2)的清除率。
清除率(%)=(A样品-A对照)/A对照×100%
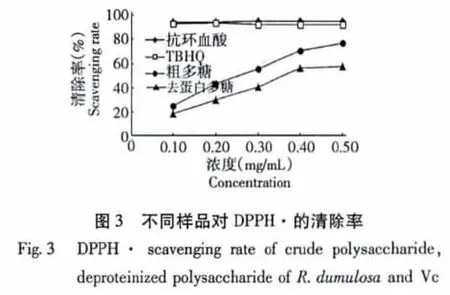
2.3.3 对DPPH·清除率的测定
取2×10-4moL/L的DPPH·无水乙醇溶液2.0 mL,加入2.0 mL不同浓度的待测样品溶液,室温(25℃)反应40 min,于波长517 nm处测定吸光度Ai,同时测定2.0 mLDPPH·和2.0 mL 无水乙醇在517 nm处的吸光度Ac,以及2.0 mL不同浓度的待测样品溶液和2.0 mL无水乙醇混合液在517 nm处测定吸光度Aj。按照下式计算不同浓度受试物对DPPH·的清除率(%)[12]。按照以下公式计算对DPPH·的清除率。
清除率(%)=[(Ac+Aj)-Ai]÷Ac×100%
2.4 小丛红景天多糖的抑菌活性
微量二倍连续梯度稀释法测定最小抑菌浓度(MIC),同时采用平板转种法测定最小杀菌浓度(MBC)。将样本溶于MH肉汤并进行二倍连续梯度稀释,稀释的样本液依次加到96孔细胞培养板,0.2 mL/孔。于每孔加入106CFU/mL菌液20μL。4℃冰箱作用12 h,置37℃培养48 h观察结果。无细菌生长的最小样本浓度为最小抑菌浓度(MIC)。将无细菌生长孔中培养液取20μL接种于MH平板,37℃培养48 h观察结果,无细菌生长接种区域对应的样本最小浓度为最小杀菌浓度(MBC)[13],重复两次。
3 结果与分析
3.1 小丛红景天多糖含量
按照2.2.1项下方法,得到葡萄糖标准溶液回归方程为:A=0.0032C+0.0008(R2=0.9995)。其浓度在20.00~100.00 μg/mL 范围内,线性关系良好。
按照2.2.4项下方法,测得小丛红景天样品中粗多糖的含量为4.08%。
3.2 对羟自由基(·OH)的清除作用
在实验浓度范围内,小丛红景天粗多糖、去蛋白多糖和Vc三者对·OH的清除率均随浓度的增加而增大。Vc清除率增加最快,当浓度为0.06 mg/mL时,清除率已达100%,而在此浓度下,小丛红景天粗多糖对·OH的清除率为41.28%,去蛋白精制多糖对·OH的清除率为24.68%,由此说明小丛红景天粗多糖和去蛋白多糖对·OH的清除能力弱于Vc。
当浓度为0.1 mg/mL时,小丛红景天粗多糖对·OH的清除率也能达到100%;而在此浓度下,小丛红景天去蛋白多糖的清除率为71.28%。这说明去蛋白多糖对·OH的清除率有所下降。测定结果如图1所示。

3.3 对过氧化氢(H2 O2)的清除作用
在实验浓度范围内,小丛红景天粗多糖、去蛋白多糖和Vc三者对H2O2的清除率均随浓度增加而增大,且Vc的清除作用增加较快,当浓度为0.02 mg/mL时,Vc的清除率达到100%,而粗多糖的清除率也能达到57.39%,但去蛋白多糖的清除率仅为35.13%。当浓度为0.35 mg/mL时,粗多糖对H2O2的清除率能达到100%,而在此浓度下去蛋白多糖对H2O2的清除率仅接近80%。研究结果说明小丛红景天粗多糖对H2O2有较强的清除作用,去蛋白多糖的清除作用弱于粗多糖。测定结果如图2所示。
3.4 对DPPH·的清除作用
测定结果如图3所示:粗多糖和去蛋白多糖的清除率随实验浓度的增加而增大,且增加趋势基本成线性关系,当浓度为0.5 mg/mL时,粗多糖对DPPH·的清除率为76.54%,而去蛋白多糖的清除率为57.69%。说明小丛红景天粗多糖对DPPH·有较好的清除作用,去蛋白多糖的清除作用弱于粗多糖。相比之下,在Vc和TBHQ的浓度达到0.1 mg/mL时,二者对DPPH的清除率分别为95.31%和92.62%,此后随着实验浓度的变化Vc和TBHQ对DPPH·的清除率的变化不大。
3.5 小丛红景天多糖的抑菌活性
如表5所示:小丛红景天多糖对选定的白假丝酵母菌(CMCC85021)、枯草芽胞杆菌(CMCC63501)、金黄色葡萄球菌(ATCC25925)和大肠埃希氏菌(ATCC25922)四种供试菌株均有很好的抑制作用,小丛红景天多糖对四种供试菌株的抑制作用能力大小顺序为白假丝酵母菌>大肠埃希氏菌>枯草芽孢杆菌>金黄色葡萄球菌。

表2 小丛红景天多糖的抑菌效果Table 2 Antimicrobial activity of R.dumulosa polysaccharide
4 讨论
本实验初步建立了小丛红景天中多糖的含量测定方法,方法简便、可靠、稳定性好,为小丛红景天多糖的进一步研究开发提供了一定基础。
本研究测得小丛红景天多糖的含量为4.08%。方勇(2011)曾对生长于不同地区的6种红景天植物多糖进行了分析比较,发现其多糖的含量有较大的差别。其中高山红景天多糖含量为4.87%,圣地红景天3.50%,狭叶红景天2.98%,玫瑰红景天2.81%,西藏大花红景天1.98%,四川大花红景天1.06%[14]。相比之下,生长于陕西秦岭的小丛红景天其多糖含量较高,仅次于高山红景天的多糖含量。
体外抗氧化实验结果表明:小丛红景天粗多糖和去蛋白多糖对·OH、H2O2和DPPH·有一定的清除作用,清除作用与浓度成正相关。其中,当粗多糖浓度达到一定值时,粗多糖对H2O2和·OH的清除率均可达到100%,其清除作用与Vc相当。相比之下去蛋白多糖对几种自由基的清除作用弱于粗多糖的。这可能是在粗多糖去蛋白的过程中,有一部分与蛋白质结合的活性糖被一同去除,使其对自由基的清除作用下降。
抑菌试验结果表明:小丛红景天多糖具有一定的抑菌活性,对大肠埃希菌、金黄色葡萄球菌、枯草芽胞杆菌和白色假丝酵母均有很好的抑制作用,尤其对白色假丝酵母抑制作用明显。
研究表明,小丛红景天植物多糖含量较高,体外实验证明其具有良好的清除自由基和抑菌、杀菌生物活性。因此,小丛红景天多糖在医药、保健方面,具有较好的开发利用价值。
致谢:本文抑菌实验在西安交通大学医学院免疫与病原生物学系完成,陕西理工学院生物科学与工程学院生工082班寇庆同学参与部分实验工作,谨此表示感谢!
1 Flora of China Editorial Committee(中国科学院中国植物志编委会).Flora of China(中国植物志),Beijing:Science Press,1984.Vol34,161.
2 Editorial Committee of Dictionary of Traditional Chinese Medicines(中药大辞典编委会).Dictionary of Traditional Chinese Medicines,2ndEdition(中药大辞典,第 2版),Shanghai:ShanghaiScientific and Technial Publishers,1985.665.
3 Chen X(陈旋),Zhang Y(张翼),Zhang JB(张剑波).Advances in research on the plant polysaccharides.Chin JNew Drugs(中国新药杂志),2007,16:1000-1004.
4 Yuan JF(原江锋),Wang DH(王大红).Antioxidant effects and cytotoxicity of crude polysaccharide from Ligusticum chuanxiong Hort.Nat Prod Res Dev(天然产物研究与开发),2012,24:877-881.
5 Li YL(李燕凌),Zhang ZX(张志旭),Hu N(胡令).Antioxidation of polysaccharides from Poria cocos.Nat Prod Res Dev(天然产物研究与开发),2012,24:1126-1128.
6 Huang BY(黄冰洋),Guo J(郭靖),Wei H(魏海).Research progress of polysaccharides from Rhodiola rosea.J Jilin Med Coll(吉林医药学院学报),2011,32:108-110.
7 Luo DQ(罗定强),Zhao XY(赵翔宇),Wang JX(王军宪).Studies on the chemical constituents from Rhodiola dumulosa(I).JChin Med Mater(中药材),2005,28(2):98-99.
8 Wang JX(王军宪),Luo DQ(罗定强),Zhao XY(赵翔宇).Studies on the chemical constituents from Rhodiola dumulosa(II).J Chin Med Mater(中药材),2006,29:335-336.
9 Yi JP(易剑平),Bi YJ(毕雅静),Song XR(宋秀荣),etal.Investigation on anthrone-H2SO4methodology of determination of polysaccharides in Lycium Barbarum.J Beijing Poly Univ(北京工业大学学报),2005,31:641-646.
10 Jin M(金鸣),Cai YX(蔡亚欣),Li JR(李金荣),et al.1,10-Phenanthroline-Fe2+oxidative assay of hydroxyl radical produced by H2O2/Fe2+.Prog Biochem Biophysics(生物化学与生物物理进展),1996,23:553-555.
11 Ru QM(茹巧美),Pei ZM(裴真明),Zheng HL(郑海雷).In vitro studies on antioxidant and antimicrobial activities of polysaccharide from Lycoris aurea.J Chin Med Mater(中药材),2008,31:1536-1540.
12 Zheng DG(郑大贵),Ye Q(叶青),Ye HD(叶红德),et al.Evaluation of antioxidant activity of L-ascorbic acid,D-isoascorbic acid and their derivatives by DPPH· assay.Sci Technol Food Ind(食品工业科技),2008,29:113-116.
13 Alberto A,Andrea B,Elisabetta C,et al.Chemical composition,plant gentic differences,antimicrobial and antifungal activity investigation of the essential oil of Rosmarinusoffcinalis L..JAgric Food Chem,2004,52:3530-3535.
14 Fang Y(方勇).The content determination and analysis of polysaccharides from Rhodiola rosea growing in different regions.Mod J Integr Tradit Chin Western Med(现代中西医结合杂志),2011,20:3988-3989.
