藏红花花瓣体外抗氧化活性部位的筛选与研究
2013-05-17黄一泓刘雅莉武文斌
黄一泓,刘雅莉,武文斌,张 雯
华东师范大学生命科学学院,上海200062
藏红花(Saffron,Crocus sativus L.),又名番红花、西红花、洎夫蓝、撒法即,为鸢尾科番红花属多年生草本植物,据《中华人名共和国药典》记载,其药用部位为干燥的花柱,藏红花作为传统中药其功效为:活血化瘀,凉血解毒,解郁安神。用于经闭癥瘕,产后瘀阻,温毒发斑,忧郁痞闷,惊悸发狂等[1]。除药用外,它可用作食品添加剂、食用色素和高级香料。近年对藏红花的药理研究表明,其花柱中的主要有效成分—藏红花苷对于癌症、冠心病、动脉粥样硬化、高血脂症等多种疾病具有较好的防治作用[2]。其花柱因产量极低同时具有神奇的药效而被世人封以“植物黄金”的称号,同时,大量的非药用部位—花瓣在藏红花的制药工业中成为副产品,造成极大的资源浪费。已有学者从藏红花花瓣的甲醇提取物中分离得到35个单体化合物,主要为萜类和黄酮醇类[3]。有研究显示:藏红花花瓣提取物对抑郁症有一定的疗效[4],并对DPPH自由基、白血病细胞、白色念珠菌有一定的抑制作用[5]。此外从花瓣中分离到的黄酮醇类单体对酪氨酸酶有较好的抑制作用[6]。上述研究表明藏红花花瓣具有活性成分及功能,具备进一步利用的基础。
为此,本研究以废弃的藏红花花瓣为材料,利用体外抗氧化活性体系筛选出其活性部位,并从清除自由基和抗脂质过氧化两方面对其展开研究,旨在填补研究空白,延长产业链,为藏红花的深度利用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 药品与动物
总抗氧化能力(T-AOC)测试盒,购自南京建成生物工程研究所;2,2-二(4-叔辛基苯基)-1-苦肼基自由基(DPPH·),购自Sigma公司;硫酸亚铁(Fe-SO4·7H2O)、水杨酸、30%H2O2、盐酸、邻苯三酚、石油醚、氯仿、乙酸乙酯、正丁醇、甲醇、无水乙醇、硫代巴比妥酸、磷酸二氢钠、磷酸氢二钠、三氯乙酸等试剂均为国产分析纯。ICR雄性小鼠,体重18~20 g,购自上海西普尔-必凯实验动物有限公司。
1.1.2 主要仪器
粉碎机(上海鼎广机械设备有限公司);RE-2000型旋转蒸发仪(上海亚荣生化仪器厂);DHG-9246A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);7200型可见分光光度计(上海市第三分析仪器厂);HHS型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂);梅特勒-托利多B-L系列电子天平(梅特勒-托利多仪器有限公司);TL-16R台式高速冷冻离心机(上海市离心机机械研究所)。
1.2 实验方法
1.2.1 原料预处理
藏红花花瓣,由浙江寿仙谷药业提供,由华东师范大学生命科学学院李宏庆副教授鉴定。置烘箱50℃烘干至恒重,粉碎过60目筛,密封袋避光保存备用。
1.2.2 藏红花花瓣不同极性部位的制备
准确称取100 g藏红花花瓣干粉末,于10倍体积70%的乙醇60℃下回流提取3次,过滤,合并滤液,45℃减压浓缩,真空冷冻干燥,得到藏红花花瓣提取物45.97 g。称取10 g藏红花花瓣提取物,溶入蒸馏水中,混匀,转入分液漏斗中,加入相同体积的石油醚,振摇10 min,放气,静置8 h后,放出下层水溶液,收集石油醚部分;下层水溶液用同法继续萃至上层液体无色为止,合并石油醚萃取液,减压浓缩,浓缩液真空冷冻干燥即得到0.752 g藏红花花瓣提取物的石油醚相(PE)。石油醚萃取后的剩余水溶液按上述方法依次用氯仿、乙酸乙酯、正丁醇萃取,分别得到0.985 g氯仿相(T)、1.005 g乙酸乙酯相(EA)、1.254 g正丁醇相(B)。正丁醇萃取后的剩余水溶液直接在60℃下减压浓缩,真空冷冻干燥得到4.676 g藏红花花瓣提取物的水相(W)部分。
1.2.3 藏红花花瓣体外抗氧化活性部位的筛选
用含1%DMSO的无水乙醇将藏红花花瓣5个不同极性部位的提取物分别配成 0.1、0.5、1、5 mg/mL的溶液作为供试液备用。
1.2.3.1 DPPH·清除能力测定
按照文献[7]方法略作改动,在 1.9 mL,0.065 mmol/L的DPPH自由基乙醇溶液中分别加入0.1 mL供试液。室温放置30 min,于517 nm下测定吸光度,每个反应做3个平行,取平均值。以1%DMSO的无水乙醇代替样品作为空白对照,吸光度为A0;以无水乙醇代替DPPH自由基溶液作为样底管吸光度为A2。DPPH自由基清除能力测定计算公式如下:
清除率(%)=[1-(A1-A2)/A0] ×100%
1.2.3.2 羟基自由基清除能力测定
按照Smirnoff的方法[8]略作改动,在试管中依次加入6mmol/L的硫酸亚铁1 mL,6 mmol/L的水杨酸-乙醇溶液1 mL,分别加入1 mL供试液,混匀后后加入0.1%的H2O2溶液1 mL,以蒸馏水补足至总体积5 mL。其中对照管以1 mL含1%DMSO的无水乙醇代替样液,样底管以乙醇代替水杨酸溶液,摇匀后37℃水浴0.5 h,离心,510 nm处测定吸光值。清除率计算公式如下:
清除率(%)=[1-(A1-A2)/A0] ×100%
式中,A1为供试液的吸光度平均值;A2为样底管吸光度平均值;A0为对照管吸光度平均值。
1.2.3.3 超氧阴离子清除能力测定[9]
取0.05 mol/L的 PBS缓冲溶液(pH=8.0)2.25 mL,分别加入0.5 mL供试液和25 mmol/L的邻苯三酚溶液0.2 mL,混匀后于25℃水浴中反应5 min,加入 0.5 mL 80 mmol/L 的 HCI终止反应,于420 nm处测定吸光度A1,空白对照以同体积的1%DMSO的无水乙醇代替样品;为排除供试液颜色干扰,样底管用同体积的无水乙醇代替邻苯三酚溶液。
清除率(%)=[1-(A1-A2)/A0]×100%
式中:A1为供试液的吸光度平均值;A2为样底管的吸光度平均值;A0为空白对照管的吸光度平均值。
1.2.3.4 总抗氧化能力(T-AOC)测定
不同极性部位总抗氧化能力的测定使用总抗氧化能力(T-AOC)测试盒进行,方法按照说明书操作。
1.2.4 藏红花花瓣活性部位对脂质过氧化的抑制作用
取上述试验中对自由基清除效果最强的部位为研究对象,配置成 0.1、0.25、0.5、1、5、10 mg/mL 的溶液作为供试液备用。
1.2.4.1 藏红花花瓣提取物活性部位对红细胞自发性氧化溶血的抑制作用[10]
小鼠眼眶取血,制成抗凝血,4℃,4000 rpm离心5 min,去除上层溶液,红细胞用预冷的生理盐水洗涤3次制成0.5%的红细胞悬液备用。
取0.5%红细胞悬液1.5 mL,分别加入 0.1 mL试样,空白对照为等体积蒸馏水,混匀,于37℃温育24 h后用生理盐水稀释4倍,4000 rpm离心10min,取上清液于540 nm处测定OD值。
对红细胞自氧化溶血的抑制率(%)=(1-A/A0)×100%
式中:A为试样的平均吸光度值,A0为空白对照的平均吸光度值。
1.2.4.2 藏红花花瓣提取物活性部位对H2O2诱导的红细胞氧化溶血的抑制作用
取1.2.4.1 制备的 0.5% 红细胞悬液 1 mL,分别加入0.1 mL试样(空白对照为等体积蒸馏水代替),加入0.5 mL的50 mmol/L H2O2启动反应,混匀,37℃温育1 h后生理盐水稀释4倍,4000 r/min离心10 min,取上清液于415 nm处测定OD值。
对H2O2诱导的红细胞氧化溶血的抑制率(%)=(1-A/A0)×100%
式中:A为试样的平均吸光度值,A0为空白对照的平均吸光度值。
1.2.4.3 藏红花花瓣提取物活性部位对肝脏自发性脂质过氧化的抑制作用[11]
小鼠颈椎脱臼致死,迅速取出肝脏,用冰冷的生理盐水洗净,加入10倍体积冰冷的生理盐水,冰浴匀浆,得到10%的肝脏匀浆液备用。取1 mL肝匀浆液于玻璃试管中,分别加入0.5mL不同浓度的供试样,空白对照加入等体积蒸馏水,混匀37℃温浴1 h,加入1mL的20%三氯乙酸(TCA)溶液,混匀后再加入0.7%的硫代巴比妥酸溶液1.5 mL,沸水浴保持15 min,4000 rpm离心10 min,取上清液于波长532 nm处测定OD值。
对肝脏自发性脂质过氧化的抑制率(%)=(1-A/A0)×100%
式中:A为试样的平均吸光度值,A0为空白对照的平均吸光度值。
1.2.4.4 藏红花花瓣提取物活性部位对H2O2诱导的肝脏脂质过氧化的保护作用
取1.2.4.3 制备的肝脏匀液 1 mL,分别加入0.5 mL不同浓度的供试样,空白对照加入等体积蒸馏水,混匀37℃温浴15 min,各试管中加入0.1 mL 100 mmol/L H2O2,混匀 37 ℃温浴 0.5 h,再分别加入1 mL 20%的三氯乙酸终止反应,然后加入1 mL 0.7%的硫代巴比妥酸溶液,混匀后于沸水中显色15 min,4000 rpm离心10 min,去除蛋白质沉淀取上清液于波长532 nm处测定OD值。
对H2O2诱导的肝脏脂质过氧化的抑制率(%)=(1-A/A0)×100%
式中:A为试样的平均吸光度值,A0为空白对照的平均吸光度值。
2 实验结果
2.1 藏红花花瓣提取物体外抗氧化活性部位的筛选
2.1.1 藏红花花瓣不同极性部位对DPPH·的清除作用

图1 藏红花花瓣提取物5个不同极性部位对DPPH·的清除作用Fig.1 Scavenging effects of five fractions with different polarities on DPPH·
由图可知藏红花花瓣提取物的5个极性部位对DPPH·均有一定的清除作用,除乙酸乙酯相外,其他部位的清除作用没有表现出明显的浓度效应。5 mg/mL时各极性部位对DPPH·的清除率分别为:石油醚相24.54%,氯仿相22.97%,乙酸乙酯相34.95%,正丁醇相25.54%,水相12.29%。

图2 藏红花花瓣提取物5个不同极性部位对的清除作用Fig.2 Scavenging effects of five fractions with different polarities on
2.1.2 藏红花花瓣不同极性部位对超氧阴离子的清除作用
各部位在1 mg/mL时对O-·2的清除作用有不同程度的增强,5 mg/mL时各部位对O-·2的清除率分别达到:石油醚相19.88%,氯仿相20.49%,乙酸乙酯相75.57%,正丁醇相41.81%,水相41.90%。
2.1.3 藏红花花瓣不同极性部位对羟自由基的抑制作用
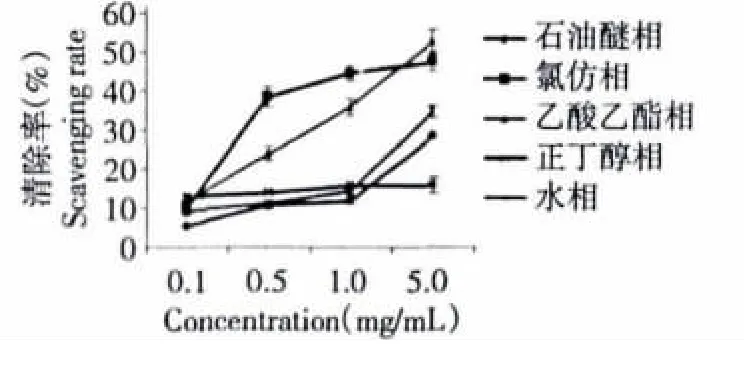
图3 藏红花花瓣提取物5个不同极性部位对·OH的清除作用Fig.3 Scavenging effects of five fractionswith different polarities on·OH
在所测定的浓度范围内,氯仿相和乙酸乙酯相对·OH的清除作用较其他3个部位强,各部位在5 mg/mL时·OH的清除分别为:石油醚相28.50%,氯仿相47.44%,乙酸乙酯相 52.48%,正丁醇相15.83%,水相 34.70%。
2.1.4 藏红花花瓣不同极性部位总抗氧化能力(TAOC)的测定
在低浓度时各部位的总抗氧化能力均较弱,当浓度升高到5 mg/mL时,各极性部位总抗氧化能力均明显增强,总抗氧化能力值(单位/毫升提取物)分别为 5.51、3.15、21.49、8.87、18.92 个单位。

图4 藏红花花瓣提取物5个不同极性部位总抗氧化能力(T-AOC)的测定Fig.4 Total antioxidant capacity of five fractions with different polarities
上述四个实验结果表明,藏红花花瓣提取物的5个不同极性部位对自由基都有一定的清除作用,均表现出抗氧化活性,且在一定浓度范围内与浓度呈现正相关效应;其抗氧化效果因反应体系的不同而不同,且不同极性部位抗氧化活性稍有差异。综合4中抗氧化体系评价藏红花提取物的5种不同极性溶剂提取物,其中以乙酸乙酯相的抗氧化作用最强,因此选择乙酸乙酯相作为进一步的研究对象。
2.2 藏红花花瓣提取物乙酸乙酯相对脂质过氧化的抑制作用
2.2.1 乙酸乙酯相对红细胞自氧化溶血的抑制作用

图5 藏红花花瓣提取物乙酸乙酯相对红细胞自氧化溶血的抑制作用Fig.5 Inhibition effects of EA on hemolysis of mice erythrocytes
由图5可知,EA对红细胞自氧化溶血的抑制作用在5 mg/ml时达到40.36%,抑制作用随着浓度的增大而加强,IC50为8.82 mg/mL,说明乙酸乙酯相能有效的减少红细胞温育过程中形成的脂质过氧化物含量,对红细胞有一定的保护作用。

图6 藏红花花瓣提取物乙酸乙酯相对H2 O2诱导的红细胞氧化溶血的抑制作用Fig.6 Inhibition effects of EA on hemolysis ofmice erythrocytes induced by H2O2
2.2.2 乙酸乙酯相对H2O2诱导的红细胞氧化溶血的抑制作用
H2O2与红细胞产生氧化反应,破坏细胞膜,引起细胞损伤。图6中实验结果表明,EA对H2O2诱导的红细胞氧化溶血的抑制作用呈现浓度依赖效应,且在5 mg/mL时抑制率达到58.91%,IC50为4.29 mg/mL,由此可见EA在细胞水平上也能够有效抑制氧化损伤。
2.2.3 乙酸乙酯相对小鼠肝脏自发性脂质过氧化的保护作用
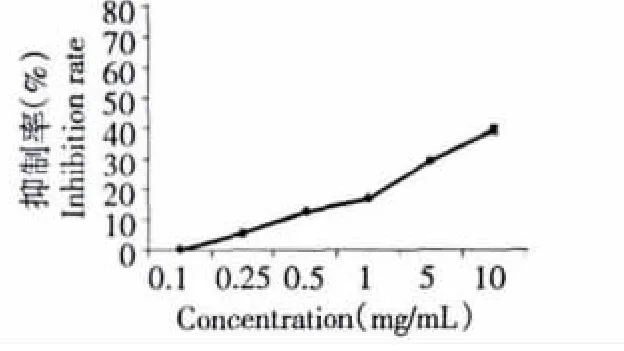
图7 藏红花花瓣提取物乙酸乙酯相对肝脏自发行性脂质过氧化的保护作用Fig.7 Protective effects of EA on lipid peroxidation ofmice liver homogeate
EA对肝脏自氧化溶血的保护作用见图7,在所测定的浓度范围内,随着浓度升高对肝脏自发行性脂质过氧化的保护作用加强,并呈现出良好的浓度正相关趋势,在10 mg/mL时对MDA生成的抑制率达到39.81%。
2.2.4 乙酸乙酯相对H2O2诱导的肝脏脂质过氧化的保护作用

图8 藏红花花瓣提取物乙酸乙酯相对H2O2诱导的肝脏脂质过氧化的保护作用Fig.8 Protective effects of EA on lipid peroxidation ofmice liver homogenate induced by H2 O2
H2O2刺激肝脏产生过氧化物MDA,其产量的多少可以代表组织损害的程度。由图8实验结果可知,在低浓度(0.1 mg/mL ~1 mg/mL)范围内EA对MDA生成的抑制作用缓慢的增强,但在高浓度(1 mg/mL ~10 mg/mL)范围内,EA对MDA生成的抑制作用随着浓度的升高而迅速加强,在10 mg/mL时对MDA生成的抑制率达到47.53%,说明EA能够有效地保护H2O2诱导的肝脏脂质过氧化。
3 讨论
本文着重于藏红花花被的药效研究,以体外抗氧化系统来锁定其活性部位评价其活性。自由基清除法是传统的抗氧化能力测定方法之一,因实验方法简单快速,实验结果直观准确而广泛应用于评价与测定抗氧化物质的活性。又因没有一种抗氧化体系可以全面评价比较供试品的抗氧化活性,故选取DPPH·、羟基自由基、超氧阴离子、总抗氧化能力等四个指标来综合评价藏红花花瓣不同极性部位的抗氧化活性。由实验结果可知,藏红花花瓣提取物的5个不同极性部位均有较好的清除自由基的能力,均表现出抗氧化活性,其中以乙酸乙酯部位作用最明显。
目前已有研究证明,自由基增加所引起的肝脏脂质过氧化是许多肝脏疾病的病因,如酒精性肝炎、血色病、内毒素性肝损害、急、慢性肝炎和肝硬化、肝脏肿瘤等[12],因此研究出天然的抗脂质过氧化剂具有重要意义。本实验结果显示,藏红花提取物乙酸乙酯相对红细胞氧化溶血及肝脏脂质过氧化均有较好的保护作用,联系其对自由基的清除作用,可推断其保护机理可能是与H2O2作用,阻止氧化反应的进行,从而减少过氧化产物的生成。希腊学者AikateriniTermentzi[13]对藏红花花瓣的醇提取物进行LCMS分析发现,其活性成分主要为黄酮醇类以及少量生物碱。目前本实验中乙酸乙酯相的成分与作用机理尚不明确,有待进一步研究。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.VolI,86.
2 Mohammad SM.Saffron chemicals and medicine usage.J Med Plants Res,2010,4:427-430.
3 Li CY,Lee EJ,Wu TS.Antityrosinaseprinciples and constituents of the petals of Crocus sativus.JNatProd,2004,67:437-440.
4 BastiAA,Moshiri E,Noorbala AA,et al.Comparison of petal of Crocus sativus L.and fluoxetine in the treatment of depressed outpatients:A pilot double-blind randomized trial.Neuro-PsychopharmacolBiol Psychiatry,2007,31:439-442.
5 Zheng CJ,Li L,Ma WH,et al.Chemical constituents and bioactivities of the liposoluble fraction from differentmedicinal parts of Crocus sativus.PharmBiol,2011,49:756-763.
6 Kubo I,IkuyoKH.Flavonols from saffron flower:tyrosinaseinhibitory activity and inhibition mechanism.Food Chem,1999,47:4121-4125.
7 Li CY(李春阳),Xu SY(许时婴),Wang Z(王璋),et al.Measuring the antiradical efficiency of proanthocyanidin from grape seed by the DPPH· assay.J Food SciBiotechnol(食品与生物技术学报),2006,25:102-106.
8 Smironff N,Cumbes Q.Hydroxyl radical scavenging activity of compatible solutes.Phytochemistry,1989,28:1051-1560.
9 Yan C(严成),Yan F(严复).Study on extraction of Lyciumbarbarumpolysaccharides by different methods and their antioxidant effects in vitro.Food Chem(食品科学),2008,29:183-187.
10 Lou C(娄翠),Tang SQ(汤顺清).Anti-lipid peroxidation of fucoidan from Laminaria japonica.China Brewing(中国酿造),2011,8:25-28.
11 Cao QH(曹群华),Qu WJ(瞿伟菁),Huang XQ(黄晓青).Antioxidantand anti-lipid peroxidation of flavonoid from Seabuckthorn seed and pomace.Chin Tradit Patent Med(中成药),2003,25:670-673.
12 Zhu HM(朱惠明).Lipid peroxidation and liver disease.Chin J Clin Hepatol(临床肝胆病杂志),1985,12:207-209.
13 Termentzi A,Kokkalou E.LC-DAD-MS(ESI+)analysis and antioxidant capacity of Crocus sativus petal extracts.Planta Med,2008,74:573-581.
