珠江口超微型浮游植物时空分布及其与环境因子的关系
2013-12-23黄小平刘庆霞
张 霞,黄小平,施 震,叶 丰,刘庆霞
(中国科学院南海海洋研究所 热带海洋环境国家重点实验室,广东 510301)
作为微食物环的起点,超微型浮游植物被原生动物(如异养鞭毛虫或纤毛虫)摄食后进入微食物环,再通过桡足类等后生浮游动物的捕食进入经典食物网,所以超微型浮游植物在很大程度上影响着渔业产量。因此,超微型浮游植物在海洋生态系统中的作用倍受研究者的重视。我国自20世纪90 年代早期也开始了海洋超微型浮游植物种类、数量、生产力、分布模式以及与环境因子关系的相关研究,已报道的研究区域包括我国的东海[5]、黄海[6]、南海北部[7-8]、厦门海域[9]、台湾海峡[10]和长江口[11]等海域,相对来说,河口生态系统中超微型浮游植物的研究非常缺乏。
很多河口包括珠江口浮游植物生长的主要限制因子是磷酸盐和光的可利用[12-13],而盐度则对浮游植物的空间分布起着决定性的作用[14-15]。超微型浮游植物是否与其他浮游植物一样受到这些环境因子的调控,它们与小型(>20 μm)、微型(3—20μm)浮游植物的关系如何,这些都是亟待解决的问题。
本研究通过调查珠江口丰水期和枯水期浮游植物种类组成、粒级结构和丰度分布,研究超微型浮游植物丰度、空间分布格局及其环境调控机制,探讨不同粒径大小的浮游植物之间的关系,在不同的季节调控的环境因素是否相同,为系统地研究河口沿岸带和近海区域微食物网结构的空间和季节变化提供科学资料。
1 材料与方法
1.1 研究区域和样品采集
2010年8月13—8月17日(夏季)和2011年1月6—11日(冬季)在珠江口海域进行了两个航次观测。共设置3个断面,夏季布设21个采样点(A1—A8,B1—B7,C1—C6),冬季19个(B7,C6因天气原因未采),站位布设见图1。A断面位于伶仃洋中部,从虎门延伸至万山群岛;B断面位于伶仃洋西部,受径流输入的影响显著;C断面位于东部海域,海洋动力作用占主导地位。
1.2 样品采集和处理
用5 L Niskon 采水器采集表层水样,用于超微型浮游植物计数的水样经20 μm筛绢过滤后,立即注入2 mL冻存管,加40%无颗粒甲醛固定,每个站位取3个平行样,放入液氮罐保存,带回实验室后转移到-20 ℃冰箱中保存至分析(3个月内完成)。用于浮游植物种类计数的1 L水加入鲁哥氏液,避光保存。
用事先高温烘烤过的Whatman GF/ F 玻璃纤维滤膜过滤0.5—1 L水样,滤膜滤液冷冻保存,滤液用于无机营养盐的测定,滤膜用于测定悬浮颗粒物浓度。分粒级叶绿素样品依次用20m、3m 和0.7m膜分级过滤 (超微型藻:0.2—3m; 微型藻:3—20m; 小型藻>20m)[16],过滤体积为1—2 L,滤膜冷冻避光保存。

图1 研究区域及采样站位
1.3 理化因子分析
水温、盐度等用YSI85 型水质检测仪在现场监测。悬浮物浓度依据重量法测定;营养盐浓度测定方法参照《海洋化学调查技术规程》[17],硝酸盐NO3-N采用Zn-Cd 还原法、亚硝酸盐NO2-N用萘乙二胺分光光度法、氨盐NH4-N采用水杨酸分光光度法、磷酸盐用磷钼蓝法,硅酸盐用硅钼蓝法。叶绿素a用荧光分光光度法测定。
1.4 浮游植物的计数
浮游植物1L水样静置沉淀24 h后,去除上层清液,使沉淀物体积为30—50 mL。将浓缩好的样品充分摇匀,吸出0.1 mL,注入记数框。在显微镜下,以40倍物镜下观察计数,换算出浮游植物密度。超微型浮游植物的计数方法按照《海洋调查规范 第6部分:海洋生物调查》实施(GB/T12763.6—2007)[18]进行。取4 mL固定后的水样,经孔径为0.2 μm的黑色核孔滤膜(Whatman)过滤后制片。载玻片于-20 ℃冰箱冷冻保存直至分析[19]。用Olympus 51落射荧光显微计数,在绿光(510—560nm)激发,40倍物镜下观察,每片计数不少于20个视野。
1.5 数据处理
超微型浮游植物数量、浮游植物密度与环境因子的相关性分析采用Pearson相关性系数,而多元线性回归方程的建立选用逐步法筛选自变量,以P<0.05判断模型是否可用,所有数据的统计分析在SPSS 17.0软件中进行。
2 结果
2.1 物理环境因素
夏季珠江口的水温变化范围为29.5—32.6 ℃,平均30.6 ℃。沿河口到近海温度逐渐降低,口门水温较近海区域高1—2 ℃。冬季珠江口水温变化范围是13.8—17.8 ℃,平均15.6 ℃,河口上游水温比下游略低。
夏季,由于珠江河水通量远远大于局地潮汐作用,径流冲淡水几乎占据了整个河口表面,因此夏季盐度低于冬季。夏季盐度的平均值为14.0,变化范围为0.2—28.3,盐度最低值出现在虎门附近,自河口向外逐渐增加。冬季径流量较少,珠江口内盐度均值为25.7,最低盐度值出现在B1站位,最高值在万山群岛至香港大屿山附近海域的C5站,为33.4 (图2)。
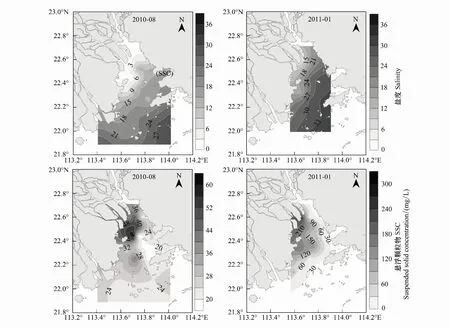
图2 珠江口盐度和悬浮颗粒物浓度分布
悬浮物浓度(SSC)夏季的平均值为30.23mg/L(范围16.97—60.73 mg/L),最大值出现在淇澳岛东北部的B2站,最小值在大屿山附近海域C4点。冬季SSC数值比夏季高,均值为81.43 mg/L(范围18.51—288.40 mg/L),最大值在蕉门附近的B1站位,最小值则位于万山群岛海域的A8站(图2)。
2.2 无机营养盐
夏季和冬季溶解性无机氮是亚硝酸盐、硝酸盐和氨氮之和(DIN=NO3-N + NO2-N+ NH4-N)、磷酸盐(PO4-P) 和硅酸盐 (SiO4-Si) 浓度的变化趋势基本一致,最高值出现在虎门海域,沿盐度梯度逐渐减小(图3),夏季珠江口虎门海域A1站位DIN含量最大,为2.35 mg/L,到大屿山南部海域C6站位浓度降为0.29 mg/L;冬季北部海域A1、A2、B1、C1点的DIN浓度都很高,均大于2 mg/L,到万山群岛附近的A8点则降低到0.1 mg/L(图3)。磷酸盐夏季的最大值22.05g/L出现在A1点,最小值2.63g/L出现在C5站;冬季磷酸盐的变化幅度较剧烈,最高53.23g/L(A2站),最低3.30g/L(C5站)。硅酸盐只在冬季测定,其分布趋势与磷酸盐非常相近,变化范围为0.66—2.49 mg/L (图3)。
2.3 浮游植物和分粒级叶绿素a的时空变化
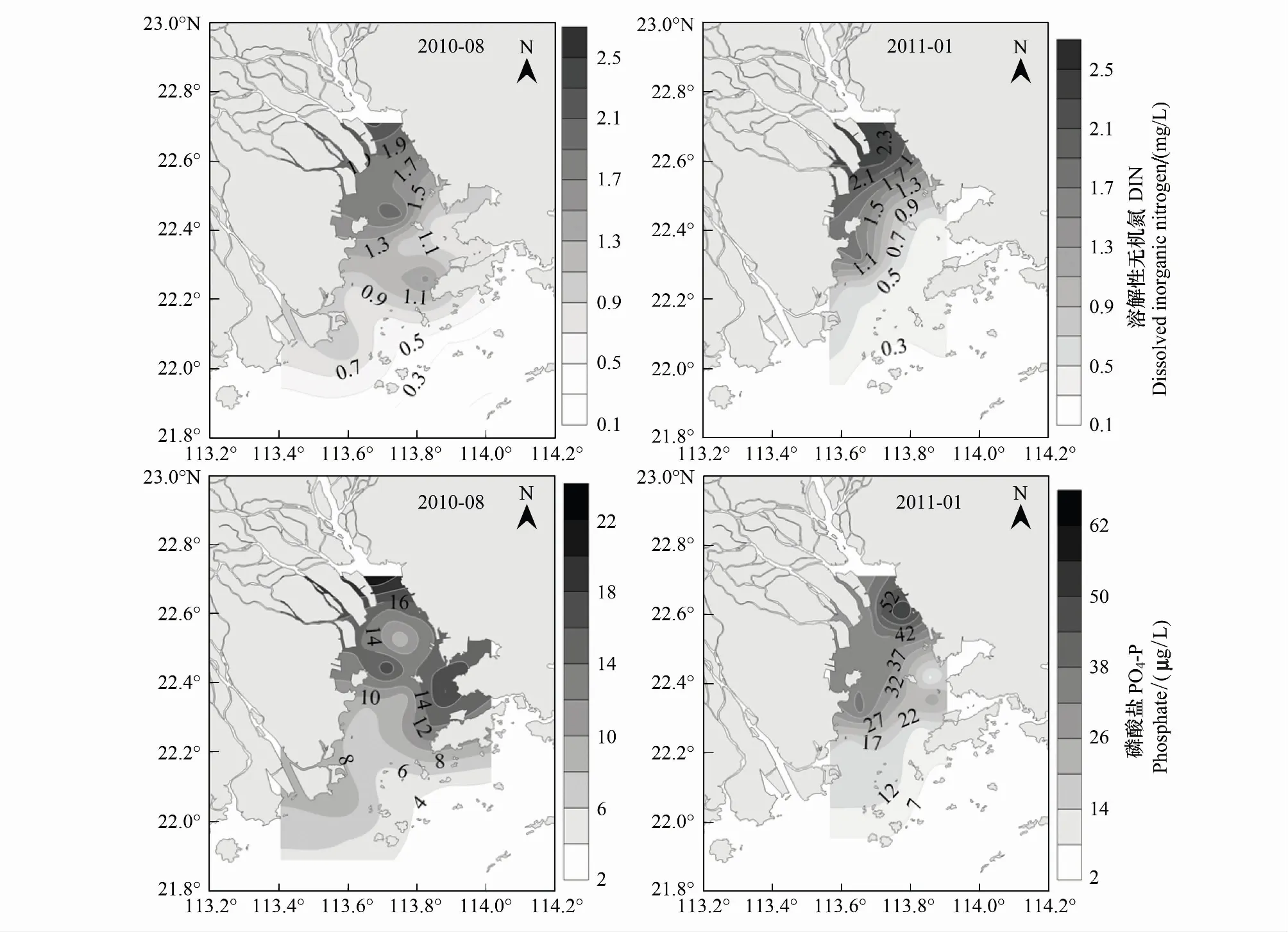
图3 珠江口DIN和PO4-P浓度分布图
夏季和冬季2个航次共发现浮游植物84种,隶属6门,58属。其中硅藻门的种类最多为36种(27属),其次绿藻门有26种(15属),蓝藻门11种(8属),甲藻门7种(5属),隐藻门4种(3属)。
夏季珠江口浮游植物的密度范围为0.30×103—6.63×103个/mL,平均1.76×103个/mL,最高值在A1站,最低值在B7站;夏季虎门附近海域浮游植物以蓝藻门和绿藻门中的淡水藻类,如微囊藻(Microcystis)、席藻(Phormidium)、平裂藻(Merismopedia)、颤藻(Oscillatoria)和栅藻(Scenedesmus)占优势,到近海海域,转为以硅藻门的广温广盐种类——中肋骨条藻(Skeletonemacostatum)占绝对优势(图4)。
冬季浮游植物密度较低,均值为0.56×103个/mL,整个珠江口内部都以一种微型隐藻——伸长斜片藻(Plagioselmisprolonga)为优势种,到近海海域时,中肋骨条藻所占比例有所升高(图4)。
超微型浮游植物夏季的平均数量(2.67×104个/mL)远远高于冬季(1.60×103个/mL),两个季节数量空间分布特征基本一致,均表现为受径流控制的内伶仃岛以北海域数量较低,随着盐度梯度逐渐增加 (图5),到万山群岛附近升高到8.49×104个/mL(夏季)和3.17×104个/mL(冬季)。

图4 珠江口3个断面浮游植物密度分布图
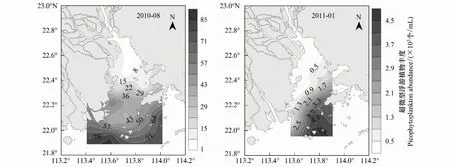
图5 珠江口超微型浮游植物丰度分布图

图6 珠江口分级叶绿素a浓度分布图

图7 珠江口夏季浮游植物与PO4-P、DIN和盐度的相关分析
夏季珠江口总叶绿素a(chl.a)浓度范围0.87—17.03 μg/L,平均浓度7.16 μg/L,高值区主要位于香港大屿山附近海域。冬季整个珠江口叶绿素a浓度很低,平均仅为0.53 μg/L。两个季节绝大多数站位的分级叶绿素浓度均为小型浮游植物(micro-chl.a)最高,其次为微型浮游植物(nano-chl.a),超微型浮游植物 (pico-chl.a) 最低,但是冬季微型浮游植物占总chl.a的比例(33.09%)高于夏季(27.39%),说明冬季微型隐藻在浮游植物群落中的优势地位。两个季节超微型浮游植物chl.a浓度以及占总浮游植物chl.a的比例与其数量空间分布趋势一致,即随着盐度增加逐渐升高(图6)。
2.4 浮游植物空间分布与环境因子的关系
夏季影响浮游植物空间分布的环境因子为磷酸盐浓度,二者成正比(图7)。以浮游植物密度为变量的多元回归线性方程为:
Phyto=0.185 [PO4-P]-0.151 (r=0.519,P<0.05)
夏季超微型浮游植物的数量与无机营养盐,包括NO2-N,NO3-N,NH4-N,PO4-P负相关,而与盐度、水深和pico-chl.a成正比(图7); 以超微型浮游植物密度为变量的多元回归线性方程为:
Pico= -0.288 [PO4-P]+5.780 (r=0.653,P<0.01)
冬季浮游植物与营养盐、悬浮物负相关,与盐度及nano-chl.a正相关。以浮游植物丰度为变量的多元回归线性方程为:
Phyto= -0.002[SSC]+0.627 (r=0.723,P<0.01)
冬季超微型浮游植物的数量与悬浮物、无机营养盐(包括NO2-N,NO3-N,NH4-N,SiO4-Si,PO4-P)和micro-chl.a负相关,而与盐度、水深、水温和pico-chl.a成正比(表1); 以超微型浮游植物密度为变量的多元回归线性方程为:
Pico= -0.735 [PO4-P] -0.073 [SSC]+45.832 (r=0.949,P<0.01)
3 讨论
珠江口海域夏季和冬季营养盐的空间分布特征一致,均表现为近岸高于离岸,硝酸盐、氨氮、硅酸盐和磷酸盐都与盐度显著负相关,表现出很强的保守行为,说明这些无机营养盐的多寡主要由陆源输入控制。本次的调查显示,冬季浮游植物数量与悬浮物浓度成显著负相关,说明浮游植物的生长与光照条件密切相关。在河口上游段,尽管营养盐丰富,但由于高浓度的悬沙作用,影响这一水域的透光率,形成浮游植物低水平的现象[20]。在切萨匹克湾和特拉华河口[20]以及长江口[21]都有类似现象。
除海水中营养盐的浓度外,浮游植物的生长与营养盐之间的比例也有关[22],营养盐比例的变化尤其是 N∶P 比值的变化,能决定浮游植物群落的组成,它主要通过影响浮游植物的种间竞争而改变浮游植物的群落结构[23]。当水体中 N/P (摩尔比)介于 8—30 的范围,浮游植物生长同时受到氮和磷的限制,若 N/P 大于30,浮游植物受磷的限制,若 N/P 小于8则主要受氮的限制[24]。本次调查海域N/P变化较大(夏季为40.8—335.0,冬季为27.8—246.5),因受到珠江陆源输入影响,珠江口绝大多数调查站位 N/P 大于 30,显示磷可能是该海域浮游植物生长的潜在限制因子。该结果与其他研究者的一致[12]。另外,本次调查的结果显示,夏季浮游植物密度与磷酸盐成正相关也反映了珠江口浮游植物受到磷酸盐的限制。
夏季珠江口绝大部分站位的优势种都是中肋骨条藻 (Skeletonemacostatum)。中肋骨条藻的生活水温为0—37 ℃,在盐度13—36的环境中均可生长,但其最适增殖温度为24—28 ℃,最适盐度为20—30[25]。因此它在珠江口常年都能生长,常在夏季达到最大丰度[26]。珠江口海域的硅酸盐一直以来都很丰富,这可能是该海域浮游植物多年来硅藻占优势的一个重要原因。
已有的数据显示,长江口夏季超微型浮游植物的平均数量为8.2×104个/mL[11];胶州湾夏季和冬季超微型浮游植物数量分别为1.72×104和3.71×103个/mL[27];切萨匹克湾的超微型浮游植物数量高达7.2×106个/mL(冬季),9.2×108个/mL(夏季)[28];在密西西比河口羽,4月超微型藻丰度的最大值为1.95×105个/mL,10月的最高值为3.67×105个/mL[29];在欧洲的3个河口生态系统中,超微型藻的数量变化范围分别是2.8×103—4.2×104个/mL(Krka河口),5.0×103—3.7×104个/mL(Rhne河口),1.0×103—5.0×104个/mL(Lena-Laptev河口)[30]。本次调查显示珠江口超微型浮游植物冬季数量明显低于夏季,夏季平均为2.67×104个/mL,冬季为1.60×103个/mL,均低于长江口、切萨匹克湾、密西西比河口羽和南海北部[5]而高于胶州湾,与3个欧洲河口生态系的水平相当,数量分布的不同可能与水体光照条件、营养盐结构和浮游动物摄食压力有关[31]。
表1珠江口冬季浮游植物与环境因子的相关性分析
Table1Pearson′scorrelationcoefficientsbetweenpicophytoplanktonabundanceandenvironmentalfactorsinJanuary2011ofthePRE

DINPO4-PSiO4-SiTSalSSCDepthMicro-chl.aNano-chl.aPico-chl.aPicoPhyto溶解性无机氮DissolvedinorganicnitrogenDIN0.850.98-0.54-0.920.49-0.54-0.72-0.71-0.49磷酸盐PhosphatePO4-P0.850.80-0.53-0.66-0.54-0.76-0.74-0.49硅酸盐SilicateSiO4-Si0.980.80-0.69-0.950.49-0.77-0.79水温TemperatureT-0.54-0.53-0.690.63-0.650.64-0.570.81盐度SalinitySal-0.92-0.66-0.950.63-0.680.510.680.670.58悬浮物浓度WuspendedsolidconcentrationSS0.490.49-0.65-0.68-0.510.86-0.57-0.57-0.58-0.59水深WaterdepthDepth0.64-0.51-0.560.65小型叶绿素aMicro-chl.a-0.570.86-0.56-0.49微型叶绿素aNano-chl.a-0.54-0.540.51-0.570.700.62超微型叶绿素aPicro-chl.a-0.72-0.76-0.770.68-0.570.700.68超微型浮游植物PicophytoplanktonPico-0.71-0.74-0.790.810.67-0.580.65-0.490.68浮游植物PhytoplanktonPhyto-0.49-0.490.58-0.590.62
黑体P<0.01
在亚热带和热带的贫营养海区,超微型浮游植物的初级生产力中可以占到总初级生产力的70%或更多[32],随着营养水平的升高,超微型藻的数量虽然也有所增加,但其重要性和对浮游植物总生物量的贡献比例却随之减小[33]。杨燕辉[27]认为近岸海水的生物、物理和化学特征包括营养盐结构、微量元素以及水体中存在的某些胞外抑制超微型浮游植物生长的物质都可能给其带来负面影响。本次调查超微型浮游植物的平面分布特点表现出:虎门海域的营养盐浓度高,超微型浮游植物叶绿素a(pico-chl.a)浓度和超微型浮游植物数量很低,而在近海区域由于河水与寡营养的外海水混合以及生物吸收作用营养盐水平逐渐降低,超微型浮游植物丰度随之升高,该特点与Mississippi River河口羽结果一致[29]。
在胶州湾,pico-chl.a占总chl.a的23% (年均值),春夏季大,秋冬季小[27];在切萨匹克湾,超微型、微型和小型浮游植物chl.a对总chl.a的贡献分别是15%、41%、44%[34];英国的Southampton Water河口夏季pico-chl.a占总chl.a最高,分别为27.7%(河口内部)和51.4%(近海)[35]。本次珠江口pico-chl.a占总chl.a的比例夏季均值为11.9%,冬季为9.3%,均低于胶州湾、切萨匹克湾和Southampton Water河口,但季节变化模式与几个河口一样,均为夏季高于冬季,说明水温对超微型浮游植物的重要影响;2 个季节珠江口pico-chl.a 比例最高值均出现在夏季万山群岛附近(夏季B6,26.3%;冬季C5,19.1%)与Southampton Water河口结果一样,有力的证明了珠江口尤其是靠近近海域超微型浮游植物在浮游植物群落中的重要地位。
本次的2个航次数据都显示超微型浮游植物的数量与营养盐成负相关,该结果与Stockner[36]和Qiu等[16]的结论相同。Qiu等[16]认为,珠江口超微型浮游植物的优势种聚球藻Synechococcus之所以与营养盐成负相关是因为其适应贫营养环境的生态位特点。模拟实验表明,添加氮、磷会抑制超微型浮游植物的生长[11,37-38]。房潮等研究了超微型浮游植物在不同营养状态下的群落特征,在NO3-N+NO2-N浓度<0.40 mg/L时,超微型浮游植物丰度随着氮营养盐浓度的升高而增加,当水体NO3-N+NO2-N浓度大于0.40 mg/L后,超微型浮游植物丰度随着氮营养盐浓度的升高而减少[39]。本研究中珠江口内受径流影响较大的口门区域浓度都大于0.40 mg/L,对应的水体中超微型浮游植物的数量较低;在万山群岛附近的近海海域,NO3-N+NO2-N基本都小于0.40 mg/L,而其数量却很高。
本研究的结果显示,超微型藻和浮游植物密度成负相关(夏季P>0.05; 冬季P<0.05),表明不同大小的浮游植物对不同营养水平水体的生理适应机理和生存策略。一般来说,由于超微型浮游植物细胞较小,细胞比表面积较大,代谢活性较高,能量转换速率较大,比粒级较大的藻类具有更高的相对光合速率和对营养盐的摄取速率,因此可以在贫营养的水体中快速生长[40-41]。要保持2 d-1的生长速率,超微型藻对环境中DIN和磷酸盐的要求仅为7 nmol/L N和0.4 nmol/L P[42]。Timmermans等[43]的结果证明,自然水体中的N、P、Fe的浓度远远高于超微型藻的生长浓度阈值,不可能成为限制因子。因此,微型和微微型藻是大洋区(贫营养水域)的主要类群,而较大的硅藻、甲藻是大陆架、沿岸带(营养盐丰富水域)的优势种[44]。在本研究中,珠江口的虎门附近主要受径流控制,浮游植物组成以淡水种类为主,到中盐度海域,营养盐和悬浮物含量高,浮游植物(包括超微型藻)受到光照限制,生物量保持低值,而到了万山群岛海域,光照条件好转,无机营养盐尤其是磷酸盐迅速降低,较大的浮游植物种类可能受到P的限制,而超微型浮游植物得以迅速繁殖。
4 结论
(1)夏季珠江口浮游植物密度与磷酸盐成正相关,反映出浮游植物受到磷酸盐的限制。
(2)超微型藻的丰度和超微型叶绿素a浓度的平面分布均表现出为在虎门海域很低,随着盐度升高而逐渐增加,在近海区域最大的特点。
(3)超微型浮游植物表现出适应贫营养环境的生态位特点。
(4)超微型藻和浮游植物总密度成负相关,表明不同大小的浮游植物对不同营养水平水体的生理适应机理和生存策略。
[1]Johnson P W,Sieburth,J M.Chroococcoid cyanobacteria in the sea:A ubiquitous and diverse phototrophic biomass.Limnology and Oceanography,1979,24(5):928-935.
[2]Campbell L,Nolla H A,Vaulot D.The importance of Prochlorococcus to community structure in the central North Pacific Ocean.Limnology and Oceanography,1994,39(4):954-961.
[3]Peng X,Ning X R,Sun J,Le F F.Responses of phytoplankton growth on nutrient enrichments in the northern South China Sea.Acta Ecologica Sinica,2006,26(12):3959-3968.
[4]Burkill P H,Leaky R J B,Owens N J P,Mantoura,R F C.Synechococcus and its importance to the microbial food web in the northwestern Indian Ocean.Deep-Sea Research Part II:Topical Studies in Oceanography,1993,40(3):773-782.
[5]Jiao N Z,Yang Y H,Hong N,Ma Y,Harada S,Koshikawa H,Watanabe M.Dynamics in autotrophic picoplankton and heterotrophic bacteria in the East China Sea.Continental Shelf Research,2005,25(10):1265-1279.
[6]Wang M,Bai X G,Liang L T,Wang F,Jiang X J,Guo Y J,Yang F.Summer distribution of picophytoplankton in the North Yellow Sea.Journal of Plant Ecology,2006,32(5):1184-1193.
[7]Huang B Q,Lin X Y,Liu M,Dai M H,Hong,H S,Li,W.Ecological study of picoplankton in northern South China Sea.Chinese Oceanology and Liminology,2002,20 (Special Issue):22-32.
[8]Pan L A,Zhang J,Chen Q,Deng B.Picoplankton community structure at a coastal front region in the northern part of the South China Sea.Journal of Plankton Research,2006,28(3):337-343.
[9]Chen J X,Huang B Q,Jia X W,Hong H S,Xie T G.Community structure of marine ultraphytoplankton in Xiamen waters using photosynthetic pigments.Marine Environmental Science,2003,22(3):16-21.
[10]Huang B Q,Hong H S,Lin X J,Chen J X.Ecological study on picophytoplankton in the Taiwan Strait—Ⅰ.Spatial and temporal distribution and its controlling mechanism.Acta Oceanologica Sinica,2003(a),25(4):72-82.
[11]Fang T,Li D J,Yu L H,Gao L,Zhang L H.Effect of irradiance and phosphate on growth of nanophytoplankton and picophytoplankton.Acta Ecologica Sinica,2008,26(9):2783-2790.
[12]Yin K,Qian P Y,Chen J C,Hsieh D P,Harrison P J.Dynamics of nutrients and phytoplankton biomass in the Pearl River estuary and adjacent waters of Hong Kong during summer:preliminary evidence for phosphorus and silicon limitation.Marine Ecology Progress Series,2000,194:295-305.
[13]Zhang J,Yu Z G,Wang,J T,Ren J L,Chen H T,Xiong H,Dong L X,Xu W Y.The subtropical Zhujiang (Pearl River) Estuary:Nutrient,trace species and their relationship to photosynthesis.Estuarine Coastal and Shelf Science,1999,49(3):385-400.
[14]Wong M W,Townsend D W.Phytoplankton and hydrography of the Kennebec estuary,Maine USA.Marine Ecology Progress Series,1999,178:133-144.
[15]Zhu G H,Ning X R,Cai Y M,Liu Z L,Liu C G.Studies on species composition and abundance distribution of phytoplankton in the South China Sea.Acta Oceanologica Sinica,2003,25(2):8-23.
[16]Qiu D J,Huang L M,Zhang J L,Lin S J.Phytoplankton dynamics in and near the highly eutrophic Pearl River Estuary,South China Sea.Continental Shelf Research,2010,30(2):177-186.
[17]908 Project Office of State Oceanic Administration.Specification for marine chemical parameters.Beijing:Ocean Press,2006:25-33.
[18]Standardization Administration of China.GB/ T 12763.6—2007.Specifications for oceanographic survey— Part 6:Marine biological survey.Beijing:Standards Press of China,2007:30-34.
[19]Booth B C.Estimating cell concentration and biomass of autotrophlc plankton using microscopy // Kemp P F,Sherr B F,Sherr E B,Cole J J,eds.Handbook of Methods In Aquatic Microbial Ecology.Boca Raton:Lewis Publishers,1993:199-205.
[20]Fisher T R,Harding L W,Stanley D W,Ward L G.Phytoplankton nutrients and turbidity in the Chesapeake,Delaware and Hudson estuaries.Estuarine,Coastal and Shelf Science,1988,27(1):61-93.
[21]Shen Z L.The effects of the physic-chemical environment on the primary productivity in the Yangtze River estuary.Transaction of Oceanology and Limnology,2000,11(3):445-448.
[22]Dong Y H,Cai J D,Qian H L.Nutrient ratios and its relationship with phytoplankton in the Pearl River Estuary.Marine Science Bulletin,2009,28(1):3-10.
[23]Qu K M,Chen B J,Yuan Y X,Xin F Y.A preliminary study on influence of N and P on population constituent of planktonic diatoms in seawater.Chinese Journal of Applied Ecology,2000,11(3):445-448.
[24]Hu M H,Yang Y P,Xu C L,Harrison J P.Phosphate limitation on phytoplankton growth in the Yangtze estuary.Acta Oceanologica Sinica,1989,11(4):439-443.
[25]Huo W Y,Yu Z M,Zou J M,Song X X,Hao J H.Outbreak ofSkeletonemacostatumred tide and its relations to environmental factors in Jiaozhou Bay.Oceanologia Et Limnologia Sinica,2001,32(3):311-318.
[26]Sun B Y,Wang X L,Li Y B,Wang C Y,Wang A J,Liang S K,Zhang C S.Role of Irradiance on the Seasonality ofSkeletonemacostatumCleve Blooms in the Coastal Area in East China Sea.Environmental Science,2008,29(7):362-367.
[27]Yang Y H.Dynamics of Picoplankton in the East and South China Seas and Some Preliminary in situ Experiments on Nutrient Enrichment Effects [D].Qingdao:Institute of Oceanology Academia Sinica,2000.
[28]Davis L N,Phillips K A,Marshall H G.Seasonal abundance of autotrophic Picoplankton in the Pagan River,a nutrient enriched subestuary of the James River,Virginia.Virginia Journal of Science,1997,48:211-218.
[29]Liu H B,Dagg M,Campbell L,Urban-Rich J.Picophytoplankton and bacterioplankton in the Mississippi River Plume and its adjacent waters.Estuaries and Coasts,2004,27(1):147-156.
[30]Moreira-Turcq P F,Cauwet G,Martin J M.Contribution of flow cytometry to estimate picoplankton biomass in estuarine systems.Hydrobiologia,2001,462(1/3):157-168
[31]Guo P Y,Shen H T.Research advance in estuarine phytoplankton ecology.Chinese Journal of Applied Ecology,2003,14(1):139-142.
[32]Takahashi M,Bienfang P K.Size structure of phytoplankton biomass and photosynthesis in subtropical Hawaiian waters.Marine Biology,1983,76:203-211.
[33]Bell T,Kalff J.The contribution of picophytoplankton in marine and freshwater systems of different trophic status and depth.Limnology and Oceanography,2001,46:1243-1248.
[34]Ray R T,Haas L W,Sieracki M E.Autotrophic picoplankton dynamics in a Chesapeake Bay sub-estuary.Marine Ecology Progress Series,1989,52:273-285.
[35]Iriarte A,Purdie D A.Size distribution of chlorophyll a biomass and primary production in a temperate estuary (Southampton Water):the contribution of photosynthetic picoplankton.Marine Ecology Progress Series,1994,115:283-297.
[36]Stockner J G.Autotrophic picoplankton in freshwater ecosystems:The view from the summit.Internationale Revue der Gesamten Hydrobiologie,1991,76(4):483-492.
[37]Chen S,Zhu M Y,Ma Y,Li R X,Li B H,Lv R H.Enclosure experiment on phosphorus eutrophication to the phytoplankton system of the Yangtze River estuary.Acta Oceanologica Sinica,2000,22 (supplement issue):272-280.
[38]Schallenberg M,Burns C W.Tests of autotrophic picoplankton as early indicators of nutrient enrichment in an ultraoligotrophic lake.Freshwater Biology,2001,46(1),27-37.
[39]Fang C,Lu Z B,Zhang L,Wang J.Responses of picophytoplankton abundance to eutrophication of the reservoirs and lakes.Proceedings of 2010 First International Conference on Cellular,Molecular Biology,Biophysics and Bioengineering (Vol 4) 2010.
[40]Chisholm S W.Phytoplankton size// Falkowski P G,Woodhead A D,eds.Primary production and biogeochemical cycles in the sea.New York:Plenum Press,1992:213-237.
[41]Thingstad T F.A theoretical approach to structuring mechanisms in the pelagic food web.Hydrobiologia,1998,363(1/3):59-72.
[42]Agawin N S,Duarte C M,Augustí S.Response of MediterraneanSynechococcusgrowth and loss rates to experimental nutrient inputs Marine Ecology Progress Series,2000,206:97-106.
[43]Timmermans K R,van der Wagt B,Veldhuis M J,Maatman A,de Baar H J.Physiological responses of three species of marine pico-phytoplankton to ammonium,phosphate,iron and light limitation.Journal of Sea Research,2005,53(1/2):109-120.
[44]Malone T C.Algal size.// Morris I,ed.The Physiological Ecology of Phytoplankton.Oxford:Blackwell Scientific Publications,1980.
参考文献:
[3]彭欣,宁修仁,孙军,乐凤凤.南海北部浮游植物生长对营养盐的响应.生态学报,2006,26(12):3959-3968.
[6]汪岷,白晓歌,梁彦韬,王芳,江雪娇,郭永坚,杨帆.北黄海夏季微微型浮游植物的分布.植物生态学报,2006,32(5):1184-1193.
[9]陈纪新,黄邦钦,贾锡伟,洪华生,谢廷贵.利用光合色素研究厦门海域超微型浮游植物群落结构.海洋环境科学,2003,22(3):16-21.
[10]黄邦钦,洪华生,林学举,陈纪新.台湾海峡微微型浮游植物的生态研究 Ⅰ.时空分布及其调控机制.海洋学报,2003,25(4):72-82.
[11]方涛,李道季,余立华,高磊,张利华.光照和营养盐磷对微型及微微型浮游植物生长的影响.生态学报,2006,26(9):2783-2790.
[15]朱根海,宁修仁,蔡昱明,刘子琳,刘诚刚.南海浮游植物种类组成和丰度分布的研究.海洋学报,2003,25(2):8-23.
[17]国家海洋局908专项办公室.海洋化学调查技术规程.北京:海洋出版社,2006:25-33.
[18]国家海洋局.GB/T12763.6—2007 海洋调查规范,第6部分:海洋生物调查.北京:中国标准出版社,2007:30-34.
[21]沈志良.长江口海区理化环境对初级生产力的影响.海洋湖沼通报,1993,1:42-51.
[22]霍文毅,俞志明,邹景明,宋秀贤,郝建华.胶州湾中肋骨条藻赤潮与环境因子的关系.海洋与湖沼,2001,32(3):311-318.
[23]孙百晔,王修林,李雁宾,王长友,王爱军,梁生康,张传松.光照与东海近海中肋骨条藻 (Skeletonemacostatum) 赤潮发生季节的关系.环境科学,2008,29(7):362-367.
[24]董燕红,蔡建东,钱宏林.珠江口海域营养盐比及与浮游植物的关系.海洋通报,2009,28(1):3-10.
[25]曲克明,陈碧鹃,袁有宪,辛福言.氮磷营养盐影响海水浮游硅藻种群组成的初步研究.应用生态学报,2000,11(3):445-448.
[26]胡明辉,杨逸萍,徐春林,哈里森 J P.长江口浮游植物生长的磷酸盐限制.海洋学报,1989,11(4):439-443.
[27]杨燕辉.中国典型海域超微型生物生态学初步研究 [D].青岛:中国科学院海洋研究所,2000.
[31]郭沛涌,沈焕庭.河口浮游植物生态学研究进展.应用生态学报,2003,14(1):139-142.
[37]陈尚,朱明远,马艳,李瑞香,李宝华,吕瑞华.磷富营养化对长江口海洋浮游生态系统影响的围隔实验研究.海洋学报,2000,22(增刊):272-280.
[39]房潮,陆志波,张莲,王娟.微微型浮游生物丰度与平原水库 (湖泊) 水体富营养化因子的响应关系研究//2010年细胞分子生物学、生物物理和生物工程学第一次会议(第四卷)
