非糖尿病慢性肾病患者游离脂肪酸水平与细胞因子及胰岛素抵抗的关系
2013-05-11倪旭伟张德忠刘玉梅叶永玲徐媚媚浙江省青田县人民医院青田323900
倪旭伟 张德忠 刘玉梅 叶永玲 徐媚媚 浙江省青田县人民医院 青田 323900
·论 著·
非糖尿病慢性肾病患者游离脂肪酸水平与细胞因子及胰岛素抵抗的关系
倪旭伟 张德忠 刘玉梅 叶永玲 徐媚媚 浙江省青田县人民医院 青田 323900
目的:观察非糖尿病慢性肾脏病(CKD)患者血清游离脂肪酸(FFA)水平及其与高敏C-反应蛋白(hs-CRP)、肿瘤坏死因子(TNF-α)、胰岛素抵抗的关系。方法:测定118例非糖尿病CKD患者(非透析治疗80例,血液透析38例)及50名健康人FFA、空腹胰岛素(FINS)、空腹血糖(FPS),同时检测hs-CRP、TNF-α、血脂等指标,并计算胰岛素敏感指数(ISI)、稳态模型胰岛素抵抗指数(Homa-IR),分析FFA与胰岛素抵抗的关系。结果:非糖尿病非透析和透析CKD患者血清FFA、hs-CRP、TNF-α、Homa-IR、TG和LP(α)水平均较健康对照组显著升高(P<0.05或P<0.01),且透析CKD组FFA、hs-CRP、TNF-α、FINS、Homa-IR、TG和 LP(α)水平较非透析CKD组明显升高(P<0.05或P<0.01);血FFA水平与hs-CRP、TNF-α、FINS、Homa-IR、TG和LP(α)呈正相关(P<0.01),与ISI负相关(P<0.01)。结论:非糖尿病CKD患者FFA水平明显升高,且与hs-CRP、TNF-α及胰岛素抵抗密切相关。
非糖尿病慢性肾病 游离脂肪酸 超敏C-反应蛋白 肿瘤坏死因子-α 胰岛素抵抗
近年来,慢性肾脏病(chronic kidney disease,CKD)患者胰岛素抵抗现象备受关注。胰岛素抵抗可以引起患者血脂和血糖代谢紊乱,这些紊乱已被证明能增加CKD患者心血管疾病的危险性,导致死亡率增加。研究认为游离脂肪酸(free fatty acid,FFA)、细胞因子与胰岛素抵抗密切相关[1]。为此,我们通过检测118例非糖尿病CKD患者及50名健康人FFA、空腹胰岛素(fasting insulin,FINS)、空腹血糖(fasting plasma glucose,FPS),同时检测超敏C-反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、血脂等指标,分析FFA水平的变化及其与细胞因子和胰岛素抵抗的关系。
1 资料与方法
1.1 研究对象 在患者知情同意下,选择2010年6月—2012年2月我院住院和门诊收治的CKD患者118例(非透析患者80例,透析患者38例),其中男73例,女45例,平均年龄(51.14±10.10)岁,体质指数(Body Mass Index,BMI)(22.80±6.97)kg/m2,原发病为慢性肾小球肾炎53例,高血压良性肾小动脉硬化症18例,多囊肾11例,慢性肾盂肾炎10例,梗阻性肾病9例,紫癜性肾炎6例,痛风性肾病3例,缺血性肾病4例,不明病因4例。选择年龄、性别匹配的50名健康志愿者为对照组,平均年龄(51.54±11.36)岁,其中男32例,女18例,体质指数(23.54±7.69)kg/m2。各组性别、年龄和BMI差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准 ①CKD诊断按文献[2]标准,即肾脏损伤(肾脏结构或功能异常)≥3个月,伴或不伴肾小球滤过率(glomerularfiltrationrate,GRF)降低,表现为病理学检查异常,或有肾损害指标,包括血或尿成分异常,或影像学检查异常:GFR持续<60mL/min的时间≥3个月,有或无肾损害;②3个月内未服用过血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、醛固酮受体拮抗剂或肾素抑制剂;③常规血液透析3个月以上,平均透析龄(17.97±12.21)个月。所有入选患者每次血透采用三醋酸纤维膜透析器及碳酸氢盐透析液,透析液流量500mL/min,血流量250~300mL/min,透析频率2~3次/周,4 h/次。排除标准:①入选前1个月发生急性感染或创伤;②慢性肾功能不全急性加重;③糖尿病、结缔组织疾病或肿瘤;④入选前使用激素或免疫抑制剂超过3个月;⑤实验前1个月有肝功能损害;⑥泌尿系统感染;⑦Ⅲ级以上(NYHA分级)心功能不全。
1.3 标本收集 所有受检对象禁食10h后于清晨空腹采血,血液透析患者为透析前采血,血液生化等指标在我院检验科当日完成。
1.4 方 法 酶联免疫吸附法(ELISA)于全自动定量酶标仪上测定TNF-α水平,试剂盒由深圳矩英生物科技有限公司提供。免疫荧光法检测hs-CRP,酶法检测血清FFA,试剂分别由韩国BODITECH公司和日本Wako公司提供,血清胰岛素采用电化学发光法测定,试剂由德国ROCHE公司提供;其他的指标于日立7600生化仪上检测,试剂均为温州东瓯生物工程有限公司提供。
采用胰岛素敏感指数和稳态模型胰岛素抵抗指数来评价胰岛素抵抗。胰岛素敏感指数为非正态分布,转换为自然对数后进行统计学计算。胰岛素敏感指数(ISI)=1/[FPS(mmol/L)×FINS(m IU/L)];胰岛素抵抗指数(Homa-IR)=[FPS(mmol/L)×FINS(m IU/ L)]/22.5。
2 结果
2.1 非糖尿病CKD组与对照组各项指标比较 CKD
组FFA、hs-CRP、TNF-α、Homa-IR、TG和LP(α)水平较健康对照组均显著升高(P<0.05或P<0.01);ISI和HDL-C水平明显低于对照组(P<0.01);透析CKD组FFA、hs-CRP、TNF-α、FINS、Homa-IR、TG和LP(α)水平升高,ISI、TC和LDL-C水平降低,与非透析CKD组比较,差异有统计学意义(P<0.05或P<0.01),见表1。
2.2 非糖尿病CKD患者FFA水平与细胞因子、Homa-IR等指标相关性分析 非糖尿病CKD患者FFA水平与hs-CRP、TNF-α、FINS、Homa-IR、TG和LP(α)水平呈现明显正相关(P均<0.01),与ISI呈明显负相关(P<0.01),见表2。
3 讨论
大多数慢性肾脏病(CKD)患者存在不同程度的胰岛素抵抗(Insulin resistance,IR)和高胰岛素血症[3-4]。研究表明,胰岛素抵抗可以通过下列机制导致肾损害:①使血压的钠敏感性增加,肾小球内压力增高,从而导致微量白蛋白尿。②促进胰岛素样生长因子(insulin-like growth factor-1,IGF-1)、转化生长因子-β1(Transforming Growth Factor-β1,TGF-β 1)、结缔组织生长因子(connective tissue growth fac⁃tor,CTGF)、纤溶酶原激活抑制物-1(plasminogen ac⁃tivator inhibitor-1,PAI-1)等物质分泌而加重肾损害。③激活肾素-血管紧张素系统(renin-angioten⁃sin system,RAS),改变血管内皮细胞内皮素-1(endothelin,ET-1)和一氧化氮(nitric oxide,NO)的比例加重肾损害。④激活氧化应激反应加重肾损害。同时IR是CKD患者的独立危险因素,可以增加心脑血管疾病的发病率和死亡率[5]。因此,观察CKD患者IR发生情况及相关因素,显得十分迫切。
表1 非糖尿病CKD组与对照组各项指标比较(±s)

表1 非糖尿病CKD组与对照组各项指标比较(±s)
注:与对照组比较,*P<0.05,**P<0.01;与非透析CKD组比较,△P<0.05,△△P<0.01
组别非透析CKD组透析CKD组对照组n/例80 38 50 FFA/(μmol/L) 485.65±111.53** 591.87±119.62**△296.92±118.76 hs-CRP/(mg/L) 3.95±0.71** 4.95±0.66**△2.39±0.79 TNF-α/(ng/L) 1.42±0.59** 1.76±0.75**△1.08±0.61 FPS/(mmol/L) 5.25±0.94 5.59±0.91** 4.97±0.96 FINS/(m IU/L) 10.74±4.75 13.79±6.71**△9.14±4.74 ISI -3.93±0.42** -4.23±0.44**△-3.67±0.60
FFA主要来源于血液中富含TG的脂蛋白和脂肪组织内TG的脂解。脂肪细胞内的TG在各种脂肪酶作用下被水解为FFA和甘油并释放入血,被机体各组织利用。正常人体组织对FFA的利用受胰岛素和胰高血糖素等激素的调控,与性别、年龄和生活习惯等因素有关。本研究结果提示:①慢性肾脏病(CKD)患者在胰岛素抵抗和高胰岛素血症的同时,还表现为细胞炎症因子的表达增加和脂质(包括脂肪酸、TG等)代谢的紊乱;②非透析CKD患者Homa-IR、ISI较血糖、胰岛素更早反应机体胰岛素抵抗的存在。③血液透析过程可能部分加重了CKD患者脂质、脂肪酸代谢的异常及微炎症反应,导致机体严重的胰岛素抵抗。但其中的确切机制尚待进一步研究。
表1 (续) 非糖尿病CKD组与对照组各项指标比较(±s)
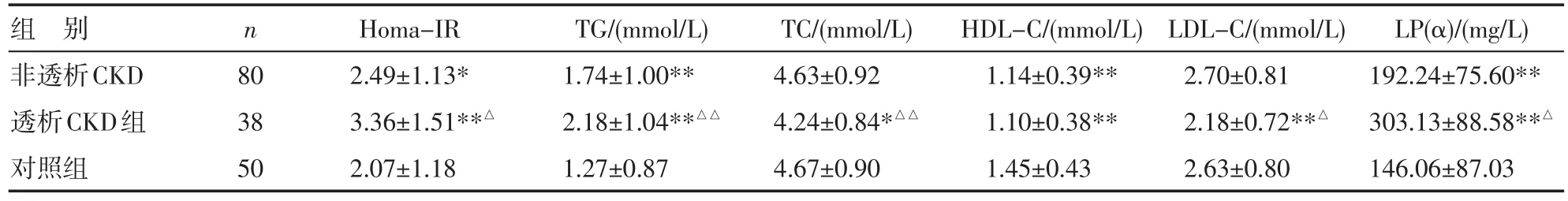
表1 (续) 非糖尿病CKD组与对照组各项指标比较(±s)
注:与对照组比较,*P<0.015,**P<0.01;与非透析CKD组比较,△P<0.05,△△P<0.01
组别非透析CKD透析CKD组对照组n 80 38 50 Homa-IR 2.49±1.13* 3.36±1.51**△2.07±1.18 TG/(mmol/L) 1.74±1.00** 2.18±1.04**△△1.27±0.87 TC/(mmol/L) 4.63±0.92 4.24±0.84*△△4.67±0.90 HDL-C/(mmol/L) 1.14±0.39** 1.10±0.38** 1.45±0.43 LDL-C/(mmol/L) 2.70±0.81 2.18±0.72**△2.63±0.80 LP(α)/(mg/L) 192.24±75.60** 303.13±88.58**△146.06±87.03
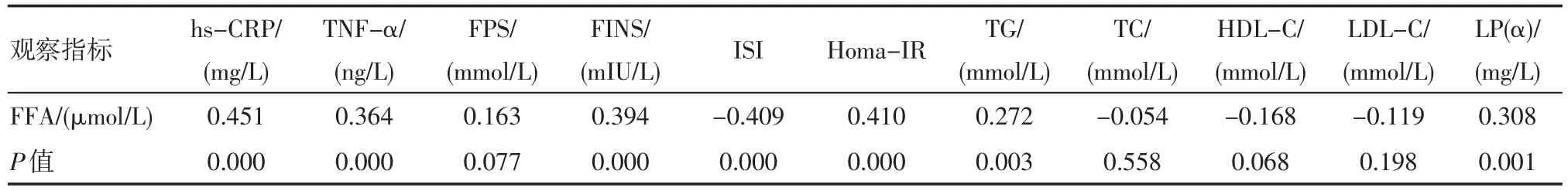
表2 非糖尿病CKD患者FFA与细胞因子、Homa-IR等指标相关性(γ)分析
非糖尿病CKD患者FFA水平与hs-CRP、TNF-α、FINS、Homa-IR、TG和LP(α)水平呈现明显正相关(P均<0.01),与ISI呈明显负相关(P<0.01)。提示FFA在CKD患者中与细胞因子、胰岛素抵抗关系复杂,我们推测hs-CRP、TNF-α等炎症因子可促进脂肪细胞的脂肪分解及FFA释放,引起高FFA血症。文献报道[6],高浓度FFA又可以通过下述途径干扰糖代谢,导致IR:①流入门静脉的FFA增多,使肝细胞胰岛素结合减少及肝细胞胰岛素受体介导的胰岛素降解加速而导致胰岛素抵抗。②FFA所致胰岛素抵抗也通过己糖胺合成途径。③FFA影响胰岛素下游信号系统。已有研究证明血浆FFA升高抑制胰岛素受体及胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)、胰岛素受体底物-2(insulin receptor substrate-2,IRS-2)酪氨酸磷酸化,抑制磷脂酰肌醇激酶-3(phosphatidylinositol kinase-3,PI-3)活性导致骨骼肌、脂肪细胞葡萄糖转移因子-4(glucose transporter-4,Glut4)向细胞表面转位减少,肌细胞胰岛素介导的葡萄糖摄取,减少及抑制糖原合成酶活性而致骨骼肌及肝糖原储存减少。④FFA对肝细胞的影响可能与蛋白激酶激活有关。⑤FFA促进前胰岛素原mRNA的表达,在转录水平促进前胰岛素原合成,造成胰岛素合成分泌增加。⑥FFA引起细胞内甘油三酯堆积,进而激活NO,且FFA不依赖于NO而具有独立引起β细胞坏死的能力。⑦在高胰岛素、高血糖状态下,高FFA影响糖代谢,包括抑制整体的糖处理,抑制骨骼肌葡萄糖摄取,抑制内脏葡萄糖合成。其次,FFA增多使肝糖产生增多,导致空腹血糖升高及高胰岛素血症。Homko[7]发现在餐后胰岛素、餐后FFA浓度升高的情况下,无论男性、女性均易出现FFA介导的外周胰岛素抵抗、肝脏胰岛素抵抗。同时,胰岛素和胰高血糖素等激素的分泌异常或生物效应的改变会导致机体释放和摄取FFA之间的平衡紊乱,致使血清FFA浓度升高,且IR又影响脂质代谢。
总之,FFA不仅与肥胖、糖、脂代谢紊乱、炎症显著相关,且参与CKD患者胰岛素抵抗的发生、发展,与IR共同成为预测糖耐量异常、高脂血症更为有效的指标。
[1]陈明卫,王佑民,胡红琳,等.血清肿瘤坏死因子-α、游离脂肪酸以及抵抗素与2型糖尿病患者胰岛素抵抗的关系[J].中国糖尿病杂志,2006,14(1):4-5.
[2]王海燕,王梅译.美国NKF.K/DOQI工作组.慢性肾脏病及透析的临术实践指南[S].北京:人民卫生出版社,2003.
[3]曾瑜,代碧珍,温向琼,等.非糖尿病肾病维持性血液透析患者胰岛素抵抗与脂质代谢紊乱的关系研究[J].陕西医学杂志,2009,38(9):1228-1230.
[4]魏莉莉,岑俊,顾谊铮,等.非糖尿病维持性血液透析患者脂肪因子与胰岛素抵抗的关系[J].中国血液净化,2010,9(2):109-111.
[5]郝丽杰,陈秉良.老年慢性肾衰竭患者胰岛素抵抗情况及分析[J].中国血液净化,2008,7(6):214-316.
[6]王涛,钟惠菊.游离脂肪酸与2型糖尿病及其心血管并发症[J].陕西医学杂志,2005,35(3):319-320.
[7]Homko CJ,Cheung P,Boden G.Effects of Free Fatty acids on glucose up take and utilization inhealthy women[J].Diabetes,2003,52(2):487-491.
Relationship Between Serum Free Fatty Acid and Cytokines and Insulin Resistance in Non-Diabetic Chronic Kidney Disease Patients
NI Xuwei, ZHANG Dezhong, LIU Yumei, et al. The People’s Hospital of Qingtian County,Qingtian(323900),China
Objective:To investigate the relationship between serum free fatty acid(FFA)and high sensitive C re⁃active protein(hs-CRP),tumor necrosis factorα(TNF-α),and insulin resistance in patients with non-diabetic chronic kidney disease(CKD).Methods:Serum FFA,fasting insulin(FINS),fasting plasma glucose(FPS), hs-CRP,TNF-α,and the lipid profile were measured and compared between 118 patients with non-diabetic CKD(non-dialytic 80 patients and dialytic 38 patients)and 50 normal controls.Insulin resistance was evaluated by using insulin sensitivity index and homeostasis model assessment-insulin resistance index(Homa-IR).Results: Serum FFA,hs-CRP,TNF-α,Homa-IR,triglyceride and lipoprotein(α)were significantly higher in non-diabetic CKD patients compared to those in normal controls(P<0.05 or P<0.01).The increase of serum FFA,hs-CRP, TNF-α,FINS,Homa-IR,triglyceride and lipoprotein(α)were higher in dialytic patients than those in non-dialytic patients(P<0.05 or P<0.01).In all patients,FFA was positively correlated with hs-CRP,TNF-α,FINS, Homa-IR,triglyceride and lipoprotein(α)but was negatively related to insulin sensitivity index(P<0.01).Conclusion:Serum FFA significantly increased in non-diabetic CKD patients and was closely correlated with insulin resistance.
non-diabetic chronic kidney disease free fatty acid high sensitive C-reactive protein tumor necrosis factor-α insulin resistance
2012-07-27
