几种水溶性化合物对印染废水中活性艳红K-2BP光解的影响
2013-05-09杨俊香
杨俊香
(鹤壁市环境保护监测站,河南鹤壁458030)
近些年来,活性染料由于性能优越被广泛用于纺织工业中,但因为印染废水中的污染物具有一定的毒性和稳定性而很难被传统的生物处理方法降解利用.为了解决这一问题,人们采用了吸附、纳米滤膜过滤、臭氧高级氧化、电化学等方法来降解印染废水[1-4].同时光催化氧化法由于其降解印染废水的高效性而受到广泛关注,有望替代传统的处理方法[5-6].
本文以活性艳红K-2BP为代表,选择几种较为常见的水溶性化合物作为影响因子,通过模拟实验研究这几种化合物对活性艳红K-2BP光解的影响,以期为光催化氧化作用对印染废水的降解提供理论依据.
1 材料与方法
1.1 试剂及仪器
FeCl3·6H2O、30%H2O2、KNO3均为分析纯,购于北京化学试剂公司;活性艳红染料K-2BP由河南某印染工厂提供.
所用仪器:SGY-I型多功能光化学反应仪(南京市斯东柯电器设备有限公司)、TU-1901双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司)、VIS-7220可见分光光度计(北京瑞利分析仪器公司).
1.2 试验方法
准确称取2.500 0 g活性艳红染料K-2BP,置于1 000 mL容量瓶中,加水定容,配制成2.5 g/L的母液.移取一定量的母液,分别添加不同浓度的双氧水、氯化铁和硝酸钠溶液配成的50 mg/L的K-2BP溶液,置于石英试管中光照(300 W汞灯),每隔一段时间取样,在534 nm最大波长处用分光光度计测定.所有光解实验进行黑暗对照试验以消除误差.
1.3 试验装置
实验所用反应器如图1所示.选用300 W中压汞灯(主波长365 nm)为光源,将其置于石英冷阱内,将冷却水通入冷阱冷却汞灯发出的热量,以保证反应温度为室温.具有磨口的石英冷阱插入盛有反应溶液的硬质玻璃反应器中(有效体积为500 mL),使反应溶液直接接受汞灯产生的光辐照.反应器上端具有采样口供取样用,底部的磁力搅拌装置可以使反应溶液均匀搅动.

图1 光解实验装置Fig.1 Photocatalytic reaction device
高压汞灯的光谱分布图如图2所示.
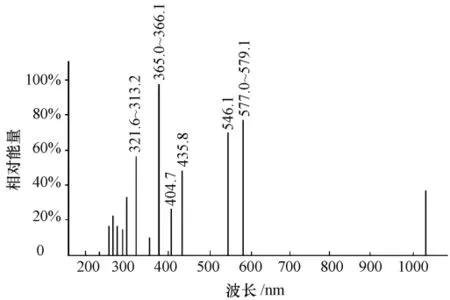
图2 高压汞灯的光谱分布Fig.2 Spectral distribution of high pressure mercury lamp
2 结果与分析
2.1 活性艳红K-2BP的光降解机理
将50 mg/L的活性艳红染料K-2BP溶液置于光解仪中进行光解实验.分别在光解时间达到0、20、40、60 min时取样,用TU-1901双光束紫外-可见分光光度计上进行全波长扫描,得到其降解不同时间后的吸收光谱,如图3所示.
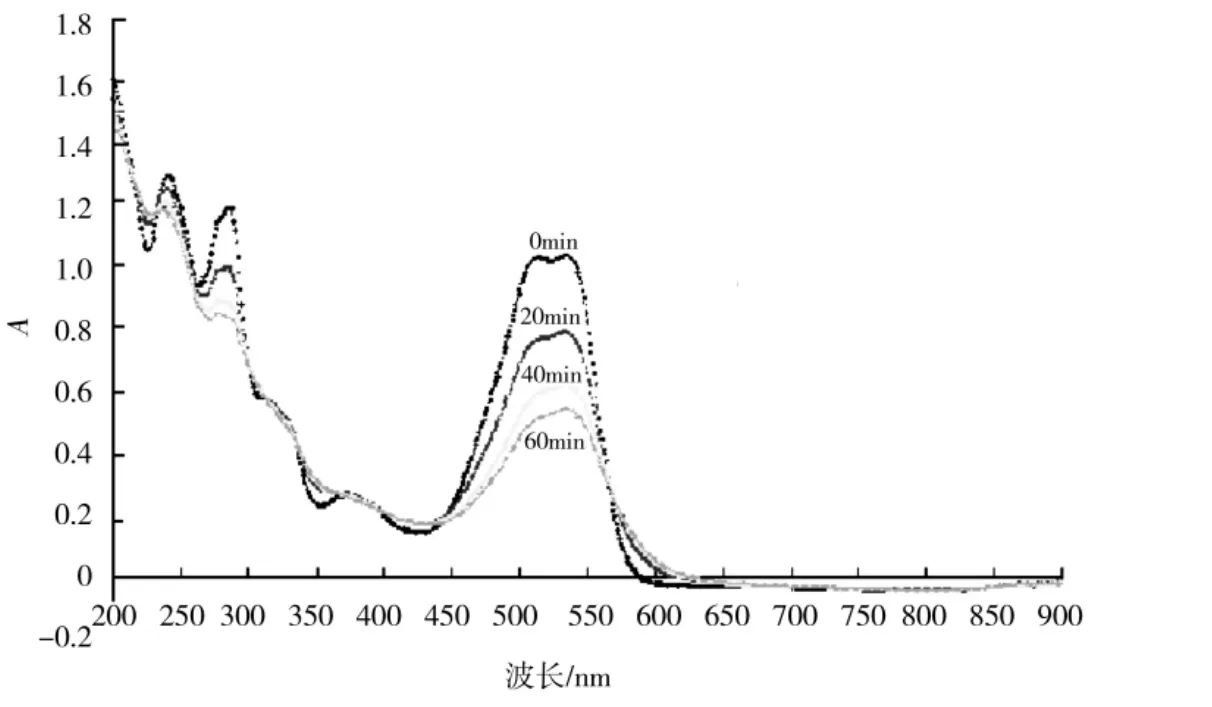
图3 K-2BP溶液在不同光解时间的光谱吸收Fig.3 UV-Vis spectra evolution of K-2BP during the photocatalytic reaction
由图3可知,随着降解时间的增加,吸收光谱中不同波峰幅度逐渐回落,而且没有新的波峰出现,说明K-2BP在光解过程极有可能是完全被矿化,没有新的污染物生成.
2.2 K-2BP的光解动力学
K-2BP的光解动力学方程采用一级动力学方程[7]:

将公式(1)积分变为:

式(2)中:k为光解速率常数;C0为染料的初始浓度;Ct为光照时间t时刻染料的残存浓度;当K-2BP红降解50%时,即Ct=C0/2时,所需的时间即为K-2BP红光解的半衰期,以t1/2表示,等于ln(2/k).而光解促进(抑制)率η可以用下式表示:

式(3)中,k0为不添加水溶性化合物时对K-2BP时的光解速率常数;ki为添加水溶性化合物后对混合溶液中K-2BP的光解速率常数,η若为正值则表示促进作用,若为负值则表示抑制作用.
表1为NO3-对K-2BP光解影响的动力学方程及相关常数.
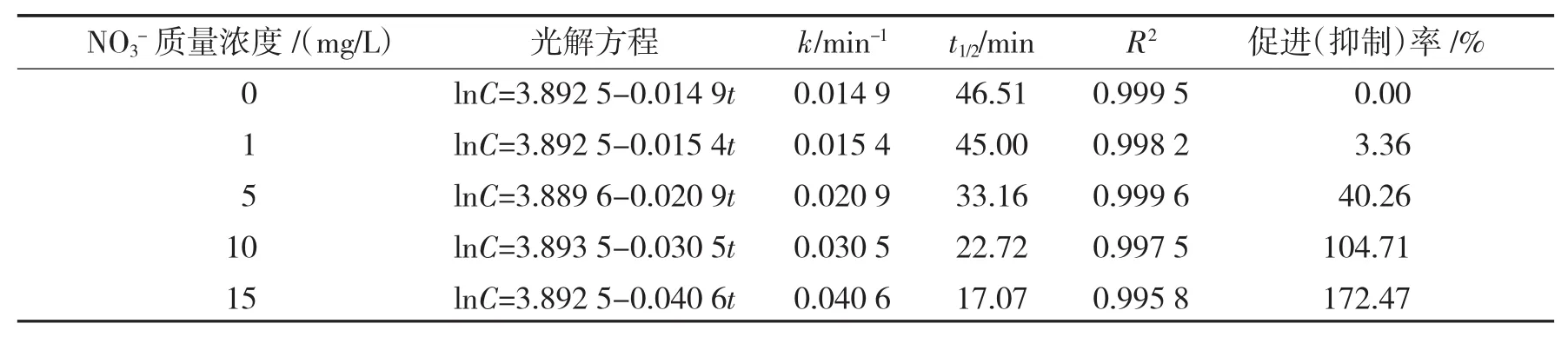
表1 NO3-对K-2BP光解影响的动力学方程及相关常数Tab.1 Photolytic constants of K-2BP with NO3-in water
由表1可知,K-2BP的光解行为可以很好地用一级反应动力学方程描述,其光解半衰期为46.51 min.
2.3 NO3-的影响
将一级反应动力学方程拟合的NO3-对染料光解影响的各种参数列于表1中.由表1可知,NO3-的存在明显促进了染料的光解.当添加质量浓度较低时,其对染料的光解促进率不高.比如,在添加质量浓度为1 mg/L时,其对染料的光解促进率只有3.36%.而当NO3-的添加质量浓度增加到5 mg/L以上的时候,明显促进对染料的光解,如在10 mg/L的时候光解促进率已超过100%,继续增大NO3-浓度促进效果则更加显著.
2.4 Fe3+的影响
将一级反应动力学方程拟合的Fe3+对染料光解影响的各种参数列于表2中.
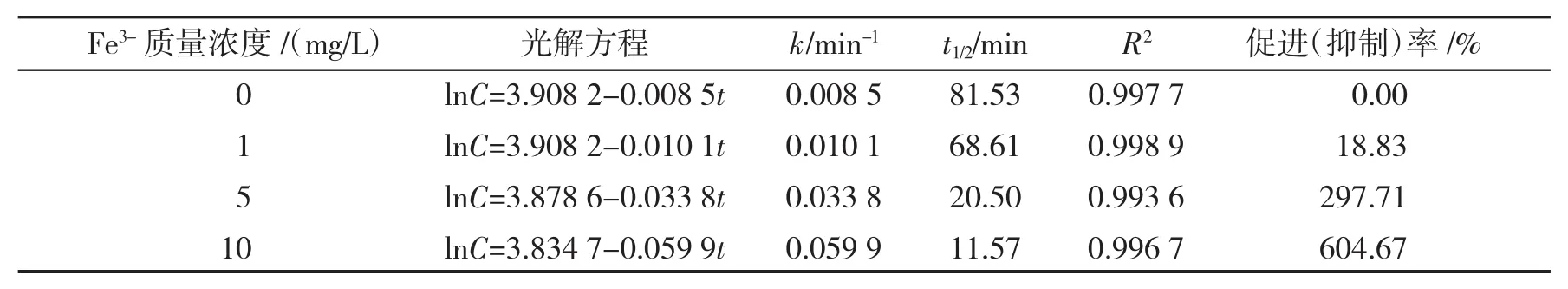
表2 Fe3+对K-2BP光解影响的动力学方程及相关常数Tab.2 Photolytic constants of K-2BP with Fe3+in water
由表2可知,Fe3+和NO3-一样,在较低的质量浓度时,对光解的促进效果不是非常明显.如在Fe3+的质量浓度为1 mg/L的时候,光解促进率只有18.83%;而当Fe3+的质量浓度稍稍增高时,光解速率增加的特别快,远超过100%,甚至在添加量为10 mg/L时,光解促进率可达到600%以上.添加Fe3+可以大大减小K-2BP的光解半衰期.
2.5 H2O2的影响
将一级反应动力学方程拟合的H2O2对染料光解影响的各种参数列于表3中.

表3 H2O2对K-2BP光解影响的动力学方程及相关常数Tab.3 Photolytic constants of K-2BP with H2O2 in water
由表3可知,H2O2的添加量在研究的质量浓度范围内对染料的光解具有非常显著的促进作用.其机理可能是,当水中存在的这些分子吸收光能后,由基态变成激发态,通过各种氧化剂或催化剂等吸收紫外辐射后生成强氧化性的·OH自由基引发化学反应使染料氧化分解[8-9].需要指出的是,有研究表明,当H2O2的添加量增至一定程度后,H2O2对光解的促进作用会转而变成对光解的抑制作用.这一现象在本文所研究的浓度范围内并未发现,我们将于后续工作中进一步研究.
3 结论
(1)K-2BP在汞灯照射下的光解行为符合一级反应动力学.
(2)NO3-的添加质量浓度对染料的光解有比较显著的影响,其添加质量浓度在5 mg/L以上,可使光解促进率达到40%以上;而Fe3+与H2O2的添加质量浓度对染料的光解有非常显著的影响,如在Fe3+与H2O2添加质量浓度为5 mg/L时,光解促进率均可超过100%.
(3)在这几种水溶性化合物存在的情况下,K-2BP的光解可能属于间接光解,其机制可能是添加的这几种化合物可以充当氧化剂或催化剂,吸收紫外辐射后生成强氧化性的·OH自由基引发化学反应使染料氧化分解.
[1]Mahmoodi N M,Arami M,Bahrami H,et al.Novel biosorbent (Canola hull):Surface characterization and dye removal ability at different cationic dye concentrations[J].Desalination,2010,264:134-142.
[2]Amini M,Arami M,Mahmoodi N M,et al.Dye removal from colored textile wastewater using acrylic grafted nanomembrane[J].Desalination,2011,267:107-113.
[3]Tehrani-Bagha A R,Mahmoodi N M,Menger F M.Degradation of a persistent organic dye from colored textile wastewater by ozonation[J].Desalination,2010,260:34-38.
[4]Maljaei A,Arami M,Mahmoodi N M.Decolorization and aromatic ring degradation of colored textile wastewater using indirect electrochemical oxidation method[J].Desalination,2009,249:1074-1078.
[5]Fu H B,Zhang S C,Xu T G,et al.Photocatalytic degradation of RhB by fluorinated Bi2WO6and distributions of the intermediate products[J].Environ.Sci.Technol,2008,42:2085-2091.
[6]Patil S R,Akpan U G,Hameed B H,et al.A comparative study of the photocatalytic efficiency of Degussa P25,Qualigens,and Hombikat UV-100 in the degradation kinetic of congo red dye[J].Desalination and Water Treatment,2012,46:188-195.
[7]傅献彩,沈文霞,姚天祥.物理化学[M].北京:高等教育出版社,1990:511.
[8]Vaughan P P,Blough N V.Photochemical formation of hydroxyl radical by constituents of natural waters[J].Environ.Sci.Technol,1998,32:2947-2953.
[9]Allen Lucas J M S,Allen S K.Formation of hydroxyl radical in illuminated surface waters contaminated with acidic mine drainage[J].Environ.Tox.Chem,1996,15:107-113.
