高浓度发酵中酵母菌性能调控及优化*
2013-05-05张琦李文林燕马海元王欣泽孔海南
张琦,李文,林燕,马海元,王欣泽,孔海南
1(上海交通大学环境科学与工程学院,上海,200240)2(长安大学环境科学与工程学院,陕西 西安,710064)
在合理控制情况下,高浓度乙醇发酵(浓醪发酵)能够有效提高设备利用率、减少单位产物所消耗的能源,并降低杂菌污染的风险,是提高乙醇发酵生产效率、降低成本的有效工艺手段。然而,高浓度基质和产物对酵母菌的抑制作用导致菌体发酵性能低下,进而限制最终目标产物浓度[1],仍是制约其工业化推广的重要因素。
本文分别分析在酵母菌乙醇发酵过程中基质和产物对酵母菌性能的影响,系统研究酵母菌在不同抑制物浓度下的生长和发酵性能的变化规律,并且比较了实际发酵过程中酵母自身所产的内源乙醇与实验中外源添加的乙醇对酵母菌发酵性能影响的差异,确定抑制物的作用阈值以及高浓发酵过程中的主要限制因子,为寻找减小抑制物对于酵母菌性能影响的有效措施,进一步提高木质纤维素乙醇生产效率和产物浓度提供了实验基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
酿酒酵母Saccharomyces cerevisiae BY4742(-60℃保存,上海交通大学环境科学与工程学院生物实验室提供)。
1.1.2 生长培养基
YPD 培养基[2],pH 4.0 ~5.0。
1.1.3 发酵培养基[3-4]
NH4Cl 3.0 g/L;KH2PO40.7 g/L;MgSO4·7H2O 0.35 g/L;CaCl20.1 g/L;NaCl 0.1 g/L;MnSO4·4H2O 0.11 g/L;CuSO4·5H2O 1.0 mg/L;ZnSO4·7H2O 21.0 mg/L;CoSO4·7H2O 4.0 mg/L;H3BO340.0 mg/L;Na2MoO4·2H2O 0.2 mg/L;FeSO414.4 mg/L。
1.1.4 发酵基质
木质纤维素的水解液中,葡萄糖占还原糖绝对比例可达70%[5],需着重研究以提高酵母菌对葡萄糖的转化率,故本研究采用葡萄糖作为发酵基质。
1.2 实验方法
1.2.1 种子培养
复苏后的酵母菌置于YPD液体培养基扩培,于全温振荡培养箱内进行,转速180 r/min,温度37℃,培养16~18 h。
1.2.2 间歇发酵
按既定浓度的酵母菌、营养液、基质和产物配制发酵反应液,而后将其置于集成控制自动化厌氧发酵罐内进行发酵,设置参数为pH 4.0,35℃,200 r/min,菌体浓度2 g/L。每批次实验均平行启用3个发酵罐同时同参数反应以控制误差。
1.3 样品分析方法
菌体浓度采用分光光度法检测[6-7],检测波长选用600 nm;基质(葡萄糖)和产物(乙醇)检测条件:岛津液相色谱仪,色谱柱BIO-RAD 910-5250,柱温65℃,RID-10A检测器,温度60℃,流动相超纯水,流速:0.8 mL/min,进样量 20 μL。
2 实验分析与讨论
2.1 高浓度基质对乙醇发酵的抑制
高浓发酵能够提高设备利用率,减少热能消耗和用水量,有效降低生产成本。但过高基质浓度所致的高渗环境,会减弱酵母菌细胞膜流动性及胞内关键代谢酶活性[9-10],从而降低酵母菌乙醇发酵性能。当基质浓度高于阈值后,继续提高基质浓度,产物将增长缓慢甚至停滞,造成原材料浪费。通过基质对酵母菌活性抑制作用的研究,能确定合理的基质投加量,在保证基质利用率及乙醇产率的前提下获取最高的经济效益。
实验中,设置的基质浓度分别为:40、80、120、160、200、280 g/L。每批次发酵时间 96 h,每隔 24 h取样。
2.1.1 基质对酵母菌生长的影响
图1为不同基质浓度下酵母菌浓度变化的对比图。当基质浓度低于160g/L时,菌体浓度随着基质浓度的提高而显著增加。这是因为葡萄糖是酵母细胞最重要的碳源,亦是重要的初期信号分子,酵母菌会根据外界基质变化来调节自身各种酶的表达水平及活性,达到最佳的代谢生长水平,最终达到最适种群密度[9]。所以在基质浓度较小时,不断提高的基质浓度改善了酵母菌的营养条件,酵母菌浓度随之增长。
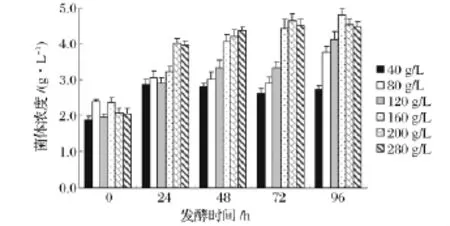
图1 不同基质浓度下酵母菌浓度随时间变化Fig.1 Variation of yeast concentration under different substrate concentration
当基质浓度大于160 g/L时,在反应初期,酵母菌对高渗环境作出应激反应,迅速提高种群密度以加快基质的总消耗速率,改善高渗环境,因而在前24小时有着较高的增长速率。但由于高浓度基质对酵母菌细胞膜流动性及胞内关键代谢酶的抑制作用,后期菌体增长速率明显放缓。比较发酵96 h内酵母菌的最大浓度,继续提升基质浓度,菌体浓度反而略有减小,可见高浓度基质对酵母菌生长繁殖存在一定的抑制作用。
图2为基质浓度与平均对基质菌体得率拟合图,随着基质浓度的逐渐升高,平均对基质菌体得率显著减小,即消耗单位的葡萄糖所生成的细胞数量逐渐下降,更多的葡萄糖消耗用以维持细胞能量,印证了高基质浓度对菌体生长繁殖的抑制作用。初始基质浓度S0和平均对基质菌体得率YX/S呈对数关系[11],具体如下式。

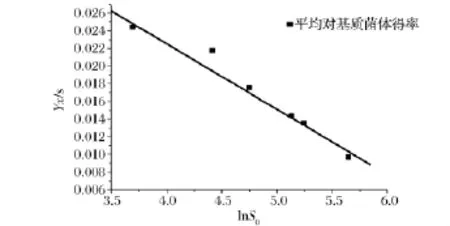
图2 基质浓度与平均对基质菌体得率拟合图Fig.2 Fitting of substrate concentration and average yeast yield to substrate
2.1.2 基质浓度对酵母菌乙醇发酵性能的影响
图3是不同基质浓度下发酵所得最大乙醇浓度变化曲线,基质浓度小于160 g/L时,产物浓度随基质增加显著提高;但当浓度大于160 g/L后,继续增加基质,最终乙醇浓度未见明显增长,一直稳定在53 g/L左右。因此,高于160 g/L的基质浓度对于乙醇发酵无实际意义,仅造成原材料的浪费。
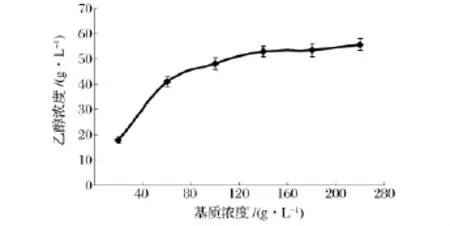
图3 不同基质浓度下最大乙醇浓度变化Fig.3 Maximum ethanol concentrations under different substrate concentration
图4是不同基质浓度下乙醇产率随时间变化关系图。随基质浓度增加,发酵所需时间相应增加:80 g/L至200 g/L时,反应需72 h,而280 g/L时,发酵96 h仍未完成。实验结果表明除了发酵负荷增加外,高浓度基质对酵母菌发酵活性的抑制亦是导致酵母菌性能下降及发酵反应时间延长的主要原因。
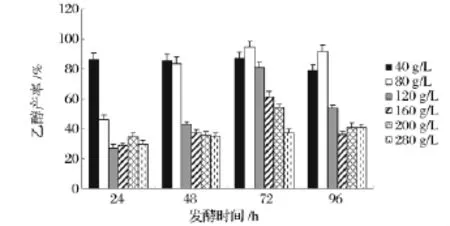
图4 不同基质浓度下乙醇产率变化Fig.4 Comparison of ethanol yields under different substrate concentration
就乙醇产率(实际乙醇产量与理论乙醇最大产量之比)而言,基质浓度为80 g/L时在48h能达到84%乙醇产率,而在72 h时,产率进一步提升至94%,乙醇最终浓度可达40 g/L,达到了营养条件与渗透压的平衡,是最佳的发酵基质浓度。但在实际工业生产过程中,并非追求最高的乙醇产率,而是单位时间内单位生产设备所产生的乙醇总量。因而即使最终产率略低,只要同生产一周期内最终获得更高的乙醇浓度,又不至于造成基质的大量浪费,才是符合生产工艺要求的基质浓度。如当基质浓度为120 g/L时候,虽然由于高浓度基质对酵母性能抑制而导致菌体对基质得率和最终乙醇产率的下降,但仍能达近80%的乙醇产率,所得乙醇浓度为48 g/L,为工艺可接受范围。
基质浓度为160 g/L时,所得乙醇浓度为53 g/L,产率降至65%,酵母菌活性受到较大程度的抑制,但基质的投加仍能提升最终产物浓度。而当基质浓度大于160 g/L后,继续增加基质投加量,乙醇产率和发酵速率急剧下降,相应地,产物最高浓度几乎不再增加,甚至略有减小,浪费大量原材料和时间。基质浓度为280 g/L时,产率仅为40%,最终产物浓度为55 g/L,酵母菌的发酵性能受到了严重抑制。
因此,在实验条件下160 g/L为基质的最大投加浓度,高于该值时,酵母生长和发酵性能急剧下降,继续增大基质浓度对发酵已无实际意义。对于实验酵母菌株的性能改进和发酵工艺的优化是提高工业生产过程中投加最高基质浓度及生产效益的有效措施。
2.2 产物对乙醇发酵的影响
乙醇是酿酒酵母厌氧发酵的重要产物,但对酵母细胞本身又是毒素和抑制剂[12]。在高浓发酵过程后期,存在着基质和产物的协同抑制作用。因而在研究产物乙醇的单独抑制作用时,需模拟出低基质浓度高产物浓度的发酵状态,即在低基质浓度的初始反应条件下,额外加入不同浓度乙醇,从而得出产物对厌氧乙醇发酵过程中酵母菌性能的单独抑制作用。
实验中,设置的初始添加乙醇浓度梯度为0、10、20、30、40、50、60、70、80 g/L,基质浓度均选为 80 g/L,发酵96 h,每隔24 h取样。
2.2.1 产物对酵母菌生长抑制
图5是不同初始乙醇浓度下酵母菌生长情况对比。
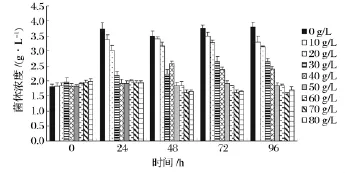
图5 不同初始乙醇浓度下菌体浓度随时间变化Fig.5 Variation of yeast concentration under different initial ethanol concentration
初始添加的乙醇对于酵母菌的增长具有抑制作用,在低浓度乙醇(小于30 g/L)情况下,菌体量的增幅虽随着乙醇浓度提高缓慢减小,但最高菌体浓度对比初始浓度仍有70%以上的增长,且菌体浓度在24 h已达最大值,外源乙醇对于酵母菌增长的抑制作用不明显;而在较高乙醇浓度(30~50 g/L)下,酵母菌的浓度最高只增长了30%左右,酵母菌的生长开始受到了较严重的抑制,同时酵母菌的延滞适应期也明显增加,对于初始添加40 g/L乙醇时,酵母菌在24 h基本未增长,在48 h达最大浓度,而初始添加50 g/L乙醇时,前48 h菌体均处于停滞期,72 h才达最大浓度;继续增高乙醇浓度,酵母菌在整个实验时间段内均增长非常缓慢,菌体浓度增长率均小于10%,当乙醇浓度大于70 g/L后,菌体浓度完全停止增加,甚至略有减小,酵母菌的生长繁殖由于受到了高浓度产物的强烈抑制作用已完全停止。
2.2.2 产物对酵母菌乙醇发酵性能的抑制
虽然乙醇在低浓度时对于酵母菌的生长无明显抑制作用,但对于酵母菌葡萄糖代谢活性却有着显著抑制作用。由图6不同初始浓度下葡萄糖转化率比较可得,就最终的葡萄糖的转化率而言,随着乙醇添加量的增加而迅速减小:在空白对照实验中,酵母菌96 h能够消耗所有的葡萄糖,乙醇浓度10 g/L时,转化率为60%;而在20 g/L时,葡萄糖转化率进一步下降到只有30%;乙醇浓度大于70 g/L后,葡萄糖几乎不再消耗,酵母菌对葡萄糖的代谢受到严重抑制。
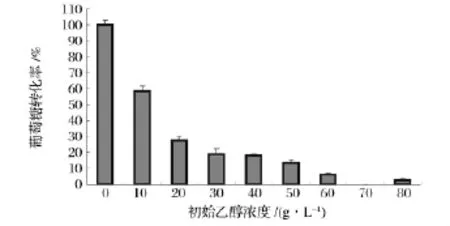
图6 不同初始乙醇浓度下葡萄糖转化率比较Fig.6 Comparison of glucose consumption rate under different initial ethanol concentration
通过对比图6和图7可以得出,葡萄糖转化率和乙醇产率变化规律非常一致,酵母菌消耗的葡萄糖几乎均有效转化为乙醇。由此可推断,在乙醇发酵过程中,葡萄糖的转运和代谢是主要限制性因素,是整个发酵过程中限速步骤[13-14],最终乙醇产率低下主要原因是受到上游代谢途径中葡萄糖转化率低下所制约。因而提高糖酵解途径及糖转运系统中关键酶在高乙醇浓度下的活性是加强酵母菌乙醇发酵性能的重要措施。
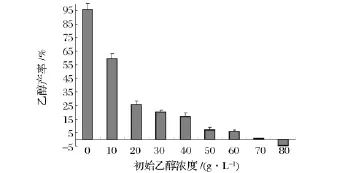
图7 不同初始浓度乙醇下乙醇产率变化Fig.7 Comparison of ethanol yield under different initial ethanol concentration
鉴于图5中所示不同乙醇浓度下酵母菌浓度存在较大差异,为了排除菌体浓度对乙醇发酵性能的影响,故采用单位质量酵母菌单位时间所产乙醇质量即乙醇发酵速率[15]来表征在不同乙醇浓度下的酵母菌实际发酵性能。
图8是不同的初始乙醇浓度下乙醇发酵速率的变化曲线。
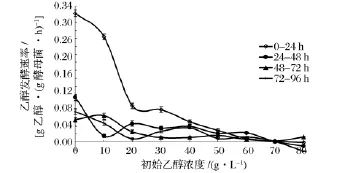
图8 不同初始浓度乙醇下乙醇发酵速率变化Fig.8 Comparison of ethanol fermentation rate under different initial ethanol concentration
由图8可得:(1)随着初始乙醇浓度的提高,各时段乙醇发酵速率总体呈下降趋势。对于各反应时间段,0~24 h发酵速率差异最大,而反应后期,由于本身乙醇发酵速率均较小,因而在不同初始乙醇浓度下发酵速率差异性较小,图中24~48 h、48~72 h、72~96 h 3条曲线较0~24 h明显平缓。(2)不同初始乙醇浓度下发酵速率变化也存在明显区别。在较低初始乙醇浓度(小于30 g/L)情况下,前24 h的乙醇发酵速率显著高于后期的乙醇发酵速率,发酵后期,由于酵母菌自身产生的内源乙醇叠加抑制作用,加之底物和营养物质消耗,酵母菌所处系统环境更为恶劣;相反地,对于高浓度初始乙醇的发酵环境,整个过程中乙醇发酵速率无显著变化,甚至部分后期发酵速率高于前期,这是由于系统本身的乙醇增量不明显,并且底物和营养物质的消耗均很少,环境变化不大,因而逐渐适应高浓度乙醇环境的酵母菌发酵性能可保持稳定,甚至在后期略有提升。
在模拟的高产物低基质浓度发酵环境中,乙醇对酵母菌生长和发酵性能具有严重抑制作用,是影响最终木质纤维素乙醇生产效益的重要因素。究其原因,除了严重抑制酵母细胞糖代谢和转运途径外[14],乙醇还抑制细胞膜上ATP酶活性导致质子浓度梯度的破坏,造成胞内营养元素的流失,同时又改变细胞膜上的磷脂组分和麦角固醇含量,增加细胞膜非特异透过性,削弱其对酵母细胞的保护作用;另外乙醇还引起胞内线粒体氧化损伤,进一步降低了酵母菌的乙醇发酵性能[16-17]。正是由于乙醇对酵母细胞多方面的毒害作用,酵母菌对乙醇非常敏感,为保持酵母菌较高生长和发酵活性,需保证发酵液中乙醇浓度小于30 g/L。当产物浓度大于酵母菌对外源乙醇的最大耐受浓度70 g/L后,菌体生长和发酵完全停止。设法降低产物的抑制作用是提升乙醇产率最为直接和有效的途径。
2.2.3 内外源乙醇抑制对比
2.2.1 和2.2.2的实验结果证明了产物乙醇对于酵母菌厌氧乙醇发酵的强烈抑制作用,但模拟实验和实际发酵结果还存在一定区别:如在基质抑制实验中得到酵母乙醇发酵的实际过程中,最大产物浓度仅55 g/L,此结果低于外源乙醇抑制实验中所得到的最大耐受浓度70 g/L。出现此现象的原因除了发酵初期高浓度基质对酵母菌乙醇发酵性能的协同抑制作用外,外源添加的乙醇与酵母菌自身发酵所产生的内源乙醇对于酵母菌的抑制作用的差异也有可能是重要原因,因此有必要系统对比相同浓度下内源和外源乙醇对于酵母发酵的抑制作用。
设置的外源乙醇浓度为 10、20、30、40、50、60、70、80 g/L,只测定不同外源乙醇浓度下0 h,12 h的酵母菌浓度、葡萄糖浓度和乙醇浓度,以排除后期酵母菌发酵产生的内源乙醇抑制作用的干扰;内源乙醇抑制对比实验取样时间为每隔12 h,共96 h,初始不添加乙醇,其余实验及检测条件保持完全一致不采用。
内外源乙醇浓度酵母菌比增长速率的对比情况同见图9。当乙醇浓度小于15 g/L时,内外源乙醇对于酵母菌的生长抑制作用没有明显区别;乙醇浓度大于15 g/L时,与外源乙醇环境相比较,在内源乙醇环境中的酵母菌比增长速率减小幅度明显加剧。在28 g/L内源乙醇下,菌体比增长速率已降为零,而对于外源乙醇,酵母菌耐受浓度达70 g/L,高浓度情况下内源乙醇对于酵母菌生长的抑制作用显著大于外源乙醇。
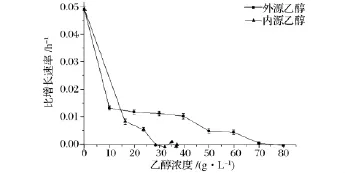
图9 内外源乙醇下12h酵母菌平均比增长速率对比图Fig.9 Comparison of 12 h-averaged specific yeast growth rate under endogenous and exogenous ethanol
图9内外源乙醇作用下乙醇发酵速率的对比曲线见图10。在相同浓度下,内源乙醇作用下酵母菌乙醇发酵速率均低于外源乙醇作用下的发酵速率,即酵母菌对内源乙醇更为敏感,如当乙醇浓度为38 g/L时,内源乙醇下发酵速率已经很低,仅为0.005 g乙醇/(g酵母菌·h),而外源乙醇下发酵速率仍大于0.200 g乙醇/(g酵母菌·h)。由图10可得,就乙醇发酵速率随乙醇浓度的衰减规律,外源乙醇下呈线性衰减,而内源乙醇时则为高次幂衰减[18]。
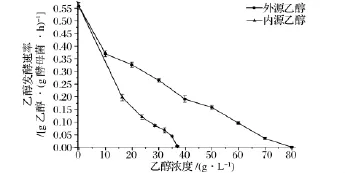
图10 内外源乙醇下12 h乙醇平均发酵速率对比图Fig.10 Comparison of 12 h-averaged ethanol fermentation rate under endogenous and exogenous ethanol
在对比实验中,所选基质浓度为80 g/L,而综合先前的实验结果,当反应的基质浓度更高时,由于酵母菌对高浓发酵环境的逐渐适应,其乙醇耐受浓度有所增加,所以酵母菌发酵对内源乙醇最大耐受浓度为2.1所述实际发酵中所获得的最高产物浓度55 g/L。
综上所述,无论对酵母菌的增长抑或发酵性能,内源乙醇的抑制作用均大于外源乙醇的抑制作用。分析原因,主要由于发酵过程中乙醇向细胞外散速率有限,导致酵母细胞内乙醇浓度高于胞外[19],而细胞内部高浓度乙醇的长时间积累以及向胞外的持续渗透不断抑制着酵母细胞的生理活性,其影响程度大于高浓度外源乙醇对酵母菌的冲击。另外,由于细胞膜的保护作用,减缓降低了外源乙醇向细胞内的渗透和毒害作用,减小及延缓了乙醇对细胞内酶活及胞内器官的损害。所以,若在产物乙醇累计至高浓度后才提取,可能对于恢复酵母活性以提高最终乙醇发酵效率作用不大,因为胞内高浓度乙醇的积累及向外渗透过程已经造成了酵母细胞不可逆破坏;而若通过循坏气提、真空提取法等发酵提取耦合技术,始终将乙醇维持在较低浓度,虽可以有效减小产物对酵母菌的抑制作用[20-21],却对工艺提出更高要求,亦进一步增加生产成本,需要对两者作出权衡。
在实际发酵过程中的高浓度内源乙醇环境下,酵母菌的生长和发酵均受到了更严重的抑制,酵母菌的最大耐受浓度小于70 g/L,所以在高产物浓度下,提高酵母菌的生长及发酵活性对于保证最终的高乙醇产量和生产效益显得更为重要。
2.3 高浓发酵中酵母菌性能关键指标
通过以上实验,定量表述了高浓发酵中酵母菌Saccharomyces cerevisiae BY4742在不同基质和产物浓度下生长及发酵活性的变化情况,并得出了实验酵母菌的性能关键指标,即其对基质和产物的耐受浓度。详见表1。

表1 Saccharomyces cerevisiae BY4742发酵关键浓度指标Table 1 Key concentrations index for Saccharomyces cerevisiae BY4742
3 总结与展望
本文以燃料乙醇生产环节中重要的发酵步骤为研究对象,探索了基质和产物对厌氧乙醇发酵过程中酵母生长及发酵性能的抑制作用,确定了基质对酵母菌性能抑制的临界浓度值以及酵母菌所能耐受的最大产物浓度,同时比较了内源和外源乙醇对酵母菌抑制程度的差异,所得结论如下:
(1)酵母菌乙醇发酵的最佳基质浓度为80 g/L,乙醇产率可达94%。继续提高基质浓度,虽然乙醇产率有所下降,但仍能达到80%,且发酵所产乙醇浓度也不断增加,可至55 g/L;当基质浓度大于临界值160 g/L后,由于受到高浓度基质的显著抑制作用,产率降至65%以下,且最终发酵所得乙醇浓度和最终菌体浓度都几乎不再增加,甚至略有减小,基质浓度继续提高对于乙醇发酵已无实际意义。
(2)产物乙醇对于酵母菌的生长和发酵性能具有显著抑制作用,是高浓发酵过程中制约乙醇产量的重要因素。
(3)内源乙醇对酵母菌生长及乙醇发酵性能的抑制作用均大于外源乙醇。单就乙醇发酵而言,酵母菌对于外源乙醇的最大耐受浓度为70 g/L,对内源乙醇该浓度则为55 g/L。所以,设法保证酵母菌在高浓度产物下的活性是提高乙醇总产量进而推广木质纤维素制乙醇工业化生产的最为直接和关键措施。
对于减弱乙醇的抑制作用、提高酵母活性,还可从以下几方面进行:
(1)筛选、驯化或通过基因工程改造酵母菌,取得高乙醇耐受性酵母菌株,保证其仍能在高浓度乙醇环境中保持较高活性,以减小乙醇抑制作用。
(2)反应进程中及时添加酵母所需微量元素及其他营养物质,以弥补反应中营养物质流失及消耗而导致的酵母活性降低的问题。
(3)反应至一定进程后,及时提取发酵液中乙醇,同时添加少量高活性新鲜酵母,以达到降低最终残糖浓度、提高乙醇产率之目的。
[1] Puligundla P,Smogrovicova D,Obulam V S R,et al.Very high gravity(VHG)ethanolic brewing and fermentation:a research update[J].Journal of Industrial Microbiology& Biotechnology,2011,38(9):1 133-1 144.
[2] 乔宗伟,张文学,张丽莺,等.浓香型白酒糟醅微生物分离培养基的选择研究[J].酿酒科技,2004,25(6):30-32.
[3] Anastassiadis S,Kamzolova S,Morgunov I,et al.Comparative study of the effect of iron on citrate-producing yeast growing on different substrates.Communicafing current research and educational topics and trends in applied microbiology[C].Bajadoz Spain:Formatex,2007:308-314.
[4] 曹宪周,牛芳方,杨兆明,等.各种维生素及微量元素在酵母菌生长过程中的优化[J].粮油加工,2009,40(10):121-123.
[5] Katahira S,Mizuike A,Fukuda H,et al.Ethanol fermentation from lignocellulosic hydrolysate by a recombinant xylose and cellooligosaccharide assimilating yeast strain[J].Applied Microbiology and Biotechnology,2006,72(6):1 136-1 143.
[6] 严益民.比浊法在测定发醇液菌体浓度中的应用[J].抚顺石油学院学报,2001,21(1):23-26.
[7] 杨帆,李淑梅,陈萍,等.发酵过程中菌液浓度的检测[J].光谱实验室,2009,26(6):1 643-1 645.
[8] 李伟军,韦新桂,丛威,等.高效液相色谱法同时分析低浓度的葡萄糖,乙醇和甘油[J].色谱,2000,18(2):170-172.
[9] 汤佳鑫,王继花,俞志敏,等.渗透压对酿酒酵母胞内代谢关键酶活性的影响[J].酿酒科技,2008,29(5):45-49.
[10] Thomas K,Ingledew W.Production of 21%(v/v)ethanol by fermentation of very high gravity(VHG)wheat mashes[J].Journal of Industrial Microbiology & Biotechnology,1992,10(1):61-68.
[11] 吕欣,李永飞,段作营,等.不同基质浓度对酒精发酵的影响[J].食品与发酵工业,2003,29(7):21-23.
[12] 贺家明,赵祥颖.酵母耐乙醇性状及提高其乙醇耐性的途径[J].山东食品发酵,1999,29(3):6-11.
[13] Alexandre H,Charpentier C.Biochemical aspects of stuck and sluggish fermentation in grape must[J].Journal of Industrial Microbiology& Biotechnology,1998,20(1):20-27.
[14] 蒋常德.木薯燃料酒精浓醪发酵工艺研究[D].南宁:广西大学,2008:15-20.
[15] Nagodawithana T W,Steinkraus K H.Influence of the rate of ethanol production and accumulation on the viability of Saccharomyces cerevisiae in"rapid fermentation"[J].Applied and Environmental Microbiology,1976,31(2):158.
[16] 张秋美,赵心清,姜如娇,等.酿酒酵母乙醇耐性的分子机制及基因工程改造[J].生物工程学报,2009,25(4):481-487.
[17] Chi Z,Arneborg N.Relationship between lipid composition,frequency of ethanol-induced respiratory deficient mutants,and ethanol tolerance in Saccharomyces cerevisiae[J].Journal of Applied Microbiology,1999,86(6):1 047-1 052.
[18] Dombek K,Ingram L.Nutrient limitation as a basis for the apparent toxicity of low levels of ethanol during fermentation[J].Journal of Industrial Microbiology& Biotechnology,1986,1(4):219-225.
[19] Dombek K,Ingram L.Determination of the intracellular concentration of ethanol in Saccharomyces cerevisiae during fermentation[J].Applied and Environmental Microbiology,1986,51(1):197.
[20] 董永胜,王立言,王瑞明,等.CO2气载乙醇固态发酵分离耦合过程的初步研究[J].生物加工过程,2005,3(1):54-57.
[21] Nguyen V D,Kosuge H,Auresenia J,et al.Effect of vacuum pressure on ethanol fermentation[J].Journal of Applied Sciences,2009,9(17):3 020-3 026.
