选择性5-羟色胺再摄取抑制剂对抑郁症患者睡眠结构的影响及与临床疗效的关系研究
2013-05-04张斌郝雪利李雪丽刘武汉
张斌,郝雪利,李雪丽,刘武汉
·论著·
选择性5-羟色胺再摄取抑制剂对抑郁症患者睡眠结构的影响及与临床疗效的关系研究
张斌,郝雪利,李雪丽,刘武汉
目的探究选择性5-羟色胺再摄取抑制剂(SSRIs)对抑郁症患者睡眠结构的影响及与临床疗效的关系。方法从多导睡眠图(PSG)数据库选择了26例接受SSRIs治疗2周以上的抑郁症患者(治疗组),并同时选择了24例近3个月未接受药物治疗的抑郁症患者(未治疗组)。评估患者睡眠情况,采用汉密尔顿抑郁量表24项版本(HAMD-24)评估患者治疗前后的抑郁状况,采用Logistic回归分析抑郁症患者睡眠结构变化与临床疗效的关系。结果治疗组和未治疗组的睡眠长度、睡眠潜伏期、非快速动眼时相睡眠(NREM)Ⅱ期与Ⅲ期的睡眠比例差异均无统计学意义(P>0.05)。经过SSRIs治疗,治疗组进入快速动眼时相(REM)的时间与未治疗组相比缩短〔(77±30) min vs.(146±64)min〕,差异有统计学意义(P=0.000),并进入正常范围;治疗组的NREMⅠ期睡眠比例与治疗组相比〔(14±5)%vs.(18±8)%〕和微觉醒指数(AI)〔(14±5)次/h vs.(18±6)次/h〕均减少,但AI仍高于正常值(<5次/h),差异均有统计学意义(P<0.05)。治疗组与未治疗组HAMD-24得分间差异有统计学意义〔(17± 6)分vs.(27±10)分,P=0.007〕。Logistic回归显示治疗组患者的REML越短〔OR=0.627,95%CI(0.517,0.923)〕和AI越低〔OR=0.839,95%CI(0.721,0.987)〕,就越容易显示出临床疗效。结论抑郁症的REM睡眠异常应该是抑郁症的核心睡眠节律异常,支持了抑郁症的睡眠时相前移假说;睡眠结构的改变影响临床疗效。
选择性5-羟色胺再摄取抑制剂;睡眠结构;抑郁症;临床疗效
多导睡眠图(PSG)是睡眠研究的客观评价工具。根据PSG成人睡眠可以被分为快速动眼时相(REM)睡眠和非快速动眼时相(NREM)睡眠。NREM进一步分为I、II、III期睡眠。其中III期睡眠又称为慢波睡眠(SWS)。REM睡眠主要与认知相关,而SWS主要与机体修复有关[1]。抑郁症通常具有三方面的睡眠特征:(1)总体改变:睡眠持续性下降、睡眠时间减少、睡眠潜伏期延长和觉醒增加;(2)NREM睡眠: SWS睡眠减少和SWS的delta波比例降低;(3)REM睡眠: REM潜伏期(REML)减少、首个REM睡眠增长和快速眼动密度增加[2-3]。前两个特征不具有特异性,而REM睡眠特征则是抑郁症的特征性睡眠结构改变[2],这些特征性睡眠结构改变提示抑郁症可能存在日周期异常。抑郁症的睡眠时相前移假说得到了大多数睡眠学家的认可[4],而且临床研究显示随着抑郁症异常睡眠的改善抑郁症状也会得到相应的改善[5]。选择性5-羟色胺再摄取抑制剂(SSRIs)是目前治疗抑郁症的一线药物[6],根据PSG研究,SSRIs可以减少REM睡眠,并且延长REML已达到改善抑郁的目的,但是它同时也因为压制SWS、增加觉醒和减少睡眠时间与效率而降低睡眠质量,10%~20%患者在治疗过程中主诉失眠[7]。然而,此类研究多是来源于氟西汀的研究[8-10],其他SSRIs的研究并不多。本研究将通过PSG来观察多种SSRIs对抑郁症患者的睡眠结构的影响及其与临床疗效之间的关系。
1 对象与方法
1.1 研究对象
1.1.1 SSRIs治疗的抑郁组(治疗组)来自广东省精神卫生研究所的PSG资料库(2006年11月—2009年11月),患者必须满足以下所有标准:(1)根据《疾病和有关健康问题的国际统计分类(第10版)》(international classification of diseases,ICD-10),诊断为抑郁发作(F32)或复发性抑郁障碍(F33)[11];(2)接受SSRIs治疗2周以上;(3)不符合ICD-10其他精神心理障碍;(4)两性均可;(5)18~65岁。再次评估纳入患者的临床和PSG数据,如果发现以下问题,则剔除该资料:(1)睡眠呼吸暂停综合征(OSAHS):睡眠呼吸暂停指数(AHI)>15次/h;(2)周期性肢体运动障碍(PLMS):周期性肢体运动指数(PLMI)>15次/h;(3)其他中重度的睡眠障碍;(4)诊断明确的神经系统疾病。26例患者最终符合以上要求,组成治疗组,平均年龄为(36.9± 2.8)岁,男11例(占42.3%),女15例(占57.7%)。1.1.2未接受药物治疗的抑郁组(未治疗组)在同期的PSG资料库,存在近3个月未接受药物治疗的抑郁症患者24例,组成未治疗组。除了近3个月未接受药物治疗以外,其余标准与治疗组相同。平均年龄为(37.3±4.1)岁,男10例(41.7%),女14例(58.3%)。未治疗组和治疗组之间的性别和年龄具有可比性。
1.2 研究方法
1.2.1 PSG数据采集和分析所有PSG数据均使用Embla N7000多导睡眠监测系统(冰岛Medcare公司)采集。PSG监测主要包括脑电活动(EEG:C3-A2,C4-A1)、颌肌和胫骨前肌的肌电活动(EMG)、双侧眼电活动(EOG)、心电活动(ECG)、口鼻气流、胸腹运动、血氧饱和度和鼾声。根据2007版美国睡眠研究会(AASM)标准[12]判定睡眠分期和睡眠相关事件。PSG指标主要包括各个睡眠分期比例以及总卧床时间(TIB)、总睡眠时间(TST)、实际睡眠时间(AST)、睡眠效率(SE=AST/TIB)、睡眠潜伏期(SL)、REML和微觉醒指数(AI)。
1.2.2 抑郁症状的评定汉密尔顿抑郁量表(HAMD)是最早应用于评定抑郁症状的量表之一[13]。本研究采用了24项版本(HAMD-24),包括有24个症状项目,其中13个精神症状项目按0~4级评分,11个躯体症状按0~2级评分,总分越高病情越重。本研究中,HAMD-24减分率>50%作为临床治疗有效的标准。
1.2.3 SSRI种类和剂量的换算26例治疗组的抑郁症患者分别接受了不同SSRIs的治疗,包括3例氟西汀、6例帕罗西汀、6例舍曲林、5例西酞普兰和6例艾司西酞普兰,治疗时间为2周至37周(中位数为3周)。根据Gartlehner等[14]的方法,我们将所有SSRI药物剂量分为低、中和高3个等级,以便不同药物间的剂量比较。调整后,低剂量7例、中剂量13例、高剂量6例。
1.3 统计学方法统计分析采用SPSS 16.0软件完成。计量资料以(±s)表示,两组间比较采用t检验。应用Logistic回归分析在治疗组中探索临床治疗有效与无效患者之间的内在差异。P<0.10在Logistic回归分析中有统计学意义,P<0.05在其他统计学检验中有统计学意义。
2 结果
就睡眠结构而言,治疗组和未治疗组之间睡眠长度相关指标(TIB、TST、AST)和SE差异均无统计学意义(P>0.05)。两组SL和II期与III期的睡眠比例也相似。未治疗组REML明显长于正常范围(60~90 min),而且未治疗组的REM期睡眠比例也低于正常值(20%~25%),与治疗组相比差异均有统计学意义(P<0.05)。经过SSRIs治疗,治疗组REML缩短,并进入正常范围。治疗组的I期睡眠比例和AI与未治疗组相比均减少,但AI仍高于正常值(5次/h),差异均有统计学意义(P<0.05)。此外,治疗组的HAMD-24总分与未治疗组相比差异有统计学意义(P<0.05,见表1)。
根据HAMD-24减分率>50%,26例治疗组患者被分为16例(61.5%)治疗有效者和10例(38.5%)治疗无效者。为了控制年龄、性别、SSRIs剂量、SSRIs治疗时间和睡眠结构特征(睡眠时间、各个睡眠分期比例、SE、SL、REML和AI)的相互影响,采用Logistic回归探索了它们对疗效的内在影响。结果显示治疗组患者的REML越短和AI越低,就越容易显示出临床疗效,见表2。
表1 两组患者睡眠结构特征和抑郁严重程度的比较(±s)Table 1 Comparison of depressive severity and sleep architecture between two groups
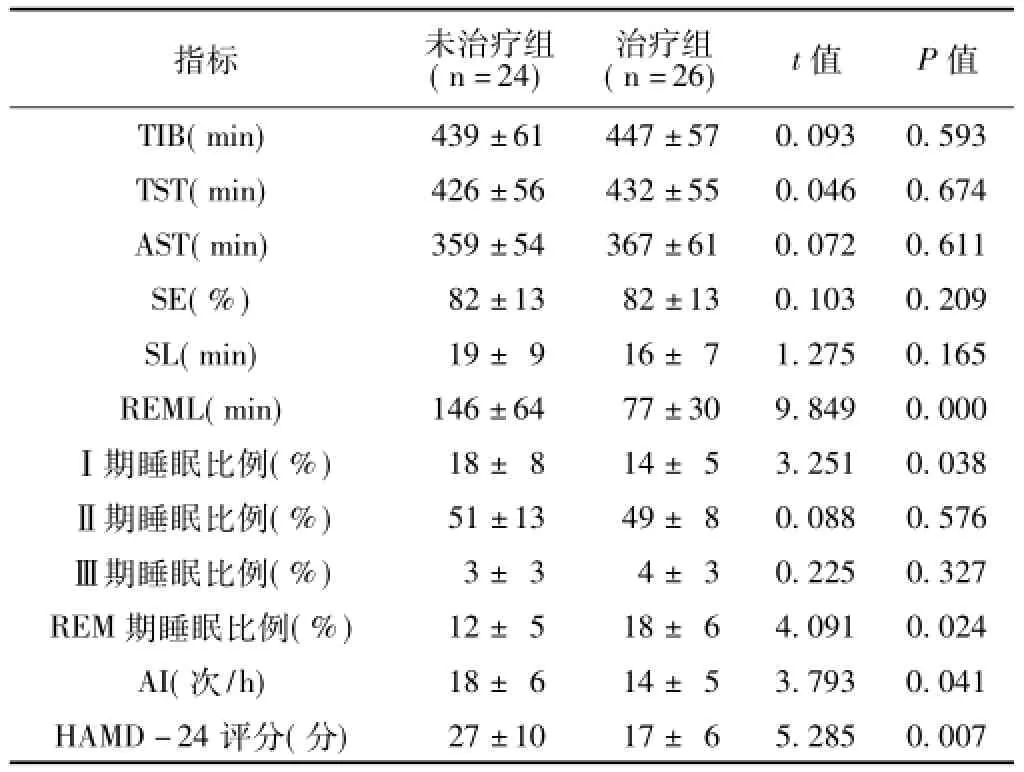
表1 两组患者睡眠结构特征和抑郁严重程度的比较(±s)Table 1 Comparison of depressive severity and sleep architecture between two groups
注:TIB=总卧床时间,TST=总睡眠时间,AST=实际睡眠时间,SE=睡眠效率,SL=睡眠潜伏期,REM=快速动眼时相,REML= REM潜伏期,AI=微觉醒指数,HAMD-24=24项版本汉密尔顿抑郁量表
指标未治疗组(n=24)治疗组(n=26)t值P值TIB(min)439±61 447±57 0.093 0.593 TST(min)426±56 432±55 0.046 0.674 AST(min)359±54 367±61 0.072 0.611 SE(%)82±13 82±13 0.103 0.209 SL(min)19±9 16±7 1.275 0.165 REML(min)146±64 77±30 9.849 0.000Ⅰ期睡眠比例(%)18±8 14±5 3.251 0.038Ⅱ期睡眠比例(%)51±13 49±8 0.088 0.576Ⅲ期睡眠比例(%)3±3 4±3 0.225 0.327 REM期睡眠比例(%)12±5 18±6 4.091 0.024 AI(次/h)18±6 14±5 3.793 0.041 HAMD-24评分(分)27±10 17±6 5.285 0.007

表2 治疗组的疗效影响因素Table 2 The influencing factors on the curative effect in the treated group
3 讨论
如抑郁症的睡眠时相前移假说所言,本研究显示抑郁症患者的REM睡眠存在明显的异常,主要表现为REML延长和REM期睡眠比例下降。虽然该假说认为抑郁症的首个REM睡眠应该增长,似乎与本研究的结果不符,但是抑郁症的睡眠质量下降将阻止REM睡眠的产生,造成REM睡眠总体比例的下降[2-3]。抑郁症患者的NREM睡眠也存在异常,主要表现为SWS比例下降,这提示了睡眠质量不良,与既往研究一致[2-3]。他们的睡眠连续性也由于过多的微觉醒而遭到破坏,并表现出睡眠转换期(I期睡眠比例)的增加。双程序模型〔自我平衡(S)程序和生物节律(C)〕是广为接受的日周期调控模型。S程序与觉醒时间的长短即睡眠压力有关,C程序由内在生理时钟所决定,体温、褪黑素、皮质醇、生长激素、胰岛素等的24 h变化被认为是生理时钟的指标[15]。这个模型也调控了抑郁症的睡眠,S程序通常由SWS和睡眠的起始和维持来体现,C程序主要由REM睡眠的特征来体现。本研究中,抑郁症患者的SWS减少和睡眠连续性反映了S程序存在问题,即睡眠压力不足。这也是睡眠剥夺对抑郁治疗有效的机制,因为睡眠剥夺增加了抑郁症患者的睡眠压力,从而改善了抑郁症状。抑郁症患者的REML缩短和REM期睡眠比例下降提示存在C程序不良,即内在的生物节律存在问题。抑郁症与生理时钟基因的相关性也陆续被证实[16-18]。这提示了抑郁症患者存在睡眠时相前移的生物节律问题。Mirmiran等[19]在1981年将氯米帕明给予初生小鼠而使成年小鼠具有与抑郁症相似的睡眠结构,这些小鼠也表现了明显的抑郁症状。这支持了睡眠异常可能是抑郁症的发病机制之一,而且通过改善抑郁症的睡眠结构不良可能也会同时改善抑郁症状[6]。
经过SSRIs治疗,抑郁症患者的REM睡眠异常得到了明显的改善。根据双程序模型,应该是C程序得到了改善,而且回归分析发现REM睡眠异常的改善和临床疗效存在密切的关系。睡眠质量密切相关的SWS治疗后没有变化,而且与疗效无关。我们也发现与睡眠连续性相关的AI和I期睡眠比例在治疗后均明显下降,而且AI下降与临床疗效密切相关,但是这两个指标在治疗后仍明显高于正常值,提示了治疗后的抑郁症患者睡眠连续性仍较差。研究显示SSRIs会压制SWS和增加觉醒,10%~20%患者在治疗过程中主诉失眠[20],然而在SSRIs治疗过程中,患者的焦虑和抑郁程度也逐渐下降,会改善患者的睡眠,增加SWS和减少觉醒。治疗后抑郁症患者的NREM睡眠的改变无疑是这两种截然相反作用的共同结果。根据双程序模型,虽然抑郁症患者的S程序存在问题,但是与临床疗效并没有直接的关系。睡眠剥夺增加了抑郁的睡眠压力,改善了抑郁症的S程序而缓解了抑郁症状,但是其并不持久,也证实了S程序异常并不是抑郁症的核心问题。
SSRIs主要通过5-羟色胺(5-HT)来发挥抗抑郁作用,它也主要通过5-HT机制来影响睡眠结构。中缝背核是5-HT在大脑的主要神经核团[21]。觉醒和NREM睡眠中,中缝背核的5-HT功能增强,抑制了脑桥产生REM睡眠;REM睡眠中,中缝背核的5-HT活动则处于静息状态[22]。中缝背核的5-HT功能在REM睡眠产生过程中扮演了闸门的角色。有假说曾推断抗抑郁剂是通过增强了中缝背核的5-HT活动而减少了REM睡眠。然而动物实验显示抗抑郁剂在减少REM睡眠的同时,抑制了中缝背核的5-HT神经点火率[23],并不支持这一假说,所以SSRIs等抗抑郁剂对睡眠结构的影响机制还未明了。
综上所述,抑郁症存在一些特征性的睡眠结构异常,既包括NREM睡眠,又包括REM睡眠,但是REM睡眠所涉及的C程序异常应该是抑郁症核心的睡眠节律异常,支持了抑郁症的睡眠时相前移假说。当然,本研究是回顾性研究,而且研究对象的数量仍显不足。有鉴于此,本研究的结论应该谨慎对待,还需要大样本和设计严谨的前瞻性研究进一步证实。
1 Billard M.Sleep:Physiology,investigation and medicine[M].New York:Kluwer Academic/Plenum Publisher,2003.
2 Reynolds CF III,Kup fer DJ.Sleep research in affective illness[J].Sleep,1987,10(3):199-215.
3 Rush AJ,Giles DE,Jarrett RJ,et al.Reduced REM latency predicts response to tricyclic medication in depressed outpatients[J].Biol Psychiatry,1989,26(1):61-72.
4 Arieti S.American handbook of psychiatry Vol 7[M].New York: Basic Books,1981:46-74.
5 Thase ME,Fasiczka AL,Berman SR,et al.Electroencephalographic sleep profiles before and after cognitive behavior therapy of depression[J].Arch Gen Psychiatry,1998,55(2):138-144.
6 White KJ,Walline CC,Barker EL.Serotonin transporters:Implications for antidepressant drug development[J].AAPS J,2005,7(2):421-433.
7 Goldstein BJ,Goodnick PJ.Selective serotonin reuptake inhibitors in the treatment of affective disorders,3:Tolerability,safety,and pharmacoeconomics[J].JPsychopharmacol,1998,12(Suppl B):55-87.
8 Dorsey CM,Lukas SE,Cunningham SL.Fluoxetine-induced sleep disturbance in depressed patients[J].Neuropsychopharmacology,1996,14(6):437-442.
9 Feige B,Voderholzer U,Riemann D,et al.Fluoxetine and sleep EEG: Effects of a single dose,subchronic treatment,and discontinuation in healthy subjects[J].Neuropsychopharmacology,2002,26(2): 246-258.
10 Shen J,Shapiro C.Polysomnographic sleep effects of fluoxetine and nefazodone on a seasonal affective disorder patient[J].Sleep Med,2002,3(6):527-528.
11 World Health Organization.International Classification of Diseases and related health problems[Z].1992.
12 Iber C,Ancoli-Israel S,Cheeson A,et al.The AASM manual for the scoring of sleep and associated events:Rules,terminology and technical specifications[M].Westchester:Illinois,2007.
13 张明园.精神科评定量表手册[M].2版.长沙:湖南科学技术出版社,1998:121-126.
14 Gartlehner G,Hansen RA,Thieda P,et al.Comparative effectiveness of second-generation antidepressants in the pharmacologic treatment of adult depression[EB/OL].www.effectivehealthcare.ahrq.gov/reports/final.cfm.
15 Arendt J.Melatonin,circadian rhythms and sleep[J].N Engl J Med,2000,343(15):1114-1116.
16 Ishida N,Kaneko M,Allada R.Biological clocks[J].Proc Natl Acad Sci,1999,96(16):8819-8820.
17 Nitabach MN.Circadian rhythms:Clock coordination[J].Nature,2005,438(7065):173-175.
18 Reppert SM.A colorfulmodelof the circadian clock[J].Cell,2006,124(2):233-236.
19 Mirmiran M,van de Poll NE,Corner MA,etal.Suppression ofactive sleep by chronic treatment with chlorimipramine during early postnatal development:Effects upon adult sleep and behavior in the rat[J].Brain Res,1981,204(1):129-146.
20 Goldstein BJ,Goodnick PJ.Selective serotonin reuptake inhibitors in the treatment of affective disorders,3:Tolerability,safety,and pharmacoeconomics[J].J Psychopharmacol,1998,12(Suppl B):55-87.
21 Steininger TL,Rye DB,Wainer BH.Afferent projections to the cholinergic pedunculopontine tegmental nucleus and adjacentmidbrain extrapyramidal area in the albino rat[J].J Comp Neurol,1992,321 (4):515-543.
22 Costa E,Tacagni G.Typical and atypical antidepressants:Molecular mechanisms[M].New York:Raven Press,1982:359-364.
23 Aghajanian GK,Graham AW,Sheard MH.Serotonin containing neurons in brain:Depression of firing by monoamine oxidase inhibitors[J].Science,1970,169(3950):1100-1102.
Influence of Selective Serotonin Reuptake Inhibitors on Sleep Architecture of Depressive Patients and Its Relationship w ith the Clinical Effect
ZHANG Bin,HAO Xue-li,LIXue-li,et al.Guangdong Mental Health Centre,Guangdong Gener-al Hospital,Guangdong Provincial Academy of Medical Science,Guangzhou 510120,China
Objective To investigate the influence of selective serotonin reuptake inhibitors(SSRIs)on sleep architecture of depressive patients and the relationship between the sleep architecture and the clinical effect of SSRIs.M ethods Totally 26 depressive patients with SSRIs treated in recent 2 weeks were recruited as treatment group from the polysomnography database,and 24 age-and sex-matched depressive patientswithoutmedication in recent3 months as un-treatment group were recruited at the same time.The Hamilton Rating Scale for Depression-24 items(HAMD-24)was used for assess the depression conditions before and after the treatment,and Logistic regression analysis was taken to determine the relationship between the sleep architecture and the clinical effect.Results There were no statistically significant differences between the two groups in sleep duration,sleep latency,percentagesofstage IIand IIIsleep(P>0.05).After SSRIs treatment,the latency of rapid eye movement(REM)in the treatment group was shortened as compared with the non-treatment group〔(77±30)min vs.(146± 64)min〕(P=0.000)and reached into normal range,and percentage of stage Isleep〔(14±5)%vs.(18±8)%〕and arousal index(AI)〔(14±5)times/h vs.(18±6)times/h〕decreased(P<0.05),but the AIstill was higher than normal (<5 times/h).The difference in HAMD-24 score between the two groupswas statistically significant〔(17±6)vs.(27± 10),P=0.007〕.Logistic regression showed that the clinical effect was associated with shorten REM latency〔OR=0.627,95%CI(0.517,0.923)〕and decreased AI〔OR=0.839,95%CI(0.721,0.987)〕.Conclusion The abnormal REM sleep may be the core of abnormal sleep rhythm in depressive disorder,which supports the hypothesis of advanced sleep phase.
Selective serotonin reuptake inhibitor;Sleep architecture;Depression;Clinical effect
R 749.42
A
10.3969/j.issn.1007-9572.2013.01.017
2012-10-07;
2012-11-22)
(本文编辑:邢煜)
广东省科技厅科技计划引导项目(2010B031600154);广州市属高校科技计划项目(08A036)
510120广东省广州市,广东省人民医院,广东省医学科学院,广东省精神卫生中心(张斌,李雪丽,刘武汉);广州医学院(郝雪利)
张斌,510120广东省广州市,广东省人民医院,广东省医学科学院,广东省精神卫生中心;
E-mail:zhang73bin@hotmail.com
