DEG/ENaC基因家族研究进展
2013-05-02王彦文
初 翔,王彦文
(山东农业大学林学院,山东泰安 271018)
1 DEG/ENaC家族简介
外部环境存在各种各样的机械刺激,感知这些刺激的细胞能够传导这些信号,到达中枢神经系统。从听觉、接触等每一种形式都可以得知我们与周围事物的相对关系。每一种组织感受这些刺激的细胞是不同的,这些细胞结构上不完全相同,但是这些机械感受器都有共同的分子结构和基础[1]。
近年来,随着分子生物学的发展,人们对感受机械刺激的分子机理的认识越来越深入。DEG/ENaC(Degenerin/epithelial sodium channel)家族参与感受机械刺激,研究其如何调节感受刺激的分子机理具有重要意义。
DEG/ENaC超家族是在多种生物中具有高度功能多样化的家族。DEG是Degenerin(变性蛋白)的缩写,来源于DEG-1和其他相关基因突变所诱导的细胞缺陷。ENaC是Epithelial sodium channel(上皮钠通道)的缩写,这种钠离子通道对阿米洛利(Amiloride或Amipromizide)敏感。DEG最早是在线虫mec-4和mec-10基因突变体发现的。实验发现,正常线虫对触角刺激极其敏感,而当这两个基因突变时线虫触角刺激反应消失。同时,当检查这两个基因过表达突变体(Gain of function mutation)时,发现可引起线虫触觉细胞变性,所以因此而得名[2]。mec-4和mec-10基因蛋白与表达在肾、大肠和肺的ENaC同样对排钠留钾利尿药阿米洛利敏感,因此将具有DEG和ENaC两者基因编码特点的蛋白分子统一命名为DEG/ENaC超家族。
动物本体对普通的触摸和相关的机械刺激感觉是普遍存在的。触觉感受器的感觉终端在全身都有分布,或者镶嵌在其他组织当中。最近的研究表明,DEG/ENaC家族与机械刺激有关,同时也可以作为神经递质受体存在,对感觉咸味,pH变化等都起到重要作用[3]。在果蝇和线虫发现,Rippedpocket(RPK)和Pickpocket(PPK)等基因是DEG/ENaC家族的成员,都与感受机械刺激有关。
2 DEG/ENaC基因家族的结构特点
现已经鉴定出DEG/ENaC的家族成员:线虫有21个,果蝇有30个,蜗牛有1个,哺乳动物至少9个,可分成5个主要的亚家族。DEG/ENaC亚基可以有500-1000个氨基酸长度的变化,包括两个共同的跨膜区域TM1和TM2(如图1)[4]。
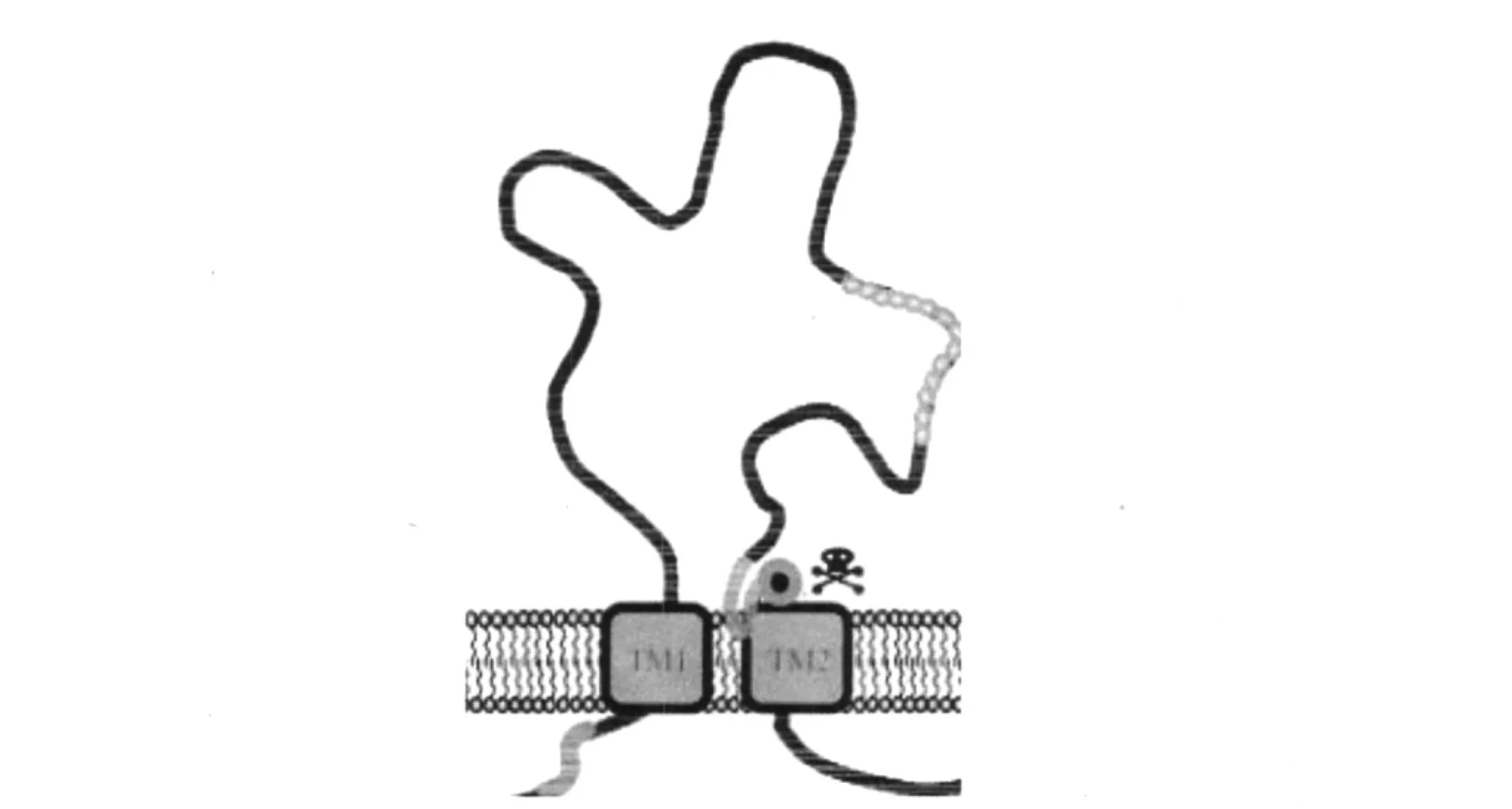
图1 DEG/ENaC超家族蛋白分子结构拓扑图Fig.1 Anatomy of a DEG/ENaC subunit
位于细胞膜上通道单元含有一个短的N末端和C末端的疏水跨膜区和一个大的细胞外环,这个环包括多个糖基化位点和具有保守跨度的半胱氨酸残基。这些结构域参与通道活性的控制和孔的形成。这些通道介导活性钠再吸收的第一步,这对于维持机体盐和水的自稳态是很必要的。在脊椎动物中,通道控制着在肾脏、结肠、肺和甜味腺中钠的再吸收,它们也在味觉认知方面起作用。TM2是离子通道的核心部分,虽然长度很短,但是高度保守,他可以与TM1区域相连,进而影响通道的开放、离子的吸收、钠离子的选择性吸收和运输。外部的结构域有富含半胱氨酸的保守区域,对离子通道的基本功能至关重要[4]。
DEG/ENaC家族可被各种刺激所调控,包括质子(ASIC酸敏感型通道),神经肽类(蜗牛的FaNaC),还有一些机械力等等[4]。同时,DEG/ENaC通道家族成员之间功能上是不均一的,这为阐明基本通道功能的分子基础提供了独特的机会,比如配体活性、动力传导、离子选择性或者药物配体的阻断等。
3 DEG/ENaC基因家族组成
3.1 DEGs亚家族
DEGs亚家族主要是在线虫中发现的,在脊椎动物和哺乳动物尚未发现。分析mec的突变体(mec-4和mec-10可以编码DEG/ENaC通道家族),正常线虫可以对触角刺激极其敏感,而当这两个基因突变时线虫对触觉刺激反应消失。随后发现了MEC-4、MEC-10、UNC-8、UNC-105和DEG-1等5个成员,这些通道在受机械刺激时开放,因而在线虫的触觉和机械感受中发挥作用[5]。
3.2 ASICs亚家族
酸敏感离子通道(ASICs)是一类阳离子通道,表达在中枢和周围神经系统。可以被细胞外酸化环境或物质所激活,属于钠通道超家族的成员,对K+和Ca2+具有较低的通透性。近来发现,ASICs不但在神经系统具有重要的生物学功能,而且在味蕾、心血管、骨骼等的生理和病理过程中具有重要作用。到目前为止,已克隆了由4个基因编码的7个ASICs亚基,它们分别是 ASIC1a、1b、1b2、2a、2b、3 和 4[6]。ASIC1a、ASIC2a、ASIC2b 在脑内主要表达于海马小脑、大脑皮质、嗅球、松果体缰、基底外杏仁核等。在外周ASICs主要存在于与疼痛感觉有关的小直径神经元,在DRG、触压觉神经末梢及其周围组织、心脏交感神经传入末梢均有表达[7]。这些亚基在表达系统中可形成功能性同聚体通道 ASIC1a、ASIC1b、A2SIC2a和ASIC3;无功能同聚体通道ASIC2b和ASIC4及多种异聚体通道。这7个亚基所组成的同聚体或异聚体酸敏感离子通道表现出不同的电流表型、通道特性和离子选择性。作为受体接受H+刺激的部位是在胞外,是保持通道基本功能的位点,与通道门控相关的部位是胞外接近TM2的甘氨酸(Gly)430处;而直接影响通道开放的概率、Na+选择性和离子通透性的位点则为胞内接近TM1处的9个保守的氨基酸序列。对ASIC的研究发现,ASICs在特定的表皮机械感受神经末梢有表达,说明ASICs可能是机械刺激感受的位点之一。Price等发现ASIC2基因敲除,小鼠的皮肤对轻触觉的敏感性明显降低,但并未使H+激活的电流在感觉神经元中消失,表明ASIC2可能存在与其他ASICs异聚体对触觉的协同作用[8]。随后发现ASIC3基因沉默小鼠对轻触觉的反应性是增强的。ASIC2和ASIC3是正常触觉产生所必须的组分,并可能以异聚体形式组成触觉感受复合体的中心成分[9]。
3.3 ENaCs亚家族
ENaC是由α、β、γ 3个高度同源亚单位组成的非电压依赖性通道,对阿米洛利敏感[10],其中α亚基对通道功能起主导作用[11]。ENaC负责肾脏Na+的限速重吸收,对于维持细胞外液量、血压、钠的自身平衡起重要作用,ENaC基因被认为是EH的重要候选基因。最近证实的βENaC和γENaC广泛存在于哺乳动物颈、腰髓、与有髓纤维联系的NF200阳性细胞和外周足底皮肤内分布于Merkel触盘、Meissner小体和Pacini小体的粗有髓神经纤维和终末端中,说明这两个成员可能属于皮肤机械感受器[12]。
3.4 BNCs/BNaCs亚家族
BNCs亚家族包括BNC1和BNC2两个成员,都只在脑组织中表达。人、大鼠和小鼠的BNC1基因,分别命名为BNC1、MDEG和BNaC1,含有由1539个碱基构成的开放阅读框,全长1809个碱基,编码由512个氨基酸构成的蛋白质。多标记染色显示,BNC1在L 4-L 5节段表达于21%的DR神经元,有90%以上NF200阳性细胞都与其共存,而只有少于4%的外周蛋白阳性小细胞含有BNC1;在外周足底皮肤,BNC1广泛存在于支配毛囊、Merkel触盘、Meissner小体和 Pacini小体的粗有髓神经纤维和终末。在正常状况下,DRG中BNC1蛋白只向外周单方向转运而不向脊髓中枢转运,脊髓后索和灰质也无BNC1的表达[13]。与野生小鼠比较,BNC1基因沉默小鼠的DRG中BNC1的mRNA和编码的蛋白消失,支配皮肤毛囊的梳状BNC1免疫反应阳性纤维消失,离体单纤维记录发现外周皮肤快适应机械感受器和慢适应机械感受器对机械刺激反应显著减弱,而A D和C伤害性感受器以及A D绒毛D机械感受器的反应正常,进一步证实BNC1可能是哺乳动物躯体机械感受器[14]。
3.5 FaNaC亚家族
在无脊椎动物的神经系统有很多FMRFamide以及与其相关的肽类物质,它们是作为神经递质和神经调节物质在神经系统发挥作用[15,16]。FMRFamide还没有在哺乳动物中分离出来,但在哺乳动物的神经系统是确实存在的。FMRFamide通常调节两种离子通道功能:FMRFamide的门控性Na+通道(FaNaC)和哺乳动物酸敏感离子通道(ASIC)。FMRFamide是通过G蛋白偶联受体,激活Na+的传导发挥作用的。
现在发现,FMRFamide直接调控Na+通道,没有涉及G蛋白的参与[17]。FaNaC是目前唯一已知由肽类物质调控的离子通道,是由653个氨基酸组成。属于ENaC/DEG家族成员,具有两个跨膜的结构域,和一个较大的胞外域。近来发现三种FaNaC通道:蜗牛HtFaNaC,椎实螺 LsFaNaC,黑斑海兔AkFaNaC。当FMRFamide刺激时,在爪蟾卵母细胞和哺乳动物细胞这三种FaNaC通道都能够产生内向电流[18-22]。
虽然LsFaNaC在体内没有发现表达,但是仍可以推测它也具有相似的特征。HtFaNaC同HaFaNaC有65%相似,LsFa-NaC同HaFaNaC有60%相似。由于HaFaNaC和HtFaNaC对FMRFamide和amiloride的敏感度不同,推测FMRFamide的识别区域可能位于胞外环90个氨基酸区域[23]。另外,FaNaC的离子通道包括含有一个较大的亲水孔道,可以选择性调控外部物质的进出。
在每种生物的中央神经节,存在大量FMRFamide门控Na+通道,含有大量FaNaC转录产物。原位杂交发现,在椎实螺超过400个神经元表达FaNaC基因,包括RpeD1神经元[24]。通过逆转录PCR发现,HaFaNaC和LsFaNaC在神经系统和腿部肌肉也有一定程度的表达。FaNaC在各种功能的神经元中大量存在,但是只有一小部分神经元能够表达翻译产物蛋白。
DEG/ENaC家族成员的关系见图2。
4 PPK基因的功能
PPK基因是DEG/ENaC家族的成员,种类很多,对各种不同的机械刺激司职不同的功能,共同感受外界环境的变化。现在已经发现 PPK1、rpk、PPK4、PPK6、PPK7、PPK10、PPK11、PPK12、PPK13、PPK14、PPK16、PPK19、PPK20、PPK21、PPK23、PPK2816种DEG/ENaC家族的编码基因。下面列举了国内外发现的PPK基因的功能。
4.1 PPK1参与身体规律性运动
中枢系统和外周神经系统共同调节身体的规律性运动。PPK1基因位于果蝇2号染色体的左臂,位置是35B1。PPK1基因是果蝇DEG/ENaC家族成员之一,在MD感觉神经元、幼虫的身体表面和脑部的两极神经元都有表达。PPK1基因突变体幼虫有正常的体外接触,但是在爬行行为上有影响。抑制PPK1基因功能时,引起爬行速度加快和运动方式无规律,运动的时间会大幅度增长。转基因PPK1时,运动行为得到恢复。这些结果表明,PPK1基因对控制规律性运动及保持身体的运动功能完整有重要作用[25]。
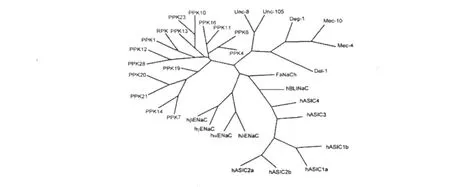
图2 DEG/ENaC家族成员的关系树Fig.2 Phylogenetic tree of DEG/ENaC ion channel family
4.2 PPK4和PPK10参与气管液体基质清除
生物体需要氧气来满足自身组织的新陈代谢和生长发育。在哺乳动物中,肺部的网络分支状结构,帮助氧气溶解于血液中,运输到各组织器官中。果蝇和哺乳动物在气管的结构上相似。在生长发育时,最初气管组织是实质的,最后这个系统必须清除液体基质,充满空气。在果蝇中,发现PPK4,-10,-11,-12,和 -13主要负责这项功能。在哺乳动物这种变化是在出生时发生的,上皮细胞能够吸收器官的液体基质。在果蝇中这种变化出现在幼虫孵化的2h左右。当用UAS-eGFP系统驱动表达,PPK4,-10,-11,-12,和 -13在幼虫的气管系统中表达。虽然PPK4和 PPK10都在成虫气管系统中表达,但它们具有不同的表达方式,PPK4在背侧的主干中表达,PPK10也在背侧主干上皮细胞中表达,但是在气孔周围表达很明显。用RNAi技术使PPK4和PPK11沉默时,发现果蝇的气管无法正常排除液体基质,影响正常的呼吸功能。当然清除液体基质这种转变的发生也需要其他PPK基因的共同参与才能完成的[26]。
4.3 PPK11和PPK19参与味觉感受
所有的陆生动物都有检测环境中盐度的能力,味觉系统是主要的化学感觉系统,能够
感觉NaCl和其他盐类。这种感觉系统可以使动物检测、摄食、辨别不同浓度的盐类,避免高浓度盐富集。DEG/ENaC成员PPK11和PPK19是与感觉盐类有关的基因,在幼虫的味觉末端组织中、成虫的腿部和翅膀的边缘表达,参与味觉的感受。当用RNAi沉默PPK11和PPK19时,幼虫失去辨别能力,无法把低浓度的Na+或者K+与水分辨开。对低浓度的盐类电生理反应是不敏感的,而幼虫对蔗糖和对气味的反应都是正常的。说明PPK11和PPK19对检测Na+和 K+等盐类具有重要作用[27]。
5 展望
DEG/ENaC基因家族的功能是参与感受机械刺激,而PPK基因是DEG/ENaC家族的成员,对各种不同的机械刺激发挥不同的作用,共同感受外界环境的变化。随着电生理学和基因工程技术的发展,未来工作的重心将转移到PPK基因的具体功能上,通过转基因技术等研究它们的生理作用。目前对PPK基因的研究是不完整的,例如基因如何参与通道打开,信号传导等,一些PPK基因的作用也不是很清晰。PPK基因正成为一个有潜力的热门研究对象而被更多学者关注,因此PPK基因的功能将是未来研究的重要方向。
[1] Peter G ,Richard G.Molecular basis of mechanosensory transduction[J].Nature,2001,413:194-202
[2] 陈 军.DEG/ENaC超家族机械感受器的分子生物学基础[J].神经解剖学杂志,2004,20(1):93-95
[3] Joshua A ,Janette M ,Dmitry,et al.Enhanced Locomotion Caused by Loss of the Drosophila DEG/ENaC Protein Pickpocket1[J].Current Biology,2003,13:1557-1563
[4] Laura ,Monica.Protons at the Gate:DEG/ENaC Ion Channels Help Us Feel and Remember[J].Neuron,2002,34:337-340
[5]Gillespie PG,Walker RG.Molecular basis of mechanosensory transduction[J].Nature,2001;413(6852):194-202
[6] Krishtal O.The ASICs:signaling molecules modulators[J].Trends Neuro sci,2003,26(9):477-483
[7] 张 晶,司军强.酸敏感离子通道在DRG的表达与调控[J].Journal of Nongken Medicine,2008,30(3):224-226
[8] Price M P,Lewin G R ,Nmllwrath S L ,et al.The mammalian sodium channel BNC1 is required for normal touch sensation[J].Nature,2000,407(6807):1007 ~1011
[9] Price M P,Mcllwrath S L,Xie J,et al.The DRASIC cation channel cont ributes to the detection of cutaneous touch and acidstimuli in mice[J].Neuron,2001,32(6):1071~1083
[10] Canessa CM,Schild L,Bueu G,et al.Amiloride sensitive epithelial Na+channel is made of three homologus subunits[J].Nature,1994,367:463-467
[11] Mcdonald FJ,Price MP,Snyder PM,et al.Cloning and expression of t heβ -andγ -units of the human epithelial sodium channel[J].Am J Physiol,1995,268(5pt1):115-163
[12] Corey D P,Garcia-noveros J.Mechanosensation and the DEG/ENaC ion channels[J].Science,1996,273(5273):323-324
[13] Jaime G A,Tarek A,Ljiljana Z J.Transport and localization of the DEG/ENaC ion channel BNaC1 to peripheral mechano sensory terminals of dorsal root ganglia neurons[J].J Neuro sci,2001,21:2678-2686
[14] Price MP,Lewin GR,McIlw rath SL,et al.The mammalian sodium channel BNC1 is required for normal touch sensation[J].Nature,2000,407(6807):1007-1011
[15] Cottrell GA.The biology of the FMRFamide-series of peptides in molluscs with special reference to Helix[J].CompBiochem Physiol A,1989,93:41-45
[16] Price DA,Greenberg MJ.Structure of a molluscan cardioexcitatory neuropeptide[J].Science,1977,197:670-671
[17] Green KA,Falconer SW,Cottrell GA.The neuropeptide Phe-Met-Arg-Phe-NH2(FMRFamide)directly gates two ion channels in an identified Helix neurone[J].European Journal of Physiology,1994,428:232-240
[18] Coscoy S,Lingueglia E,Lazdunski M,et al.The Phe-Met-Arg-Phe-amide-activated sodium channel is a tetramer[J].J Biol Chem,1998,273:8317-22
[19] Furukawa Y,Miyawaki Y,Abe G.Molecular cloning and functional characterization of the Aplysia FMRFamide-gated Na(+)channel[J].European Journal of Physiology,2006,451:646-656
[20] Jeziorski MC,Green KA,Sommerville J,et al.Cloning and expression of a FMRFamide-gated Na(+)channel from Helisoma trivolvisand comparison with the native neuronal channel[J].J Physiol,2000,526:13-25
[21] Lingueglia E,Champigny G,Lazdunski M,et al.Cloning of the amiloride-sensitive FMRFamide peptide-gated sodium channel[J].Nature,1995,378:730-733
[22] Whim MD.Heterologous expression of the ionotropic FMRFamide receptor in murine CNS neurons[J].Soc Neurosci Abstr,2004,12:845
[23] Cottrell GA,Jeziorski MC,Green KA.Location of a ligand recognition site of FMRFamide-gated Na(+)channels[J].FEBS.Lett.2001,489:71-74
[24] Perry SJ,Straub VA,Schofi eld MG,Burke JF,Benjamin PR.Neuronal expression of FMRFamide-gated Na+channel and its modulation by acid pH[J].JNeurosci,2001,21:5559-5567
[25] Lixian Zhong,Richard Y H,W Daniel Tracey.Pickpocket Is a DEG/ENaC Protein Required for Mechanical Nociception in Drosophila Larvae[J].Current Biology,2010,20:429-434
[26] Lei Liu,Wayne A.J,Michael J W.Drosophila DEG/ENaC pickpocket genes are expressed in the tracheal system,where they may be involved in liquid clearance[J].PNAS ,2003,100(4):2128-2133
[27] Lei Liu,A.Soren Leonard,David G Motto,et al.Contribution of Drosophila DEG/ENaC Genes to Salt Taste[J].Neuron,2003,39:133-146
