乌榄种仁油的提取工艺及脂肪酸组成
2013-05-02郭守军杨永利黄惠萍陈剑委刘浩元
郭守军 杨永利 黄惠萍 陈剑委 刘浩元
GUO Shou-jun YANG Yong-li HUANG Hui-ping CHEN Jian-wei LIU Hao-yuan
(韩山师范学院生物系,广东 潮州 521021)
(Biology Departmentof Hanshan Normal University,Chaozhou,Guangdong 521021,China)
乌榄(Canarium pimela koenig),又名黑榄、木威子,是橄榄科橄榄属的常绿乔木[1],常生于低海拔的山地、林中。主要分布于中国广东、福建、台湾、海南、广西、云南等省[2],花期5~7月,果期8月。果核卵圆形至椭圆形,两端钝,成熟时紫黑色,有浓郁的香味。果实可食用,为岭南果品之一,味酸、涩、性平、无毒,也是粤东名菜“橄榄菜”的辅料;种子即“榄仁”,是制糕饼的高级馅料之一,广式中秋月饼中的“五仁”,其中便有它的一份,也可榨油食用[1-3]。乌榄果实含丰富的芳香成分,挥发油得率为0.111%,为黄色透明油状液体,具有清甜的蜜蜡香气,是制备食用香精的良好原料[4]。乌榄果具有清热解毒、消肿止痛、治感冒、上呼吸道炎、肺炎、多发性疖肿等多种功效[5];现代药理学研究[6]表明,乌榄果的水提取物具有快速、显著的降压作用。乌榄果实中含有丰富的钠、钙、镁、铁、锰、钼等人体必需的元素及较为丰富的V。果皮含有花青素[8],是一种稳定、安全的食用天然紫色素。
粤东是乌榄的主产区,普宁、揭西、潮州等地有大面积的种植,年产量约在5 000 t以上,资源丰富。但是乌榄果实在当地也仅作为腌制咸菜的辅料,果肉被食用后,果壳连同果仁常常被废弃,造成了很大的浪费。目前也未见有关乌榄种仁油提取工艺及其性质等方面的研究报道。本试验以乌榄果仁为原料,利用有机溶剂萃取法并借助正交试验设计提取乌榄种仁油,测定其理化性质,并通过GC—MS分析了乌榄种仁油中脂肪酸成分,以期对乌榄果的进一步开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜乌榄果实:广东省揭阳市揭西县乌榄园;
无水乙醇、丙酮、正己烷、环己烷、石油醚(30~60 ℃)、三氯甲烷、无水硫酸钠、正庚烷、甲醇、氢氧化钾、盐酸、冰乙酸:分析纯,广州化学试剂厂;
一氯化碘、碘化钾、可溶性淀粉、酚酞指示剂:分析纯,广州化学试剂厂。
1.1.2 主要仪器设备
电子天平:JJ1000型,常熟双杰测试仪器厂;
气相色谱—质谱—计算机联用仪:HP 6890/5973型,美国Hewlett-Packark公司;
红外线干燥箱:404-1型,上海市实验仪器总厂;
真空干燥箱:DZF-6050型,上海博迅实业有限公司医疗设备厂;
阿贝折射仪:2WAJ型,上海宙山精密光学仪器有限公司。
1.2 方法
1.2.1 工艺流程
鲜果→去果皮和种皮→乌榄种仁→真空干燥(30℃,0.01 MPa)→粉碎(过80目筛)→索氏提取→无水硫酸钠脱水→减压浓缩→籽油
1.2.2 种仁的制备 将新鲜乌榄果实去果皮和种皮,将种仁于真空干燥箱中35℃干燥24 h,粉碎备用。
1.2.3 乌榄种仁油最佳提取工艺的研究
(1)提取试剂的选择:称取乌榄种仁粉 5.00 g,分别以单次虹吸溶剂量(料液比1∶18,m∶V)的无水乙醇、丙酮、正己烷、石油醚、三氯甲烷,在各自的最佳提取温度下回流提取3 h,计算得油率,确定最佳的提取试剂。
(2)提取时间对得油率的影响:称取5份乌榄种仁样品各5.00 g,以石油醚为提取溶剂,分别置于索氏提取器中,加入两次虹吸的量(料液比1∶18,m∶V)的最佳提取溶剂,55℃下分别回流提取 1,2,3,4,5 h,计算得油率,确定最佳的提取时间。
(3)提取温度对得油率的影响:称取5份乌榄种仁样品各5.00 g,分别置于索氏提取器中,加入两次虹吸的量(料液比1∶18,m∶V)的最佳提取溶剂,分别在 40,45,50,55,60℃下回流提取最佳提取时间长,计算得油率,确定最佳的提取温度。
(4)料液比对得油率的影响:称取5份乌榄种仁样品各5.00 g,分别置于索氏提取器中,分别按 1∶12,1∶14,1∶16,1∶18,1∶20(m∶V)的料液比加入最佳提取溶剂,在最佳提取温度下回流提取最佳提取时间长,计算得油率,确定最佳提取料液比。
(5)最佳提取条件的确定:在单因素试验基础上以提取温度、料液比和提取时间为三因素进行L9(33)正交试验,确定乌榄种仁油的最佳提取工艺[9,10]。
1.2.4 得油率的测定 分别用质量法和瓶重法计算得油率[11],并取二者平均值作为试验结果。
(1)质量法:得油率的计算公式见式(1)。

式中:
R——得油率,%;
mA——提取前样品加滤纸的质量,g;
mB——提取后样品加滤纸的质量,g;
m1——提取前样品质量,g。
(2)瓶重法:得油率的计算公式见式(2)。

式中:
R——得油率,%;
m'——提取前空圆底烧瓶的质量,g;
m''——提取后圆底烧瓶加样品油的质量,g;
m1——提取前样品质量,g。
1.2.5 GC—MS分析
(1)甲酯化:取1 g油样于圆底烧瓶中,移取10mL甲醇及0.125mL 1mol/L KOH甲醇溶液于油样中,并加入几粒沸石,加热回流至溶液清澈透明为止(回流过程不断摇动烧瓶)。冷却后,将烧瓶中的内容物转移到分液漏斗中,并用5mL正庚烷洗涤烧瓶,将此洗涤液一并转移到分液漏斗中,并向分液漏斗中加入10 mL蒸馏水,摇动,静置分层(上层为酯层,下层为水层)后,分出上层液,下层溶液继续再用5 mL正庚烷重复萃取1次,合并上层溶液,并用蒸馏水进行多次洗涤,直至洗涤水呈中性为止,分离出酯层,无水硫酸钠干燥,过滤,减压浓缩,回收溶剂,得到约5 mL的脂肪酸甲酯的正庚烷溶液装入样品瓶中,用封口钳封口置入4℃冰箱,进行GC—MS分析。
(2)气相色谱条件:石英毛细管柱 HP-5MS,30μm×0.25μm,膜厚0.25μm。程序升温:从60℃开始,保持1min,以2.5℃/min升到210℃,保持5min,再以10℃/min升到280℃,保持 10 min;进样量 0.4μL,分流比 1∶60;载气为He,柱流量 1.2mL/min,进样口温度:280 ℃。
(3)质谱条件:EI源;电离电压70 eV;离子源温度230℃;扫描范围 33~550 AMU,质谱库 NIST62.i和 ETANIH。
1.2.6 物化性质的测定
(1)相对密度:按GB/T 5526——85(比重瓶法)执行。
(2)折光指数:按GB/T 5527——85执行。
(3)酸价:按GB/T 5530——1998执行。
(4)碘值:按GB/T 5532——2008执行。
(5)皂化价:按GB/T 5533——85执行。
2 结果与分析
2.1 乌榄种仁油最佳提取工艺
2.1.1 最佳溶剂的选择 提取溶剂对乌榄种仁油提取率的影响见图1。
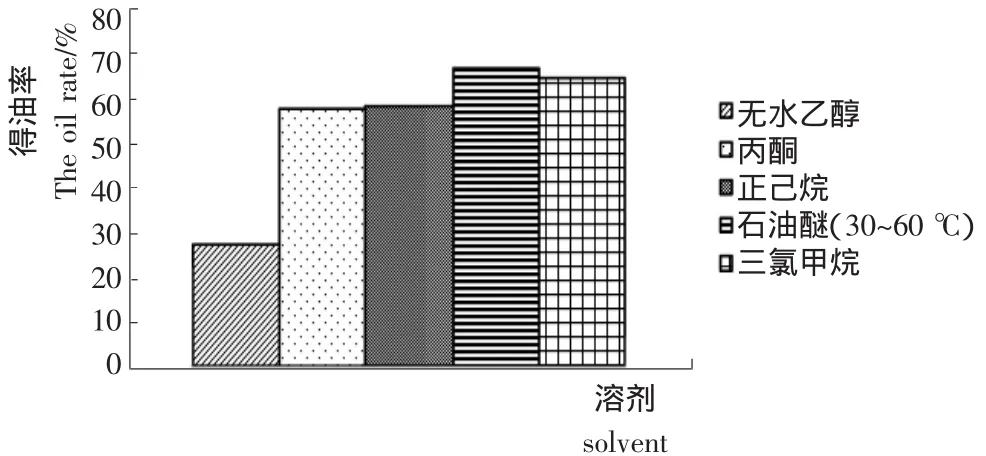
图1 溶剂对种仁油提取率的影响Figure 1 Effectof solventon the extraction rate of Canarium pimela kernel oil
由图1可知,提取溶剂的选择对乌榄种仁油的提取率有较大的影响。无水乙醇浸提效果最差;丙酮、三氯甲烷、正己烷和石油醚都有较好的提取效果,但丙酮不适宜作浸提溶剂[11],而三氯甲烷又有一定的毒性,所以前两种溶剂在实际生产中无法应用。后两种中,石油醚提取率最高且得到油样颜色较浅,散发出一股淡淡的油香味。因此,综合考虑,选择石油醚为乌榄种仁油的最佳提取溶剂。
2.1.2 提取时间对提取效果的影响 提取时间对乌榄种仁油提取率的影响见图2。
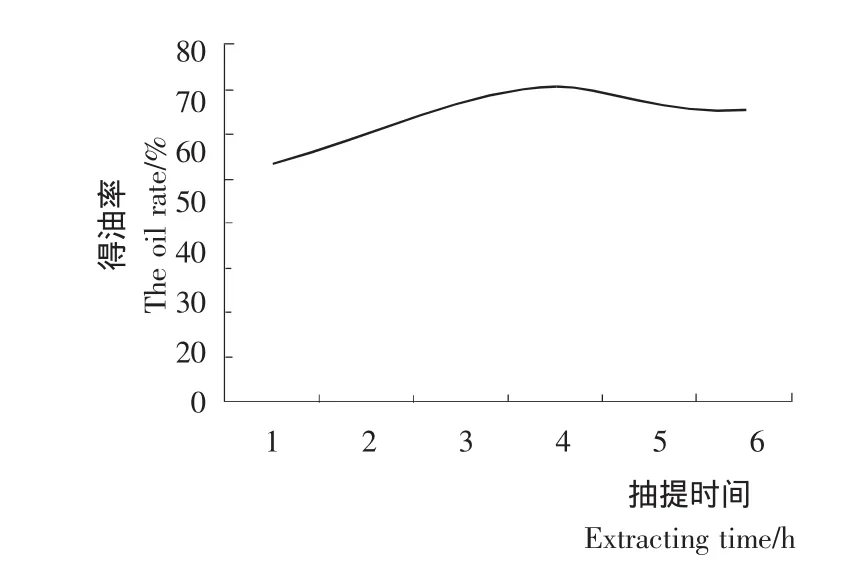
图2 提取时间对种仁油提取率的影响Figure 2 Effectof extraction time on the extraction rate of Canarium pimela kernel oil
由图2可知,在进行籽油提取的前4 h里,得油率随提取时间的延长逐渐增大,当提取时间为4 h时,得油率达到最大,但是当提取时间超过4 h时,随着提取时间的延长得油率稍有下降。分析认为,提取时间为5 h和6 h时提取率基本持平,提取时间为4 h得油率稍高于5 h和6 h,可能是由于微量提取溶剂残留造成。综合考虑各方面因素,选择4 h为最佳浸提时间。
2.1.3 提取温度对提取效果的影响 提取温度对乌榄种仁油提取率的影响见图3。

图3 提取温度对乌榄种仁油提取率的影响Figure 3 Effectof temperature on the extraction rate of Canarium pimela kernel oil
由图3可知,在50~55℃时,乌榄种仁的出油率随提取温度的上升而显著升高。当温度继续上升时,得油率却呈下降趋势,其原因是所用提取剂石油醚的沸程为30~60℃,当提取温度超过55℃甚至高于60℃时,导致索氏提取器中石油醚的虹吸速度远超过了乌榄种仁中的油脂的溶出速度,在固定的提取时间内,出油率反而略有降低。综合考虑各方面因素,选择55℃为最佳浸提温度。
2.1.4 料液比对提取效果的影响 料液比对乌榄种仁油提取率的影响见图4。
由图4可知,当料液比从1∶12(m∶V)增至1∶16(m∶V)时,乌榄种仁的出油率逐渐升高,而在料液比1∶16(m∶V)以后乌榄种仁的出油率略有降低。料液比的增大,有两种影响结果,①使籽粕中的油脂提取率增大;②因油脂在提取剂中的溶质浓度影响效应,溶剂的沸点会下降,致使索氏提取器中单位时间的虹吸次数会降低。本试验中,在料液比为1∶12~1∶16(m∶V)时,第一种影响结果起主要作用,当料液比大于1∶16(m∶V)之后,第二种影响结果起主要作用;两种影响结果共同作用的结果使料液比1∶16(m∶V)之后提取率会稍有下降。故选择料液比1∶16(m∶V)为最佳提取料液比。
2.1.5 L9(33)正交试验 根据以上单因素试验的试验结果,取得油率较高时的单因素水平进行正交试验,试验因素水平见表1,正交试验结果见表2。
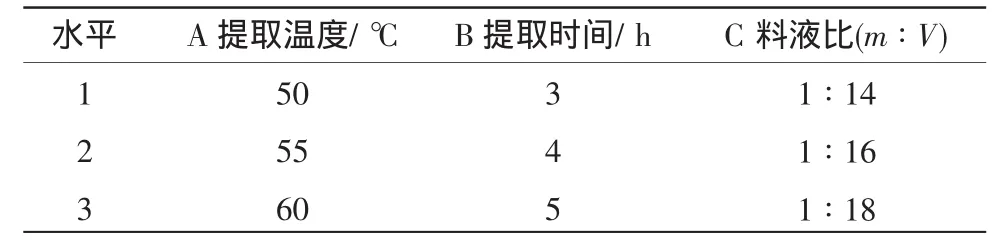
表1 正交试验因素水平表Table1 Factors and levels of orthogonal teston extraction conditions of Canarium pimela seed oil

表2 L9(33)正交试验结果直观分析表Table2 Intuitive analysis resultof orthogonal testwith L9(33)
由表2可知,各因素对种仁油提取效果的影响程度顺序是B>C>A,最佳组合为A3B3C3,即以石油醚为浸提溶剂,浸提温度60℃,浸提时间5 h,料液比1∶18(m∶V)。
由表3可知,提取时间、提取温度以及料液比3个因素对乌榄种仁油提取效果的影响没有差异性。
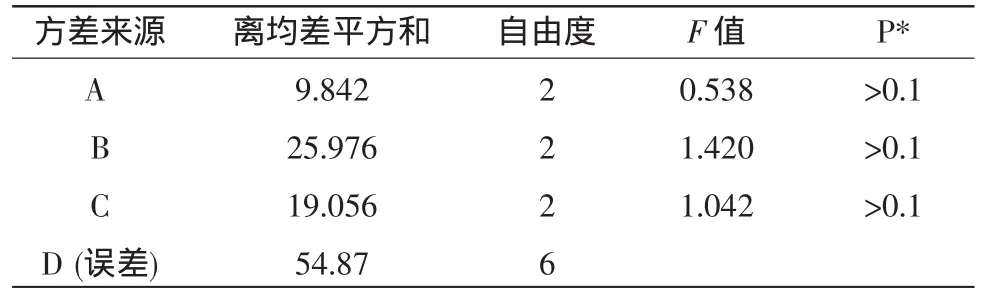
表3 方差分析表Table3 Variance analysis table
为了确定正交试验最佳组合的再现性,进行了最佳组合的验证实验,即以石油醚为浸提溶剂,浸提温度60℃,浸提时间5 h,料液比1∶18(m∶V)为提取条件,测得的种仁油得率为71.4%,大于正交试验测得的最高籽油得率的组合70.6%,证明确定的最佳组合是正确的。
2.2 乌榄种仁油GC-MS定性和定量分析
乌榄种仁油脂肪酸甲酯的GC—MS总离子色谱图见图5。由图5可知,色谱分离出4个峰,表明乌榄种仁油是由4种化合物组成,根据GC—MS联用测定所得到的质谱信息,应用数据库进行检索,并对检索结果进行人工核对,通过与标准谱图对照、分析,确定了乌榄种仁油组成成分的结构[11,12],并按照峰面积归一法计算可算出各组成化合物的相对百分含量。乌榄种仁油脂肪酸组成分析鉴定结果见表4。乌榄种仁油中主要含有亚油酸、油酸、棕榈酸和硬脂酸,其中亚油酸、油酸和棕榈酸是其主要成分,占乌榄种仁油组成的95.17%。乌榄种仁油中饱和脂肪酸仅占39.79%,而不饱和脂肪酸含量为60.21%。

图5 乌榄种仁油脂肪酸甲酯的GC—MS总离子流色谱图Figure 5 GC—MS total ion chromatogram of kernel oil from Canarium pimela

表4 乌榄种仁油脂肪酸甲酯衍生物的GC—MS分析结果Table4 Identification results of chemical constituents for the kernel oil of Canarium pimela
2.3 乌榄种仁油与棕榈油脂肪酸组成比较
由表5可知,虽然乌榄种仁油的脂肪酸组成与普通的“油酸—亚油酸”类油脂差异较大,但是除了单不饱和脂肪酸(油酸)和多不饱和脂肪酸与棕榈油差别较大外,其总饱和脂肪酸和总不饱和脂肪酸的百分含量与棕榈油相近[13],故可以将乌榄种仁油归为“棕榈酸类油脂”。乌榄种仁油的稳定性仅次于棕榈油,是一种稳定性较高的油脂,可以长期储存,可以做烹饪、煎炸用油,也可以作为代用可可脂的原料。多不饱和脂肪酸和饱和脂肪酸之比(PUFA/SFA)为0.90,营养价值高于棕榈油 (PUFA/SFA 0.23)。
2.4 乌榄种仁油理化性质分析
乌榄种仁油部分理化指标见表6。
由表6可知,乌榄种仁油的比重为0.911 3 g/cm3,折光指数为1.469 1,与其它一般常见植物油基本一致;酸价0.989mg/g,表明其游离脂肪酸含量很低;碘价为84.6 g/100 g,低于多数植物油,显示其不饱和脂肪酸含量偏低;皂化价为186.2mg/g,与其它常见的植物油相比较低,则说明乌榄种仁油中脂肪酸平均分子量较小。

表5 乌榄种仁油与棕榈油脂肪酸含量比较Table5 Comparison on fatty acid constituent contentof kernel oil from Canarium pimela with palm oil /%

表6 乌榄种仁油部分理化指标Table6 Partof physical and chemical indicators of kernel oil from Canarium pimela
3 结论
以石油醚为浸提溶剂,利用索氏提取法提取得到的乌榄种仁油样为呈明亮淡黄色的透明液体,散发出一股淡淡的油香味,提取率71.4%。乌榄种仁油中不饱和脂肪酸含量较高(60.21%),主要成分为油酸和亚油酸。亚油酸是人体内制造磷质、胆固醇、糖质和前列腺素等的必须脂肪酸[4]。所以它是人体获取多不饱和脂肪酸的良好食物来源。
潮汕地区乌榄资源丰富,如果在采摘后,先将果肉和果仁进行分离,果肉用于腌制橄榄菜,果核去掉内果皮后,对果仁压榨制备乌榄种仁油。不仅可以减少果仁的浪费,也可以大大提高乌榄的经济价值。所以乌榄开发前景良好。
1 杨永利,郭守军,马瑞君,等.乌榄叶挥发油化学成分分析[J].广西植物,2007,27(4):662~664.
2 钟桂红,丁冬纯,周燕芳.乌榄果及其种子营养成分分析[J].江西化工,2008(3):81~82.
3 吴修仁.潮汕生物资源志略[M].广州:中山大学出版社,1997:297.
4 郭守军,杨永利,黄佳红,等.乌榄果实挥发性化学成分的GC—MS分析[J].食品科学,2009,30(12):251~253.
5 江苏新医学院.中药大辞典[M].上海:上海科技出版社,1986:467~472.
6 董艳芬,梁燕玲,罗艳,等.乌榄果降压作用的实验研究[J].医学理论与实践,2006,19(8):880~882.
7 丁冬纯,钟桂红,周燕芳,等.乌榄中矿质元素含量的测定[J].广东微量元素科学,2008,15(8):54~56.
8 杨永利,郭守军,庄浩川,等.乌榄果皮色素的提取工艺及稳定性研究[J].食品科学,2007,28(5):109~114.
9 云淑娟,林荣锋,李秉超,等.正交试验法优选香菜籽挥发油提取工艺及抑菌作用研究[J].齐齐哈尔大学学报,2007,23(6):76~79.
10 孔维军,赵艳玲,山丽梅,等.正交法优选干姜挥发油提取工艺[J].中国实验方剂学,2009(3):23~24.
11 张京芳,张存莉,岁立云,等.香椿籽油浸提、精炼及理化特性分析[J].食品与发酵工业,2007,33(3):136~139.
12 赖锡湖,黄卓,李坚,等.超临界CO2萃取茶叶籽油及其成分分析[J].食品与机械,2011,27(2):38~40.
13 公谱,邓干然,曹建华,等.棕榈油的螺旋压榨制取及其脂肪酸组分分析[J].安徽农业科学,2011,39(6):3 659~3 661
