小拟南芥液泡膜H+-PPase基因OpVP1的克隆、序列分析及表达
2013-04-26徐芳赵云霞魏艳玲李超孙黎黄先忠
徐芳,赵云霞,魏艳玲,李超,孙黎,黄先忠
(石河子大学生命科学学院农业生物技术重点实验室,石河子 832003)
盐胁迫是导致农作物减产的主要非生物因素之一,土壤中过高浓度的Na+会造成植物的生理干旱,扰乱细胞的离子平衡,导致膜功能失调和代谢活动的减弱,从而抑制生长并最终导致细胞死亡[1]。植物细胞抵御Na+毒害的主要策略有Na+的外排和Na+的区域化[2]。这2个过程分别由分布在质膜和液泡膜上的Na+/H+逆向转运蛋白实现。已有研究表明,液泡膜Na+/H+逆向转运蛋白在液泡膜H+-ATPase和液泡膜H+-PPase建立的跨液泡膜质子梯度的驱动下,将细胞质中过多的Na+区域化到液泡内,从而减轻了Na+对细胞质内的各类代谢酶的危害,同时降低了细胞渗透势,进而提高植物的耐盐性和抗旱性[3-4]。
液泡膜H+-PPase是一种广泛存在于很多生物体内的H+转运酶。它只包含1条分子量约80kDa的多肽,结构简单,其底物为简单的低价焦磷酸(PPi),含有1个高能磷酸酐键[5]。在植物对水分胁迫和盐分胁迫的响应中,H+-PPase作为一种有效的质子泵调节细胞的酸度,驱动各种离子在液泡内的区隔化,扮演着重要的角色。液泡膜H+转运无机焦磷酸酶水解2个无机磷(Pi)的同时,还能将H+从细胞质经过液泡泵入膜内,起到质子泵的作用,即将PPi水解的自由能与质子跨膜转运相偶联,形成质子驱动力(△H+),为离子和其它溶质的次级转运提供动力[5]。在植物细胞中,H+-PPase除了作为一种有效的质子泵调节细胞的酸度,驱动各种离子在液泡内的区隔化外,还可作为一种调节因子控制植物生长素的运输,在植物响应逆境胁迫和调节植物生长发育的过程中可能起作用[6]。近年来,人们对植物耐盐的分子机制的研究已经取得了较大的进展。但是,植物的耐盐性是一个复杂的问题,还存在很多的问题需要进一步的阐明。所以,对植物耐盐性的进一步探索,还需从更多的盐生植物着手,挖掘耐盐相关基因,才能真正从细胞、组织和整体水平上阐明植物盐胁迫的信号转导机制,为植物的遗传改良奠定基础。
小拟南芥为十字花科无苞芥属早春短命植物,异种名是Arabidopsis pumila,现在的接受名是Olimarabidopsis pumila,是模式植物拟南芥(Arabidopsis thaliana)的近缘种[7]。小拟南芥在新疆分布较为广泛,适应新疆特殊的干旱气候,具有生活周期短、光合效率高、结实量大的特点[8]。近年来对小拟南芥耐盐生物学特性进行初步的研究,发现小拟南芥适应于新疆特殊环境,具有耐受高浓度NaCl胁迫的特性[9,10]。小拟南芥是植物生物学研究较好的材料,可以利用它研究平行进化的同源基因和进化中产生的新基因。近年来,我们一直以小拟南芥为研究材料,克隆了Na+/H+逆向转运蛋白相关基因ApNHX1[10],构建了小拟南芥经高盐胁迫的入门cDNA文库[11]。本研究通过同源克隆的方法试图从小拟南芥克隆1个液泡膜H+-PPase逆向转运蛋白基因cDNA全长序列,并利用一系列生物信息学软件分析了该蛋白的理化性质、结构域、跨膜特性、系统进化等,旨在为进一步研究该基因的功能打下基础。
1 材料与方法
1.1 材料
新疆小拟南芥(Olimarabidopsis pumila)种子为本实验室保存,小拟南芥的室内培养参照文献[10]中的方法进行。
大肠杆菌菌株 DH5α、质粒pCAMBIA2300-CaMV35S由本实验室保存,质粒pMD18-T vector、DNA Marker、限制性内切酶、Taq酶、IPTG、X-gal、DEPC购自TaKaRa公司,SMARTTM RACE cDNA Amplificatin Kit购自Clontech公司,凝胶回收试剂盒购自Promega公司,其它试剂均为国产分析纯。
1.2 方法
1.2.1 新疆小拟南芥RNA的提取和cDNA的合成
小拟南芥根、茎、叶片、花和角果等组织总RNA的提取采用TIANGEN公司的RNA prep pure Plant Kit试剂盒(离心柱型),参照说明书提取。cDNA模板第一链的制备,根据Promega公司MMLV Reverse Transcriptase合成。
1.2.2 OpVP1基因核心片段的扩增
根据NCBI上登录的液泡膜H+-PPase基因的保守序列设计扩增核心序列的1对引物:
P1:5′-GACCAGAGTGTTGTGGCTAA-3′;P2:5′-ATGTGGCGTAGTCAGGTT-3′。
以上面制备的叶片cDNA为模板,P1,P2为引物进行PCR扩增。
RT-PCR扩增体系为20μL:cDNA 3μL,10×Ex Taq Buffer 2.0μL,2.5mmol/L dNTP Mixture 1.5μL,10μmol/L的上下游引物各0.5μL,Ex Taq(5U/μL)0.2μL。
扩增条件:94℃2min后;94℃30s,56℃30 s,72℃2min,35个循环;72℃延伸10min。
PCR扩增产物经1.0%琼脂糖凝胶电泳分离,凝胶回收试剂盒回收目的片段。将目的片段连接到pMD 18-T载体上,转化大肠杆菌DH5α,挑取阳性克隆于LB培养基中过夜摇菌,小量提取质粒经酶切鉴定,将鉴定正确的质粒交由北京六合华大基因科技股份有限公司测序。
1.2.3 OpVP1的3′RACE和5′RACE扩增
根据OpVP1基因的核心片段序列,分别设计3′RACE和5′RACE引物各2个。
3′RACE引物OpVP-3-GSP1:5′-TTCGCAGGCAGTTCAACACCATC-3′;
OpVP-3-GSP2:5′-GATTCCTCCTGGTTGCC TTGTCA-3′。
5′RACE引物OpVP-5-GSP1:5′-CAGAGGTAACAGCACCAAGAACG-3′;
OpVP-5-GSP:5′-GTGCTGAATCCCTCAAC AGAGCC-3′。
RACE反应体系和扩增条件均按照SMARTTM RACE cDNA Amplification Kit说明书进行。
1.2.4 OpVP1基因开放阅读框(ORF)的扩增
根据核心片段序列、3′RACE和5′RACE扩增序列,拼接得到OpVP1基因全长cDNA序列,利用ORF Finder(www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找ORF,根据最长的ORF设计1对引物:
Bam HⅠ-OpVP1-F:5′-CGGGATCCATGGTGGCGACAGCTTTACTACCGG-3′(下划线代表Bam HⅠ酶切位点);
XbaⅠ-OpVP1-R:5′-GCTCTAGATTAGAGGTACTTGAAAAGGATACC-3′(下划线代表XbaⅠ酶切位点),用作OpVP1基因ORF的扩增。
扩增体系为20μL:cDNA 3μL,10×Ex Taq Buffer 2.0μL,2.5mmol/L dNTP Mixture 1.5 μL,10μmol/L的上下游引物各0.5μL,Ex Taq(5U/μL)0.2μL。
扩增条件:94℃2min;94℃45s,58℃45s,72℃3min,35个循环;72℃10min。
目的片段的检测和测序同1.2.2。这样构建了pMD 18-T:OpVP1载体。
1.2.5 生物信息学分析
蛋白理化性质预测用ProtParam (http://www.expasy.ch/tools/protparam.html)分析;疏水性/亲水性分析用ProtScale (http://expasy.org/tools/protscale.html)分析;跨膜结构预测用TMHMM-2.0 (http://www.cbs.dut.dk/services/TMHMM-2.0/);蛋白质的三级结构预测使用Swiss-Model workspace (http://swissmodel.expasy.org/)进行同源建模[12],并用 Swiss-Pdb Viewer 4.1.0进行可视化分析。
在 NCBI(http://www.ncbi.nlm.nih.gov)中下载相关的VP蛋白序列,利用MEGA4.1(Molec-ular Evolutionary Genetics Analysis,version4.1)软件进行部分已知VP蛋白的系统进化分析,蛋白序列比对利用Clustal W程序进行,进化树利用Neighbor-Joining方法构建,其中进行1000次Bootstrap分析以使得分枝的结果更可靠[13]。
1.2.6 OpVP1基因组织表达分析
采用实时荧光定量PCR(qRT-PCR)技术分析OpVP1在小拟南芥不同组织中的表达。
基因特异上游引物:5′-GCCTGGGACAACGCCAAGAAGTA-3′;
下游引物和5′-CACCGTGAGTGGCAAAGA A GGGA-3′。
内参引物采用Actin2引物,分别为Actin2-F:5′-GGTAACATTGTGCTCAGTGGTGG-3′;Actin2-R:5′-AACGACCTTAATCTTCATGCTGC-3′扩增。
qRT-PCR反应体系和反应程序参照TaKaRa公司产品SYBR○RPremix Ex TaqTM(Perfect Real Time)的试剂说明书的方法进行。PCR仪为罗氏Light Cycler○R480Real-Time PCR System 荧 光定量PCR仪,检测每份样品的OpVP1基因和Acitin2内参基因Ct值,每份样品3次重复。实验数据分析采用2-△Ct法进行相对定量分析,先分别计算出每组的△Ct=Ct目的基因-Ct内参基因,再根据△Ct求出2-△Ct以及标准误。使用Microsoft Excel 2007软件处理数据并作图。
2 结果与分析
2.1 小拟南芥液泡膜H+-PPase基因全长的克隆
以小拟南芥的叶片cDNA为模板,利用保守引物扩增得到1条约为1600bp的核心片段(图1-1)。将该片段克隆、测序,Blast X比对分析,发现该序列与拟南芥的AVP1(NM_101437.4)氨基酸相似性为94%,表明该序列可能为小拟南芥质子焦磷酸酶基因。通过3′RACE扩增得到700bp的3′端cDNA序列(图1-2),通过5′RACE扩增得到620bp的5′端cDNA序列(图1-3)。将3个片段拼接起来得到一全长的cDNA序列,可预测得到最长的ORF。根据该ORF序列设计扩增引物,扩增得到1个2.3kb的cDNA序列(图1-4)。
测序结果与拼接的编码序列完全吻合。这表明扩增了该基因的ORF序列,并将该基因命名为OpVP1。

图1 小拟南芥OpVP1基因的PCR扩增Fig.1 PCR amplification of gene OpVP1in Olimarabidopsis pumila
2.2 OpVP1基因的生物信息学分析
OpVP1基因的cDNA全长为2698bp,含有2313bp的完整ORF,推测编码770个氨基酸。氨基酸序列比对分析结果表明,OpVP1同拟南芥的AVP1(AAL84953)、琴叶拟南芥 AlVP1 (XP_0028901200)、芜菁的BrVP1(AET95910)的相似性最高,分别为98.4%、98.6%和95.3%。其与盐芥TsVP1(AAR08913)、棉花GhVP1(ADN96173)的相似性分别为96.2%、89.1% (图2)。

图2 OpVP1同其他植物的H+-PPase蛋白氨基酸序列比对分析Fig.2 Alignment analysis of OpVP1and H+-PPase from other plants
ProtParam分析软件推测OpVP1蛋白的分子式为C3688H5780N900O1058S34,相对分子量是80745.9Da,等电点pI 5.13。
用TMHMM-2.0预测表明OpVP1蛋白具有14个跨膜结构(图3)。利用Swiss-Model workspace进行OpVP1蛋白的同源建模(图4),表明该蛋白的三维结构是由2个相同的单体组成的蛋白质二聚体,每个单体含有26个α-螺旋和5个β-折叠。其中,α-螺旋占整个氨基酸序列的75%左右,并且像栅栏似的平行排列,说明该蛋白具有膜蛋白的特点。
将来自不同植物的液泡膜H+-PPase基因的氨基酸序列构建系统进化树分析(图5)。表明植物的H+-PPase基因同源基因按照单子叶和双子叶分别进化。小拟南芥OpVP1基因与琴叶拟南芥、拟南芥、芜菁、盐芥等H+-PPase基因遗传距离最近,属于Ⅰ型液泡膜H+-PPase基因。

图3 OpVP1蛋白的跨膜结构预测Fig.3 Transmembrane region prediction of OpVP1
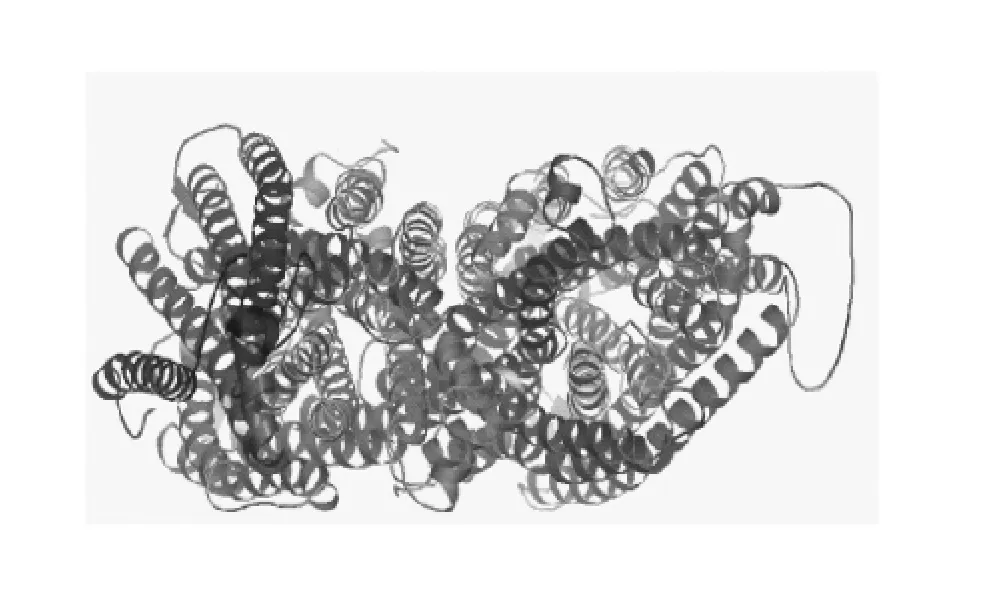
图4 OpVP1的三级结构Fig.4 Tertiary structure of OpVP1

图5 植物液泡膜H+-PPase基因的系统进化树Fig.5 Phylogentic tree of vacuole H+ -PPase gene from different plants
2.3 OpVP1基因的组织表达分析
qRT-PCR实验结果(图6)表明,OpVP1基因在小拟南芥的根、茎、叶、花、果荚中均有表达,在角果中的表达最高,其次是在花中的表达,茎和叶片中的表达量相似,根中的表达最低。
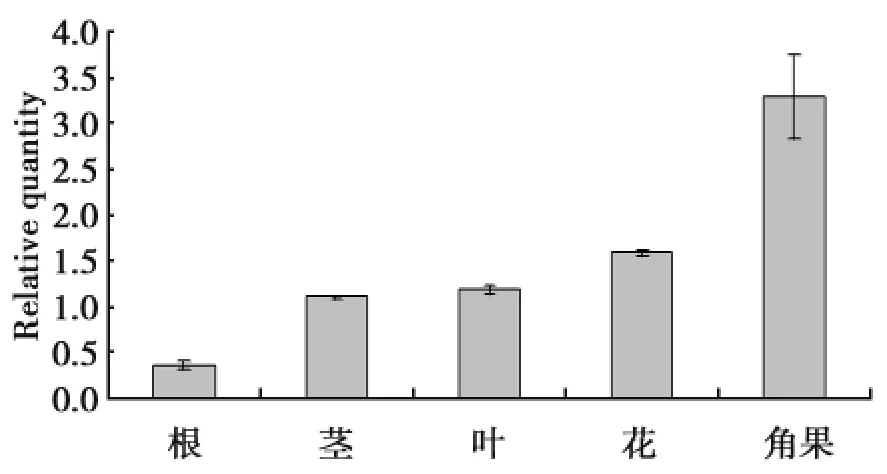
图6 qRT-PCR分析OpVP1基因的组织表达Fig.6 Expression analysis of OpVP1in different tissue of Olimarabidopsis pumila by qRT-PCR
3 讨论与结论
植物液泡膜H+-PPase在植物的耐盐中起着作用[2-4]。通 过 RT-PCR 和 RACE 技术,从新疆 短命耐盐植物小拟南芥中克隆了1个液泡膜H+-PPase基因OpVP1,OpVP1基因的cDNA全长为2698 bp,5′非编码区(UTR)长度为178bp,3′非编码区(UTR)长度为206bp,ORF长2313bp,推测该基因编码770个氨基酸。OpVP1蛋白的分子量约80 KDa,等电点pI 5.13。三级结构预测表明OpVP1是由2个相同的单体组成的蛋白质二聚体,每个单体主要以α-螺旋为主。
高等植物中存在Ⅰ型和Ⅱ型2种类型的液泡膜H+-PPase,Ⅰ型依赖K+激活而适度被Ca2+激活,主要分布在液泡膜上,Ⅱ型对K+不敏感而对Ca2+极其敏感,主要分布在高尔基体和溶酶体上[14-15]。这2种类型的H+-PPase在氨基酸序列上亲缘关系较远,它们之间的同源性仅有37%~39%[16]。本研究克隆的小拟南芥H+-PPase基因OpVP1与模式植物拟南芥Ⅰ型H+-PPase基因AVP1的同源性为98.2%,而与Ⅱ型H+-PPase基因AVP2的同源性仅为40%,系统进化分析也表明OpVP1属于Ⅰ型H+-PPase基因。
基因表达分析结果表明OpVP1基因在根、茎、叶、花和果实中都有表达,但在果实中的表达比其它组织中的表达量高。已有的研究表明H+-PPase基因在不同植物的不同组织中表达量不相同,可能在植物在长期的进化中H+-PPase基因的功能发生了分歧。番茄的Ⅰ型的H+-PPase基因SlVP1在果实早期发育中起着重要作用[16]。
后期拟进行OpVP1基因的反式作用因子和顺式作用元件的分析。我们的研究将进一步解析植物H+-PPase基因家族如何行使功能的,丰富植物耐盐信号传导的分子机制。
[1]Zhu J K.Plant salt tolerance[J].Trends in Plant Science,2001,6:66-71.
[2]Frommer W B,Ludewig U,Rentsch D.Taking transgenic plants with a pinch of salt[J].Science,1999,285:1222-1223.
[3]Blum Wald E,Poole R J.Na+/H+antiport in isolated tonoplast vesicles from storage tissue of Beta vulgaris[J].Plant Physiology,1985,78:163-167.
[4]Apse M P,Aharon G S,Snedden W A,et al.Salt tolerance conferred by over expression of a vacuolar Na+/H+antiporter in Arabidopsis[J].Science,1999,285(5431):1256-1258.
[5]包爱科,张金林,郭正刚,等.液泡膜 H+-PPase与植物耐盐性[J].植物生理学通讯,2006,42(4):777-783.
[6] Maeshima M.Vacuolar H+-pyrophosphatase.Biochim Biophys Acta[J].2000,1465(1):37-51.
[7]孙稚颖,郑纪庆,李法曾.拟南芥属的系统位置:种皮及分子证据[J].植物学通报,2008,25(5):565-573.
[8]张海波,刘彭,刘立鸿,等.新疆短命植物小拟南芥(Arabidopsis pumila)种子萌发特性及其生态适应性[J].生态学报,2007,27(10):4311-4316.
[9]张海波,刘彭,刘立鸿,等.新疆短命植物小拟南芥耐盐性的初步研究[J].西北植物学报,2007,27(2):286-290.
[10]院海英,顾超,徐芳,等.小拟南芥 Na+/H+逆向转运蛋白基因的克隆及生物信息学分析[J].石河子大学学报:自然科学版,2011,29(4):402-407.
[11]院海英,徐芳,吕新华,等.小拟南芥高盐胁迫诱导cDNA文库的构建与测序分析[J].石河子大学学报:自然科学版,2012,30(1):1-3.
[12]Kumar S,Nei M,Dudley J,et al.MEGA:A biologist-centric software for evolutionary analysis of DNA and protein sequences[J].Briefings in Bioinformatics,2008,9(4):299-306.
[13]Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL Workspace:a web-based environment for protein structure homology modeling[J].Bioinformatics,2006,22:195-201.
[14]Serrano A,Perez-Castineira J R,Baltscheffsky M,et al.H+-PPase:Yesterday,today and tomorrow[J].IUBMB Life,2007,59:76-83.
[15]Gaxiola R A,Palmgren M G,Schumacher K,Plant proton pumps[J].FEBS Letters,2007,581:2204-2214.
[16]Mohammed S A,Nishio S,Takahashi H,et al.Role of vacuolar H+-inorganic pyrophosphatase in tomato fruit development[J].Journal of Experimental Botany,2012,63(15):5613-5621.
