咳嗽及肺部游走性阴影为主要表现的抗中性粒细胞胞浆抗体相关性血管炎1例
2013-04-24张晓军张桂芝钱小顺
郭 军, 张晓军, 张桂芝, 张 东, 钱小顺
咳嗽及肺部游走性阴影为主要表现的抗中性粒细胞胞浆抗体相关性血管炎1例
郭 军*, 张晓军, 张桂芝, 张 东, 钱小顺
(解放军总医院南楼临床部呼吸科, 北京 100853)
笔者成功诊治1例65岁男性抗中性粒细胞胞浆抗体(ANCA)相关性血管炎患者。该患者主要表现为慢性咳嗽和肺部游走性阴影,曾被诊断为淋巴细胞性间质性肺炎,激素治疗有效,病情复发后查MPO-ANCA阳性,结合肺穿刺活检明确诊断为ANCA相关性血管炎,加用糖皮质激素和环磷酰胺后病情再次缓解。根据文献报道和笔者的临床经验,ANCA相关性血管炎临床表现复杂,缺乏特异性,常被误诊。呼吸科医师对ANCA相关性血管炎肺部受累特点应熟悉,要重视血清ANCA的筛查,以便于本病的早期诊断。
抗中性粒细胞胞浆抗体; 血管炎; 肺部受累; 诊断
1 病例摘要
患者,男性,65岁,因“间断咳嗽、肺部游走性阴影6年余”于2012年6月15日入院。患者2006年7月无明显诱因下出现干咳,无发热、喘息和咯血,先后服用多种抗生素和止咳药物,症状无明显缓解,2007年3月初收入院诊疗,查血常规正常;红细胞沉降率45mm/h;C-反应蛋白升高;抗核抗体和抗可提取核抗原为阴性;肺功能提示轻度限制性通气功能障碍;胸部CT提示双肺散在结节、团块状阴影;PET-CT提示双肺多发轻度高代谢灶,右肺下叶高代谢灶SUVmax3.83。2007年3月底行CT引导下经皮肺穿刺(右下肺后基底段SUVmax3.83处;图1),报告淋巴细胞性间质性肺炎伴急性炎症,CD3(+),CD20(+),可疑CD68(+),CD30(-)。诊断考虑为“淋巴细胞性间质性肺炎”(lymphocytic interstitial pneumonia,LIP),于3月30日开始口服甲泼尼龙64mg,1次/d。2周后复查胸部CT提示双肺多发阴影明显吸收,出院随访。激素治疗3个月后咳嗽基本消失,胸部CT证实肺内阴影完全吸收,甲泼尼龙规律减量至8mg(1次/d)维持。2008年上半年患者先后出现右耳听力受损和右眼眶后肿物(炎性假瘤),眼眶肿物切除后病理提示炎性假瘤。2008年8月胸部CT提示原肺内结节状阴影吸收无复发(图2),2009年1月停服激素。2011年3月患者干咳再次加重,胸部CT提示左上肺尖后段、左下肺背段和后基底段新发结节状阴影,此后随访未予特殊治疗。2012年4月患者咳嗽加重,间断感下肢关节和肌肉酸痛,5月下旬胸部CT提示左下肺后基底段阴影增大,纵隔内未见淋巴结肿大(图3)。为明确肺部病变性质再入院。既往史:自诉有“慢性鼻炎”史,可疑结核感染,有股骨头缺血性坏死病史。
入院查体 生命体征平稳,自然状态动脉血氧饱和度97%,无皮疹,浅表淋巴结无肿大,双肺呼吸音清,深吸气末左肺底可闻及少许水泡音,未闻及哮鸣音。心脏、腹部无阳性体征。双下肢无水肿。
诊疗经过 入院诊断考虑“咳嗽、肺部阴影性质待定”。完善检查:血尿便常规、生化全套、凝血功能、红细胞沉降率、C-反应蛋白、补体、免疫球蛋白、转铁蛋白、血清蛋白电泳、肿瘤标志物全套均无异常;结核抗体、真菌D-葡聚糖试验、军团菌和肺炎支原体抗体均阴性;血清血管紧张素转换酶正常;外周血淋巴细胞亚群:CD4+细胞比例升高,CD8+细胞比例降低;痰培养抗酸染色3次阴性、淋巴细胞培养+干扰素测定提示结核分枝杆菌感染可能性<5%(解放军第309医院);抗核抗体、抗可提取核抗原和抗角蛋白抗体谱均为阴性;抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody,ANCA)阳性p型、ANCA分型髓过氧化物酶(myeloperoxidase,MPO)阳性;肺功能检查通气和弥散均正常、呼气末一氧化氮38.1ppb;电子气管镜检查除气管和支气管黏膜充血明显外,余无明显异常,右中叶内侧段和左上叶下舌段行支气管肺泡灌洗,回收率30%,肺泡灌洗液中,巨噬细胞70%~75%,淋巴细胞20%,中性粒细胞5%~10%,嗜酸性粒细胞0%,CD4/CD8=5.0。2012年7月5日CT引导下经皮肺穿刺(左下肺后基底段),CT扫描见左下肺结节影有缩小,活检病理送北京协和医院病理会诊中心,镜下见肺组织病变呈节段性分布,病变多在血管周,血管周淋巴细胞及少量浆细胞及嗜酸性粒细胞浸润,少许炎症细胞浸及血管壁,无纤维素样坏死,病变区外肺组织炎症轻微但血管壁较厚。同时再次复习2007年3月肺穿刺病理,病变分布不均匀,其中一条肺组织间隔增宽,淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润,病变沿血管走形,血管周细胞浸润显著,可见淋巴滤泡形成。结合临床特点,诊断考虑为“ANCA相关性血管炎”,8月10日开始加用甲泼尼龙16mg(1次/d)口服和环磷酰胺400mg(1次/2周)注射治疗后,患者无不适,于2012年8月31日出院门诊长期随访。
最后诊断 MPO-ANCA相关性血管炎。
随访情况 患者规律在风湿科和呼吸科门诊随访,甲泼尼龙16mg(1次/d)服用1个月后开始减量,每15d减1/4片,至6mg(1次/d)时长期维持。环磷酰胺400mg(1次/2周)共注射6次后,改为400mg(1次/4~6周)注射1次。2012年11月复查胸部CT提示左下肺后基底段结节影基本消失(图4)。
2 临床病理讨论
郭军经治医师(南楼呼吸科) 本患者为老年男性,慢性迁延病程,起病隐匿,表现为咳嗽和多发肺部阴影,无发热、喘息和咯血;体检肺部无阳性体征;化验外周血嗜酸性粒细胞正常,发病初曾有炎性指标升高,但当时未行ANCA检测;糖皮质激素治疗可明显缓解病情,肺部阴影一度消失。但停用激素后肺部阴影复发,且病灶位置呈游走性;逐渐出现多器官受累(眼眶后炎性假瘤、听力损伤和关节痛)的表现,但无肾脏病变;此后查ANCA过筛P-ANCA阳性,分型MPO-ANCA阳性;肺穿刺组织病理学提示病变多在血管周,血管周淋巴细胞及少量浆细胞及嗜酸性粒细胞浸润,少许炎症细胞浸及血管壁。综合以上病史特点,特别是血清学ANCA阳性和肺组织病理学特征,诊断上应该考虑为ANCA相关性血管炎。
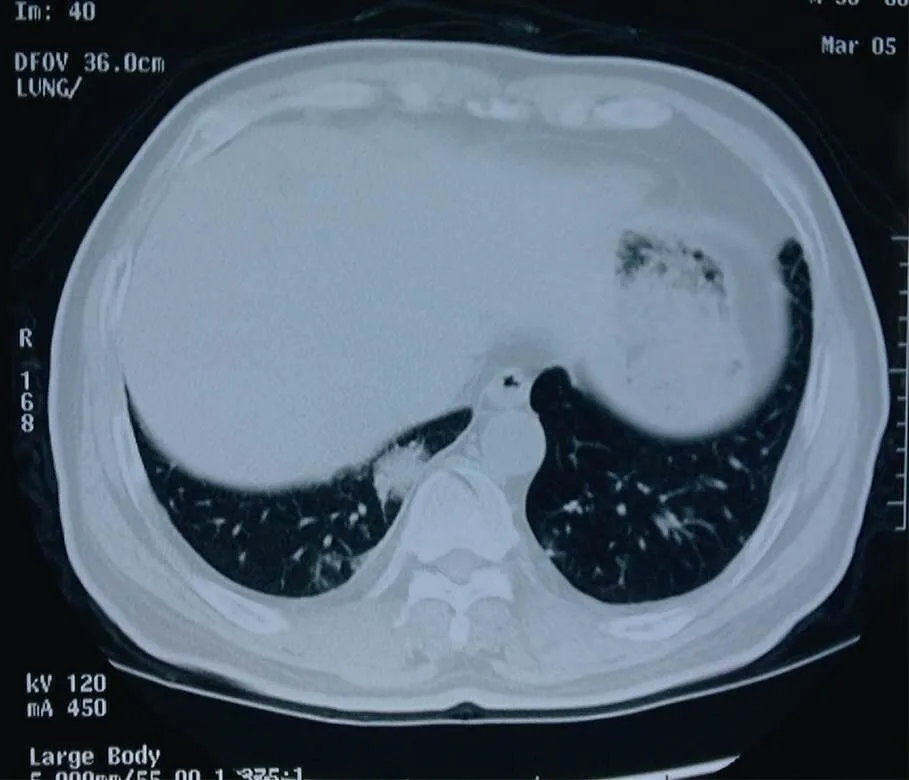
图1 激素治疗前(2007年3月)右下肺后基底段结节影
Figure 1 Posterior basal segment nodules of right lower lung before glucocorticoids therapy (March, 2007)

图2 激素治疗1年后(2008年5月)右下肺后基底段结节影消失
Figure 2 Posterior basal segment nodules of right lower lung disappeared after glucocorticoids trerapy for 1 year (May, 2008)
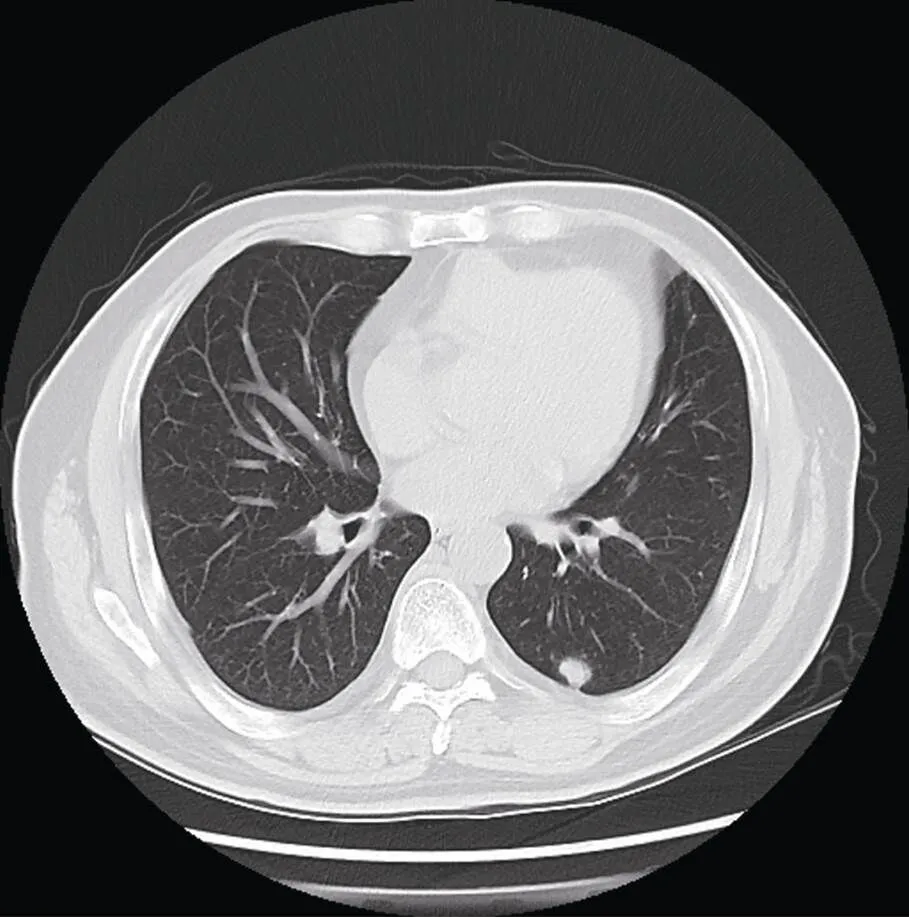
图3 激素和环磷酰胺治疗前(2012年5月)左下肺后基底段结节影
Figure 3 Posterior basal segment nodules of left lower lung before glucocorticoids and cyclophosphamide therapy (May, 2012)
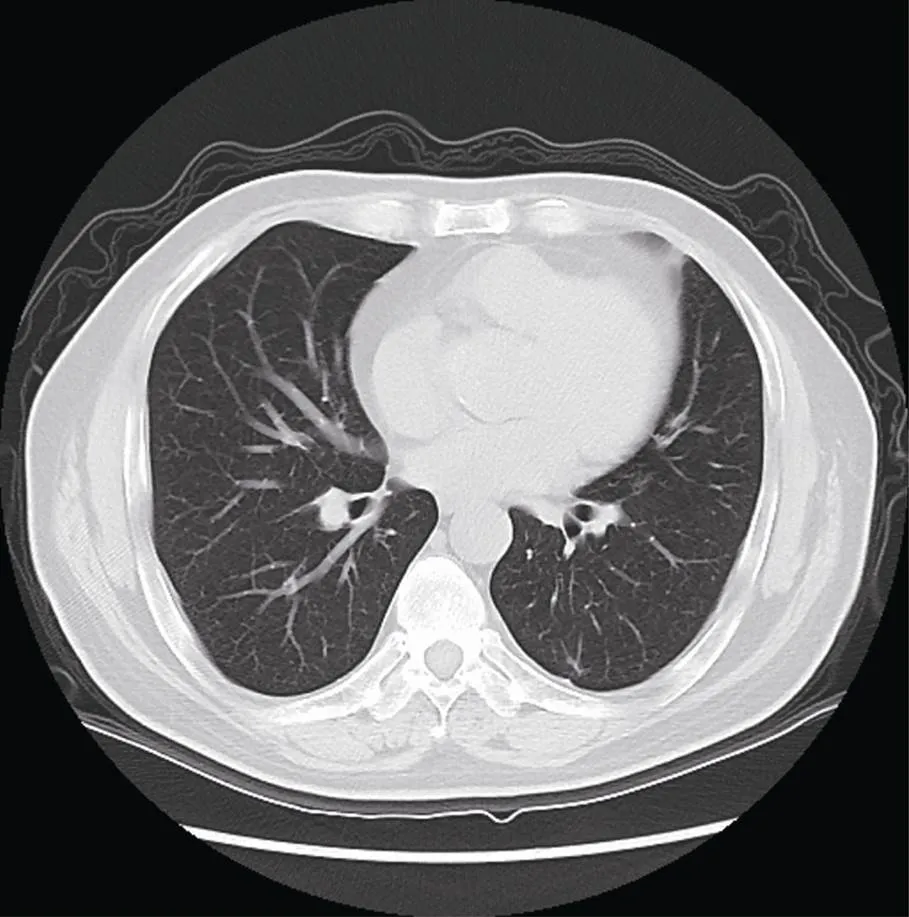
图4 激素和环磷酰胺治疗3个月后(2012年11月)左下肺后基底段结节影消失
Figure 4 Posterior basal segment nodules of left lower lung disappeared after glucocorticoids and cyclophosphamide therapy for 3 months (November, 2012)
张晓军主管医师(南楼呼吸科) ANCA相关性血管炎是累及全身多个系统、以小血管损害为主、血清ANCA阳性的一组疾病。虽然ANCA相关性血管炎可见于各年龄组,但约50%的患者>65岁的老年人[1],其临床表现复杂多变,发病率低,其症状无特异性,与感染、肿瘤和血栓栓塞疾病等有重叠,诊断上较为困难。ANCA相关性血管炎累及器官以肾脏最多见,肺脏为其次,以呼吸系统症状为首发表现的患者并不少见。肺脏受累常见表现:可出现咳嗽、咳痰、呼吸困难、咯血和胸痛等症状,其中弥漫性肺泡出血可导致呼吸衰竭而危及生命;体征上可出现干湿啰音、爆裂音,或肺部体征无异常;胸部影像学双肺受累多见,可出现斑片状影、结节影、磨玻璃影、团块状影、网格状和蜂窝状影、肺部空洞、胸腔积液等[2]。上呼吸道受累也可见于部分ANCA相关性血管炎患者,表现为慢性难治性鼻窦炎、上呼吸道溃疡造成的软组织或骨结构破坏性的病变。与ANCA相关性血管炎肺部受累还需鉴别的肺血管炎病有坏死性结节病样肉芽肿、支气管中心性肉芽肿病、良性淋巴细胞血管炎和肉芽肿病、淋巴瘤样肉芽肿病,鉴别的关键要依靠肺组织活检。
张东主诊医师(南楼呼吸科) 同意前面两级临床医师的分析,目前诊断“ANCA相关性血管炎”证据充分。本患者病程中曾被诊断为LIP,有必要再复习一下该病的临床特点。LIP是局限于肺部的以成熟、致密的淋巴细胞、浆细胞增殖和浸润为主的间质性炎症[3]。该病较为罕见,国内外报道均不多,多数为继发性,与类风湿关节炎、干燥综合征等自身免疫性疾病有密切关系[4],也有部分学者认为与EB病毒和HIV等病毒感染有关[5],特发性LIP即是特发性间质性肺炎的一种病理类型。上海肺科医院陈宝等[6]报道了3例成人特发性LIP,总结诊治体会并复习文献认为诊断特发性LIP需要满足以下条件:(1)肺部影像学主要表现为多发小结节和小囊肿;(2)伴高γ球蛋白血症;(3)肺组织病理主要表现为间质大量多克隆浆细胞浸润;(4)无肺外器官受累;(5)需排除可导致γ球蛋白增高的疾病(如慢性肝病、慢性感染和自身免疫性疾病等),类似影像学改变疾病(如肺结核、真菌感染和血源性肺脓肿)和病理上肺间质亦以浆细胞浸润为主的疾病(如浆细胞性间质性肺炎、慢性外源性过敏性肺泡炎、黏膜相关性淋巴瘤和Castleman病等)。结合该患者临床表现和辅助检查,可以除外LIP的诊断。通过本例总结的经验就是,对于疑难肺部疾病的诊断必须将临床特点和组织病理结果紧密结合分析,不可过分依赖任何一方的诊断价值。
刘鸿瑞教授(北京协和医院病理科) 患者2012年7月肺活检(左下肺后基底段)示肺组织病变呈节段性分布,病变多在血管周,肺间质增宽,血管周淋巴细胞及少量浆细胞及嗜酸性粒细胞浸润,少许炎症细胞(主要为淋巴细胞)浸及血管壁,但无纤维素样坏死,病变区外肺组织炎症轻微但血管壁较厚。结合患者存在多器官受累及血清中有自身抗体等临床特点,考虑肺部病变为继发系统性疾病改变。复习患者2007年3月肺穿刺活检(右下肺后基底段),病变分布不均匀,其中一条肺组织间隔增宽,淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润,病变沿血管走形,血管周细胞浸润为著,可见淋巴滤泡形成,肺泡Ⅱ型上皮细胞增生,肺泡腔内可见巨噬细胞聚集。发病初根据病理曾考虑LIP,而LIP多为继发性,其与自身免疫性疾病关系较密切,特征是小叶间隔和肺泡间隔增厚,间质内大量细胞渗出,包括有成熟的淋巴细胞、免疫母细胞、浆细胞和组织细胞,但主要还是多型性浆细胞和T细胞[7]。本患者2007年即行肺活检,但未能早期确诊,分析原因,与当时未关注ANCA检测、未全面将病理和临床特点结合分析、疾病早期多器官受累的临床特征尚未充分显现等有关。故再次强调,在间质性肺疾病的诊断中通常都需要临床、影像和病理科的医师密切协作,方可做出最缜密的诊断。
张江林主任医师(风湿科) 本患者以咳嗽、肺内多发结节和斑片样阴影起病,起病初红细胞沉降率增快,C-反应蛋白升高,曾用大剂量糖皮质激素治疗后病情明显缓解,但停用激素2年后肺部阴影复发,肺内病灶位置呈游走性,病程中还出现右耳和右眼部的受累,本次住院期间查p-ANCA阳性、分型MPO阳性,结合肺穿刺组织病理学特征,目前“MPO-ANCA相关性血管炎”诊断非常明确。ANCA相关性血管炎是一种全身多器官及系统受累的自身免疫性疾病,以血清ANCA阳性和病理学检查为主要诊断依据,主要病理特征为血管壁的炎性细胞浸润和(或)细胞壁坏死[8]。ANCA相关性血管炎的分类包括:(1)肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA),过去称为韦格纳肉芽肿病(Wegener’s granulomatosis,WG)[9];(2)显微镜下多血管炎(microscopic polyangiitis,MPA);(3)嗜酸性粒细胞性肉芽肿性多血管炎(eosinophilic GPA,EGPA),过去称为Churg-Strauss综合征[10],ANCA是此类疾病的血清学诊断指标。ANCA按照荧光类型可分为c-ANCA和p-ANCA。c-ANCA为胞浆型,靶抗原为抗蛋白酶3,对活动性GPA的诊断有较高敏感性和特异性,滴度与疾病活动性相关;p-ANCA为核周型,主要靶抗原为MPO,对MPA的诊断有重要价值。在中国,ANCA相关性血管炎中MPA最多,约占80%,GPA约占20%,而EGPA相对罕见,我国患者血清ANCA多识别MPO,其中多数为MPA[1]。该患者ANCA分型MPO阳性,似乎支持MPA的诊断,但结合临床却应考虑GPA可能性较大。因为MPA多出现肺泡出血,累及肾脏(肾小球肾炎)的可能性几乎是100%,而该患者无肾脏受累证据,且病程中出现右眼眶后炎性假瘤,这是GPA较特征性的表现,故应该考虑为局限性GPA。因为GPA和MPA的临床特征的确存在着部分重叠,两者关系并非绝对排他,故越来越多地使用“ANCA相关性血管炎”这一术语,这也意味着它们可能是单一疾病过程中的不同变种[11],且ANCA相关性血管炎的治疗原则和方案完全一样,故针对该患者诊断上严格细分为GPA或MPA并无临床实际意义。患者目前红细胞沉降率和炎性指标正常,肺部病变有部分自发吸收,但是考虑ANCA与病情活动程度有关联,故考虑病情仍有轻微活动,值得治疗。可给予经典的糖皮质激素联合环磷酰胺来治疗,治疗强度可较常规方案降低,予甲泼尼龙16mg(1次/d)口服和环磷酰胺400mg(1次/2周)注射,激素服用1个月后开始缓慢减量,环磷酰胺注射累积一定剂量后可随诊中调整为口服免疫抑制剂,如甲氨蝶呤片。需要指出的是GPA是较易复发的疾病,需长期严密随访,及时调整治疗。
[1] 赵明辉. 抗中性粒细胞胞浆抗体相关小血管炎研究进展[J]. 中国实用内科杂志, 2012, 32(9): 680−683.
[2] 李晓辕, 刘佳育, 徐 伟. ANCA相关性血管炎肺部表现[J]. 中国老年学杂志, 2011, 31(10): 3941−3943.
[3] American Thoracic Society, European Respiratory Society. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias[J]. Am J Respir Crit Care Med, 2002, 165(2): 277−304.
[4] Cha SI, Fessler MB, Cool CD,Lymphoid interstitial pneumonia: clinical features, associations and prognosis[J]. Eur Respir J, 2006, 28(2): 364−369.
[5] Kurosu K, Yumoto N, Rom WN,Oligoclonal T cell expansions in pulmonary lymphoproliferative disorders: demonstration of the frequent occurrence of oligoclonal T cells in human immunodeficiency virus-related lymphoid interstitial pneumonia[J]. Am J Respir Crit Care Med, 2002, 165(2): 254−259.
[6] 陈 宝, 李惠萍, 张容轩, 等. 成人特发性淋巴细胞性间质性肺炎三例并文献复习[J]. 中华内科杂志, 2008, 47(6): 486−490.
[7] Swigris JJ, Berry GJ, Raffin TA,Lymphoid interstitial pneumonia: a narrative review[J]. Chest, 2002, 122(6): 2150−2164.
[8] Bosch X, Guilabert A, Espinosa G,Treatment of antineutrophil cytoplasmic antibody-associated vasculitis[J]. JAMA, 2007, 298(6): 655−699.
[9] Falk RJ, Gross WL, Guillevin L,Granulomatosis with polyangiitis (Wegener’s): an alternative name for Wegener’s granulomatosis[J]. Ann Rheum Dis, 2011, 70(4): 704.
[10] Furuta S, Jayne DR. Antineutrophil cytoplasm antibody-associated vasculitis: recent developments[J]. Kidney Int, 2013, doi: 10.1038/ki.2013.24. [Epub ahead of print]
[11] Mahr A, Katsahian S, Varet H,Revisiting the classification of clinical phenotypes of anti-neutrophil cytoplasmic antibody-associated vasculitis: a cluster analysis[J]. Ann Rheum Dis, 2013, 72(6): 1003−1010.
(编辑: 王雪萍)
A case of antineutrophil cytoplasmic antibody associated vasculitis manifested with chronic cough and pulmonary migratory shadows
GUO Jun*, ZHANG Xiao-Jun, ZHANG Gui-Zhi, ZHANG Dong, QIAN Xiao-Shun
(Department of Geriatric Respiratory Medicine, Chinese PLA General Hospital, Beijing 100853, China)
We reported a successful diagnosis and treatment of a 65-year-old male patient with pulmonary lesion caused by antineutrophil cytoplasmic antibody (ANCA) associated vasculitis. The main manifestations of the patient were chronic cough and pulmonary migratory shadows. He was once diagnosed as lymphocytic interstitial pneumonia, and received effective corticosteroid mono-treatment. MPO-ANCA was positive after the disease relapsed, and ultimately, the diagnosis of ANCA associated vasculitis was made after lung puncture biopsy. After combination administration of corticosteroid and cyclophosphamide, all signs and symptoms were relieved. According to literature and our clinical experience, ANCA associated vasculitis had complex, non-specific clinical manifestations, and thus, was often misdiagnosed. In order to facilitate the early diagnosis of this disease, respiratory physicians should be familiar with the characteristics of the pulmonary involvement of ANCA associated vasculitis, and pay more attention to serum ANCA screening.
antineutrophil cytoplasmic antibody; vasculitis; pulmonary involvement; diagnosis
R593.2
A
10.3724/SP.J.1264.2013.00201
2013−04−23;
2013−05−21
郭 军, E-mail: dragonet76@163.com
