常压室温等离子体快速诱变酒精酵母及其突变株的特性研究
2013-04-23王方方孙沛勇银会娟
王方方,孙沛勇,银会娟,尹 迪
(河南天冠企业集团有限公司,河南 南阳 473000)
目前,世界各国经济发展都面临能源供应安全和生态环境保护的双重压力,为了实现能源、环境和经济的持续协调发展,各国都在致力于可再生能源的开发和研究[1-2]。乙醇除广泛应用于食品、医药卫生、化工等领域外,还被公认为最具有发展前景的可再生清洁能源之一。我国燃料乙醇产业从2001年起步,现己扩大到十几个省份。2002年国家在黑龙江、河南、安徽三省新上了3个总设计规模为90万吨的建设项目[3-5]。2005年世界乙醇的总产量达到108亿加仑,2000~2005年其产量以平均每年18.5%的速度递增[6]。未来乙醇的应用主要体现在3个方面:车用燃料、燃料电池的燃料以及成为支撑现代以乙烯为原料的石化工业的基础原料。目前世界乙醇产量的80%以上是通过酿酒酵母以淀粉质或其他糖质原料发酵生产的[7]。为了提高淀粉利用率,降低粮耗,获得高产酒精酵母菌株显得尤为重要。新的微生物菌种决定着微生物代谢产品,但菌种的生产能力高低,则决定着微生物产品的开发和生产前景,因此,微生物的诱变育种是极其重要的环节[8]。近期利用常压室温等离子体技术对酒精酵母进行诱变处理,效果比较理想。
常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变技术具有射流温度低、产生的等离子体均匀、无需真空装置、操作简易、成本低、与生物大分子和细胞作用明显等优点[9-10],已成为快速突变微生物基因组的有效方法。前期的研究结果表明,ARTP技术可以快速有效地突变细菌、微藻、酵母菌等微生物[11-12]。
对酒精酵母来说发酵终了酒精含量是一个重要指标,其测定方法使用蒸馏法[13]。本研究通过对出发菌株和诱变后单菌落进行发酵实验,综合比较实验结果,进行复筛-再复筛的验证以及遗传稳定性的实验,以确定出最优突变株。
1 材料与方法
1.1 材料与试剂
培养基:种子培养基:自制麦芽汁,浓度12°Bx~14°Bx,121℃、30min灭菌;斜面:在麦芽汁中加入1.8%(w/v)的琼脂粉,121℃、30min灭菌;发酵培养基:生产用糖化醪,100℃、90min灭菌。
菌株:生产用酵母菌。
1.2 仪器与设备
ME403E电子天平:梅特勒-托利多;SHP-80(D)电热恒温培养箱:上海森信实验仪器有限公司;ZHWY-211C恒温培养振荡器:上海智城分析仪器制造有限公司;LDZX-150KBS立式电热压力蒸汽灭菌锅:上海申安医疗器械厂。
1.3 方法
1.3.1 培养及保存方法
诱变前处理:原种由斜面活化后,挑取适量接入种子培养基中,28℃、150r/min培养12h;诱变后筛分:平板单菌落接入种子培养基,于28℃进行液体试管培养,16h后转接入三角瓶进行28℃、150r/min摇床培养,9h后转接入发酵培养基进行发酵实验;保存方法:4℃低温保存。
1.3.2 ARTP诱变方法
诱变至对数生长期的酵母种子液经预处理后涂布于载片表面,将载片置于载台上,用ARTP诱变育种系统2mm射距照射,分别照射0s、15s、30s、45s、60s、75s、90s、120s、150s、180s,将经过处理后的载片放于装有1mL生理盐水的离心管中,振荡均匀后稀释至10-1、10-2、10-33个梯度,每个梯度涂布平板2个。
1.3.3 分析方法[13]
酒精度测定分析方法:准确量取发酵醪100mL,注入1000mL平底烧瓶内,加水120mL,将平底烧瓶和冷凝器连接好,注意勿使漏气。置电炉上加热蒸馏,馏出液收集于100mL量筒内,当馏出液达到100mL刻度时,取下摇匀,以酒精度计与温度计同时测其酒度和温度,根据酒精度和温度换算表,换算为20℃时的酒精度。
1.3.4 计算公式

2 结果与分析
2.1 ARTP诱变致死率曲线的测定
前期研究发现,等离子体对细菌细胞壁、细胞膜及蛋白质都有显著的作用效果,处理时间长会导致细胞壁部分或者完全的破裂,释放出细胞内蛋白[14]。这是由于等离子体产生的活性粒子能够破坏细胞结构也能够穿过细胞壁到达细胞内,打断基因、蛋白键等,从而导致大部分微生物死亡[15]。但少数经过ARTP照射的微生物会通过本身的自动修复系统修复存活,并在这一过程中产生基因突变。因此,选择合适的ARTP操作条件能够实现微生物的快速诱变。
由图1可知,等离子体对酵母菌的杀伤力有一个突变的过程,处理时间低于60s时,酵母菌的致死率为0;处理时间为75s时,致死率约为24%;而处理时间为90s时,有一个显著突变,从24%跃升为90%,因此可以确定酵母的致死时间为90s。由于菌株的突变具有随机性,其致死率和突变率及突变方向的关系不是十分清楚,与诱变方法和菌种本身的特性密切相关。本实验选取致死率在90%以上的单菌落进行筛分实验。

图1 酒精酵母的致死率曲线Fig.1 Fatality rate curve of alcohol-producing yeast
2.2 酵母突变体的筛分实验
由于实验条件所限,对于酵母突变体的筛分实验选用传统的筛分方法。从ARTP处理并经梯度稀释得到的平板上挑取单菌落,接种至10mL装量的液体试管中,28℃培养16h,接入装有80mL培养基的小三角瓶中,28℃、150r/min摇床培养,8h后接入270g发酵培养基中,接种量为10%,34℃静置培养。发酵期间进行定时称质量,以失质量不超过0.2g/h为发酵终点。
对初筛试验的结果进行统计,参照不同的突变标准得出的正负突变率数值见表1。

表1 不同突变标准下正负突变率结果统计Table 1 Positive or negative mutation rate under different mutation standards
突变标准是指(目标菌酒精度/出发菌酒精度-1)*100%所得的结果。从表1结果可以看出,菌株发生正负突变的情况均有发生,且随着突变标准的不断提高,负突变率结果逐渐高于正突变率。对于突变标准超过3%的5个菌株,其发酵酒精度和糖醇转化率见表2。
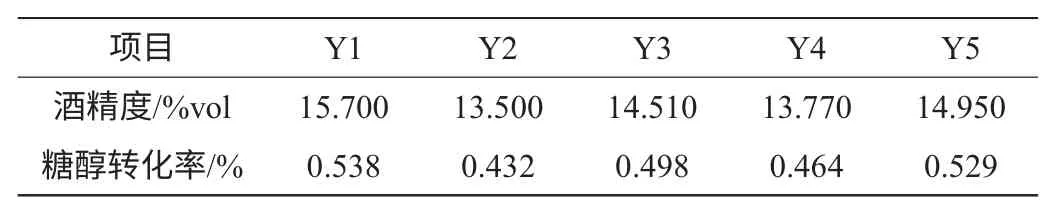
表2 较优突变株的初筛结果Table 2 Preliminary screening result of excellent mutant strains
表2中Y2和Y4酒精度较低,是因为发酵培养基初始浓度低的原故。因为发酵所使用的糖化醪直接从生产上糖化罐中取用,不同的配料批次糖化醪浓度存在一定的差别。
2.3 较优突变株的复筛实验
为了验证突变株的发酵实验结果,对初筛中发酵结果比较理想的5株突变株Y1、Y2、Y3、Y4和Y5和出发菌株再连续进行2次发酵实验,发酵结果见表3。
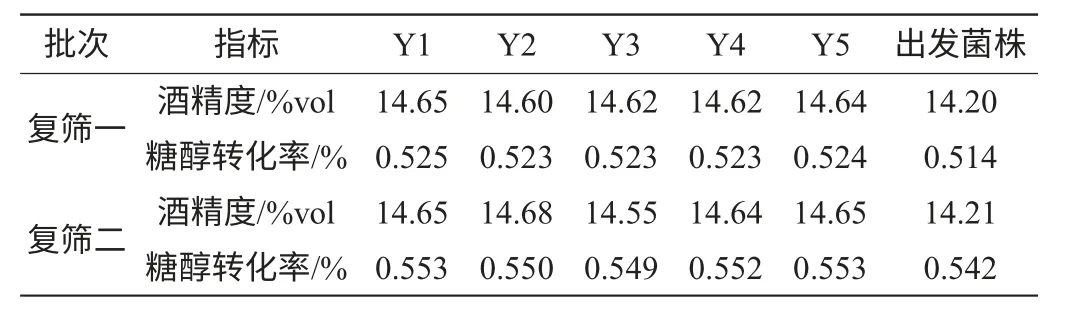
表3 较优突变株的复筛结果Table 3 Rescreening result of excellent mutant strains
从表3发酵结果可以看出,这5株菌发酵稳定性和平行性较好,其发酵结果趋势比较一致。
2.4 遗传稳定性实验
通过初筛和复筛实验结果可以看出,筛选出的5株突变株较出发菌株酒精度有一定程度的提高。为了检测筛选出菌株的遗传稳定性,对突变株进行传代,并对某些传代次数的突变株进行发酵实验,实验结果见表4。

表4 较优突变株遗传稳定性实验结果Table 4 Genetic stability experiments result of excellent mutant strains
分析结果表明,等离子诱变的酵母突变株都保持着良好的遗传稳定性。
2.5 发酵期间失重情况变化

图2 酵母菌发酵期间失重情况Fig.2 Weight loss during alcohol-producing yeast fermentation period
从图2酵母菌发酵失重情况可以看出,菌株的发酵周期分为延迟期、对数期以及稳定期。刚接入发酵培养基时,菌株需要一个逐渐适应新环境的过程,此为延迟期,该阶段菌种的发酵表现为延迟,失重缓慢;菌株适应新环境后,快速利用培养基中的糖分,发酵迅速;发酵后期,培养基中糖分基本消耗殆尽,发酵缓慢,失重情况趋于稳定。对比出发菌株,突变株在发酵前期速度慢于出发菌株,随着发酵过程的不断进行,突变株失重逐渐超过出发菌株,至发酵结束,失重高于出发菌株。通过失重情况可初步判断突变株的发酵结果优于出发菌株。
3 结论
通过系列实验结果可知,ARTP诱变育种方法可快速有效地诱变酒精酵母,而且突变效果良好。通过对近100个单菌落的初筛,以发酵终酒精度为指标,其中正突变率超过3%的突变株有5个。通过对5个较优突变株的反复筛分,确定其突变效果。并对具有优良突变效果的突变株进行数次传代,通过实验验证突变株具有较好的遗传稳定性。
[1]FARRELL AE,PLEVIN R J,TURNER BT,et al.Ethanol can contribute to energy and environment goals[J].Science,2006,311(27):506-508.
[2]ROBERT F.Cellulosic ethanol:Biofuel researchers prepare to reap a new harvest[J].Science,2007,315(16):1488-1491.
[3]沈 煜,王 颖,鲍晓明,等.酿酒酵母木糖发酵酒精途径工程的研究进展.生物工程学报,2003,19(5):636-641.
[4]NISSEN TL,KIELLAND-BRANDT MC,NIELSEN J,et al.Optimization of ethanol production inSaccharomyces cerevisiaeby metabolic engineering of the ammonium assimilation[J].Metab Eng,2000,2(1):69-77.
[5]Ethanol’s potential:looking beyond corn data[OL].http://www.earth-policy.Org/Updates/2005/Update49data.htm,2005.
[6]BJORKQVIST S,ANSELL R,ADLER L,et al.Physiological response to anaerobicity of glycerol-3-phosphate dehydrogenase mutants ofSaccharomyces cerevisiae[J].Appl Environ Microb,1997,63(1):128-132.
[7]ANDRE L,HEMMING A,ADLER L.Osmoregulation inSaccharomyces cerevisiaeStudies on the osmotic induction of glycerol production and glycerol 3-phosphate dehydrogenase(NAD+)[J].FEBS Lett,1991,286(1-2):13-17.
[8]NISSEN TL,SCHULZE U,NIELSEN J,et al.Flux distributions in anaerobic,glucose-limited continuous cultivations ofSaccharomyces cerevisiae[J].Microbiology,1997,143(1):203-218.
[9]LI HP,LI G,SUN WT,et al.Radio-frequency,atmospheric-pressure glow discharges:producing methods,characteristics and applications in bio-medical fields[J].Complex Syst,2008,982(2):584-591.
[10]LI G,LI HP,WANG LY,et al.Genetic effects of radio-frequency,atmosphericpressure glow discharges with helium[J].App Phys Lett,2008,92(22):221504.
[11]WANG LY,HUANG ZL,LI G,et al.Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma[J].J Appl Microbiol,2010,108(3):851-858.
[12]WANG LY.Studies on the mechanisms and applications of the atmospheric room temperature plasmas acting on the microbes[D].Beijing:Tsinghua University,2010.
[13]MILLER SM,MAGASANIK B.Role of the complex upstream regioll of the GDH2 gene in nitrogen regulation of the NAD-linked glutamate dehydrogenase inSaccharomyces cerevisiae[J].Mol Cell Biol,1991,11(12):6229-6247.
[14]POMPL R,JAMITZKY F,SHIMIZU T,et al.The effect of low-temperature plasma on bacteria as observed by repeated AFM imaging[J].New J Phys,2009,11(11):115023.
[15]MORFILL GE,KONG MG,ZIMMERMANN JL.Focus on plasma medicine[J].New J Phys,2009,11(11):115011.
