多种除氧技术培养丁酸梭菌的研究
2013-04-23廖美德
邓 庆,廖美德
(华南农业大学 资源环境学院,广东 广州 510642)
丁酸梭菌(Clostridium butyricum)又名酪酸菌,属芽孢杆菌科(Bacillaceae),梭菌属(Clostridium),革兰氏阳性,有芽孢,孢子卵圆,偏心或次端生。丁酸梭菌是严格厌氧的芽孢菌[1],产淀粉酶、蛋白酶、脂酶、纤维酶、半纤维酶等多种胞外酶,能合成泛酸、烟酸、叶酸、维生素B1、吡哆醇、核黄素等维生素类化合物,主要代谢产物为丁酸、乙酸[2]。自1944 年日本[3]将丁酸梭菌制剂以整肠制剂药品正式投入临床应用以来,丁酸梭菌制剂在国内外临床应用已有几十年的历史,不仅对各种原因(肠道感染、肿瘤化疗、外科手术等)所致的肠道菌群紊乱[4]、急慢性腹泻、肠易激综合症、非溃疡性消化不良等疾病有良好的疗效[5],尤其对使用抗生素后所致的伪膜性肠炎有独特的效果。
我国于1993年引入,研究时间仅20年,对于丁酸梭菌的培养方法改进和应用领域还有许多空间进行探索[6]。本研究结合丁酸梭菌在畜牧养殖业[7]中的生产实际,创新性地采用生物除氧的培养方法,将酵母菌与丁酸梭菌一起混合培养[8]。酵母菌具有很高的营养价值[9],含有丰富的蛋白质,在畜牧业中已有悠久的应用历史。因此混合培养物[10]不仅可以为饲养动物提供营养,还能预防和治疗其肠道损伤。丁酸梭菌是一种对氧敏感,严格厌氧生长的细菌,因此,长期以来,人们依赖厌氧生物反应器或在培养基中添加还原性耗氧剂如谷胱甘肽还原盐等方法培养丁酸梭菌。本实验采用了添加无机还原除氧剂硫代硫酸钠、有机还原除氧剂半胱氨酸和混合培养3种方法来培养丁酸梭菌,目的是提高丁酸梭菌的生物量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
丁酸梭状芽孢杆菌(Clostridium butyricum):华南农业大学天然农药与化学生物学教育部重点实验室提供。
酵母菌(Saccharomyces cerevisiae):华南农业大学天然农药与化学生物学教育部重点实验室提供。
1.1.2 培养基
液体硫乙醇盐培养基:酪蛋白胨15g,L-胱氨酸0.5g,葡萄糖5g,酵母膏5g,氯化钠2.5g,硫乙醇酸钠0.5g,刃天青(resazurin)0.001g,琼脂0.75g,次甲基兰0.05g,蒸馏水1000mL,pH 7.1。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[11]:蛋白胨2g,酵母膏1g,葡萄糖2g,次甲基兰0.05g,蒸馏水100mL,pH 7.0。
1.1.3 试剂
液体硫乙醇盐培养基:青岛高科园海博生物技术有限公司;蛋白胨、酵母菌:英国Oxoid公司;无水葡萄糖(分析纯)、次甲基兰(分析纯):天津市福晨化学试剂厂;L-胱氨酸(纯度≥98.0%):上海伯奥生物科技有限公司;硫代硫酸钠(分析纯):北京刘李店化工厂;琼脂粉:广州华奇盛生物科技有限公司。
1.2 仪器与设备
UVmini-1240紫外可见分光光度计:日本岛津公司;CX31显微镜:日本OLYMPUS公司;XB-K-25血球计数板:上海安信光学仪器制造有限公司;303A-2S恒温电热培养箱:上海浦东荣丰科学仪器有限公司;TCYQ恒温振荡培养箱:广州深华生物技术有限公司;DHP-9052恒温培养箱:上海一恒科学仪器有限公司;HRAYAMA高压灭菌锅:华粤行仪器有限公司。
1.3 方法
1.3.1 丁酸梭菌生长曲线测定
将配制好的含9mL液体硫乙醇盐培养基的试管随机分为实验组和对照组,按1%菌种量接丁酸梭菌于实验组试管中,在37℃恒温箱中培养,每隔8h分别测定实验组与对照组培养基OD600nm值(测定前,充分振荡),用实验组OD600nm值减去对照组OD600nm值,即得此时菌体OD600nm值,根据OD600nm值绘制丁酸梭菌生长曲线[12]。
1.3.2 丁酸梭菌OD600nm、酵母菌OD600nm与其生物量的关系曲线测定
丁酸梭菌OD600nm、酵母菌OD600nm与其生物量的关系:选取5个不同菌体浓度的丁酸梭菌菌液、酵母菌菌液,分别测定其OD600nm,并用血球计数板在显微镜下数出不同OD600nm对应的菌数,建立拟合曲线。
单一丁酸梭菌、酵母菌菌液OD600nm与混合菌液OD600nm关系:随机选取5个相同体积不同菌体浓度的丁酸梭菌和酵母菌单一悬液,分别测定OD600nm,然后将两者按不同体积混合后,测定混合液OD600nm,测定单一丁酸梭菌、酵母菌菌液OD600nm与混合菌液OD600nm关系曲线。
1.3.3 无机还原物除氧能力
分别添加质量浓度为0g/mL、0.018g/mL、0.036g/mL、0.054g/mL、0.072g/mL、0.090g/mL无机还原化合物硫代硫酸钠1mL于含8mL液体硫乙醇盐培养基的试管中,使各试管中硫代硫酸钠的质量浓度分别为0.000g/mL、0.002g/mL、0.004g/mL、0.006g/mL、0.008g/mL、0.010g/mL。培养基高温灭菌(121℃、15min)后,按1%接种量接入丁酸梭菌种子液于培养基中,37℃恒温箱培养,每隔12h观察试管中蓝色液体的高度,次甲基兰遇氧变蓝,因此溶液显示蓝色即表示含有氧气。实验中蓝色层越高表示氧气渗入量越大。
1.3.4 无机还原化合物对丁酸梭菌生物量的影响
在8mL硫乙醇盐培养基中,分别添加质量浓度分别为0g/mL、0.009g/mL、0.0018g/mL、0.0027g/mL、0.0036g/mL、0.0045g/mL、0.0054g/mL 无机还原化合物硫代硫酸钠1mL,培养基高温灭菌(121℃、15min)后,随机分为对照组与实验组,按1%接种量接入丁酸梭菌种子液于实验组培养基中(对照组加入等量无菌水),置于37℃恒温箱中培养48h,分别测定实验组与对照组OD600nm值,按照OD600nm值与其生物量关系的回归方程计算丁酸梭菌生物量[13]。
1.3.5 有机还原剂对丁酸梭菌生物量的影响
在8mL硫乙醇盐培养基中,分别添加质量浓度分别为0g/mL、0.009g/mL、0.0018g/mL、0.0027g/mL、0.0036g/mL、0.0045g/mL有机还原化合物半胱氨酸1mL,培养基高温灭菌(121℃、15min)后,随机分为对照组与实验组,按1%接种量接入丁酸梭菌种子液于实验组培养基中(对照组加入等量无菌水),置于37℃恒温箱中培养48h,分别测定实验组与对照组OD600nm值,按照OD600nm值与其生物量关系的回归方程计算丁酸梭菌生物量[13]。
1.3.6 不同接种量对单一培养丁酸梭菌、酵母菌于YPD中生物量的影响
分别按1%、2%、3%、4%、5%接菌量接种单一丁酸梭菌、酵母菌于YPD培养基中。30℃恒温培养48h后,测定菌液OD600nm值,观察丁酸梭菌在无任何除氧剂的YPD培养基中是否生长以及酵母菌的接种量是否对其生物量有影响[14]。
1.3.7 混合培养对丁酸梭菌生物量的影响
将配制好的含9mL YPD培养基的试管随机分为实验组和对照组,用移液枪按表1的体积比分别接丁酸梭菌与酵母菌于实验组培养基中(接种量为1%)后,实验组和对照组放在30℃条件下,同时分别测定接种液的OD600nm值,按照OD600nm值与其生物量关系的回归方程计算丁酸梭菌生物量。实验组和对照组培养48h后测定其OD600nm值,并用血球计数板计算得出酵母菌数,按照OD600nm值与其生物量关系的回归方程计算丁酸梭菌生物量[15]。

表1 混合培养丁酸梭菌与酵母菌的接种比例Table 1 Inoculation ratio of mixture culture ofC.butyricum andS.cerevisiae
2 结果与分析
2.1 丁酸梭菌生长曲线
丁酸梭菌在硫乙醇盐培养基上生长曲线测定结果见图1。图1数据为培养液稀释10倍后的测定值(下同)。从丁酸梭菌生长曲线中可知,在2h 以前是迟缓期,2h~10h为丁酸梭菌生长的对数期,10h后进入对数生长后期,16h后进入稳定期,40h左右生长达到顶值,之后是衰亡期。后期研究中选取丁酸梭菌生长对数期进行接种。
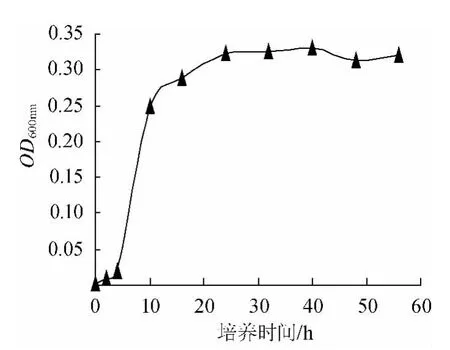
图1 丁酸梭菌生长曲线Fig.1 Growth curve ofC.butyricum
2.2 丁酸梭菌OD600nm、酵母菌OD600nm与其生物量的关系曲线测定
2.2.1 酵母菌OD600nm与生物量(细胞浓度)关系
酵母菌悬液OD600nm值与与其生物量对应关系如图2所示,经回归分析得到回归方程(1):

式中:Y 为酵母菌生物量,107个/mL,X 为酵母菌悬液OD600nm值。
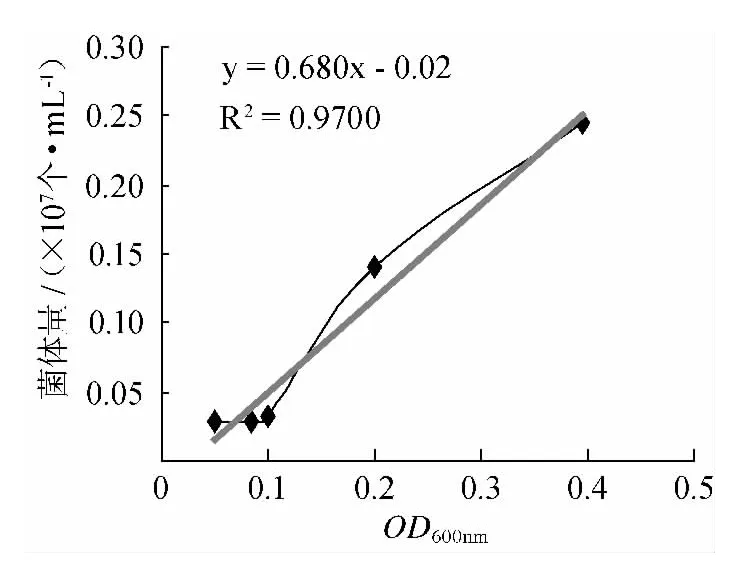
图2 酵母菌OD600nm与菌体量关系Fig.2 The relationship betweenOD600nm ofS.cerevisiae and biomass
2.2.2 丁酸梭菌OD600nm与生物量关系图
丁酸梭菌悬液OD600nm值与其生物量(细胞浓度)关系见图3,经回归分析得到回归方程(2):
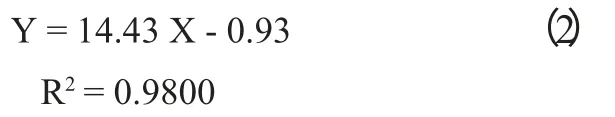
式中:Y 为丁酸梭菌的生物量,107个/mL,X 为丁酸梭菌悬液的OD600nm值。
2.2.3 单一丁酸梭菌、酵母菌菌液OD600nm与混合液OD600nm的关系
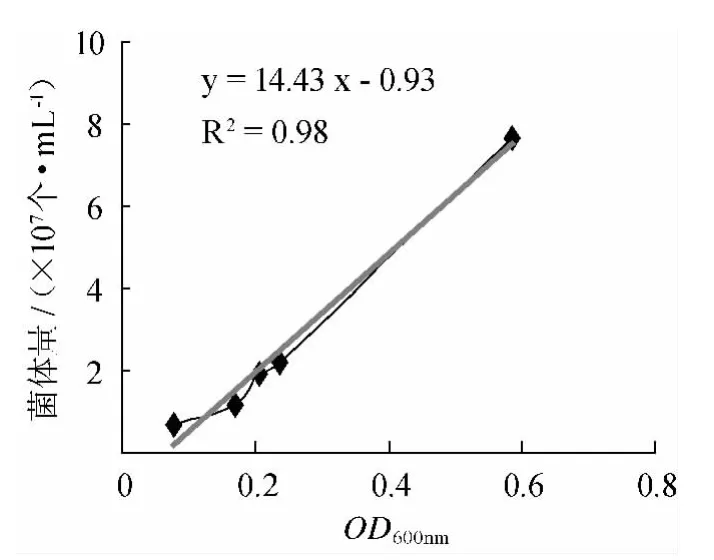
图3 丁酸梭菌OD600nm与菌体量关系Fig.3 The relationship betweenOD600nm ofC.butyricum and biomass
将等体积不同OD600nm的丁酸梭菌与酵母菌混合,测定其混合液OD600nm值,结果见图4。由图4可知,丁酸梭菌、酵母菌及混合菌液OD600nm值可以由(3)式计算。


图4 单一丁酸梭菌、酵母菌菌液OD600nm与混合液OD600nm的关系Fig.4 The relationship betweenOD600nm of singleC.butyricum,S.cerevisiae andOD600nm of broth mixture
2.3 次甲基兰指示硫代硫酸钠除氧效果分析
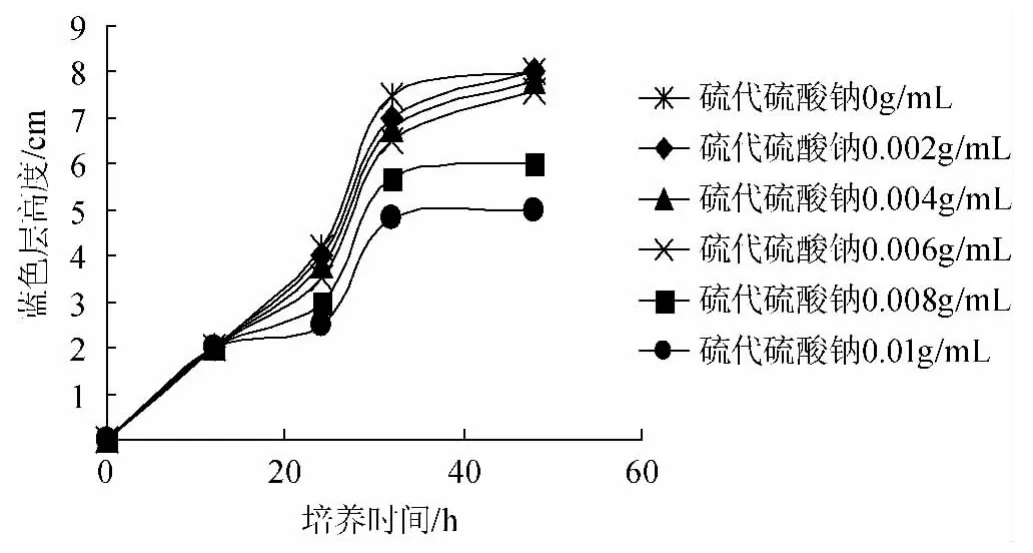
图5 次甲基蓝指示硫代硫酸钠的除氧效果Fig.5 Deoxidize effect of thiosulfate sodium indicated by methylene blue
由图5可知,培养初期,硫代硫酸钠的添加量与除氧效果成正相关,但随着培养时间的延长,氧气不断扩散进入,蓝色层高度逐渐增加。到培养末期(50h),硫代硫酸钠的添加量为0g/mL~0.006g/mL的蓝色层的高度几乎一致为8cm,表明培养末期硫代硫酸钠的添加量与除氧效果无相关性。硫代硫酸钠的添加量分别为0.008g/mL和0.010g/mL时蓝色层高度分别为5cm和6cm,表明高质量浓度硫代硫酸钠对除氧具有较好的效果。蓝色溶液高度越小,表明除氧效果越好,越有利于丁酸梭菌生长。
2.4 无机还原活性物除氧剂对丁酸梭菌生长的影响
以无机还原活性物硫代硫酸钠作除氧剂对丁酸梭菌生长的影响测定结果见图6。结果表明,当硫代硫酸钠的添加量为0g/mL~0.004g/mL,丁酸梭菌的生物量与添加量成正相关。当硫代硫酸钠的添加量为0.004g/mL时丁酸梭菌的OD600nm值最大。当添加量大于0.004g/mL时,丁酸梭菌的生物量与添加量成负相关,因此硫代硫酸钠除氧的最佳添加量是0.004g/mL。
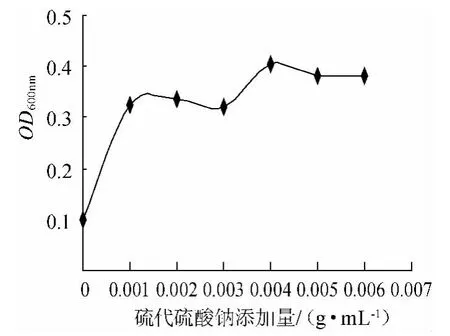
图6 硫代硫酸钠添加量与菌体量关系Fig.6 The relationship between dosage of sodium thiosulfate and biomass
2.5 有机还原活性物除氧剂半胱氨酸对丁酸梭菌生长的影响
有机还原活性物半胱氨酸(还原型)除氧剂对丁酸梭菌生长的影响测定结果见图7。从图7可知,当半胱氨酸的添加量为0g/mL~0.004g/mL,丁酸梭菌的生物量与添加量成正相关。当半胱氨酸的添加量是0.004g/mL时丁酸梭菌的OD600nm值最大。当添加量大于0.004g/mL,丁酸梭菌的生物量与添加量成负相关,因此半胱氨酸除氧的最佳添加量是0.004g/mL。

图7 半胱氨酸添加量与菌体量关系Fig.7 The relationship cysteine added volume and biomass
2.6 不同接种量对单一培养丁酸梭菌、酵母菌于YPD中生物量的影响
分别按1%、2%、3%、4%、5%的接菌量接种单一丁酸梭菌、酵母菌于YPD培养基中,然后放置于30℃恒温培养箱中培养48h,测定其OD600nm。酵母菌接种量与酵母菌生物量关系曲线见图8。由图8可知,酵母菌能在YPD中较好的生长,但其接菌量对酵母菌生物量几乎无影响。丁酸梭菌单一培养于YPD中,接种量与丁酸梭菌生物量关系曲线见图9。由图9可知,丁酸梭菌单一培养于YPD中是不生长的。

图8 在YPD培养基中不同接菌量与酵母菌生物量关系Fig.8 The relationship between different inoculum ofS.cerevisiae and its biomass in YPD medium
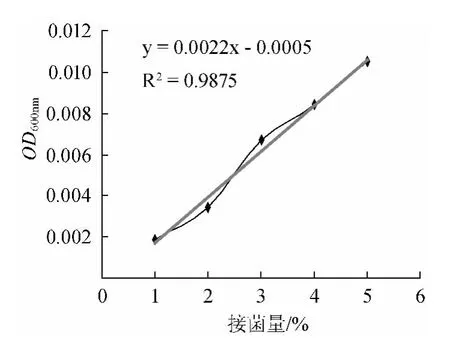
图9 在YPD培养基中不同丁酸梭菌接菌量与其生物量关系Fig.9 The relationship between different inoculum ofC.butyricum and its biomass in YPD medium
2.7 不同接菌量对混合培养中酵母菌与丁酸梭菌生物量的影响

图10 不同接菌量对混合培养中酵母菌与丁酸梭菌生物量的影响Fig.10 Effect of different inoculum of mixed culture on biomass ofS.cerevisiae andC.butyricum
不同比例接种量对酵母菌、丁酸梭菌生物量的影响见图10。由图10可知,酵母菌与丁酸梭菌共培养体系可以保证良好的厌氧环境,但二种菌种的初始接种比例对酵母菌和丁酸梭菌的生长有很大影响,当丁酸梭菌与酵母菌接种菌体量比是0.517(体积比)时,丁酸梭菌生物量达最大值5.238×107个/mL,此时酵母菌生物量为1.68×106个/mL。当接种菌体量比是1.206(体积比)时,酵母菌生物量达最大值2×106个/mL,此时丁酸梭菌生物量为4.953×107个/mL。但过高的酵母菌添加量会抑制丁酸梭菌的生长,其原因有待于进一步研究。
3 结论
实验结果表明,随着除氧剂添加质量浓度的升高,除氧效率有所提高,当硫代硫酸钠和半胱氨酸质量浓度为0.004g/mL时,丁酸梭菌生物生长量分别达到最大值3.49×108个/mL和4.24×108个/mL,当除氧剂添加量超过0.004g/mL时,丁酸梭菌的生长受到抑制;但除氧剂不能持续的除氧,至培养末期,除氧剂的除氧效果几乎没有除氧能力。以YPD为培养基,不同接种比例混菌实验结果表明,丁酸梭菌与酵母菌之间存在一定的协同关系,当丁酸梭菌与酵母菌接种菌体量比是0.517时,丁酸梭菌生物量达最大值5.238×107个/mL,酵母菌生物量为1.68×106个/mL。
[1]赵 熙,冉 陆,杨宝兰,等.丁酸梭菌活菌制剂对肠道菌群影响研究[J].中国微生物学杂志,1999,12(6):332-333.
[2]匡 群,孙 梅,施大林.酪酸梭状芽孢杆菌培养条件的研究[J].饲料工业,2005,26(10):36-39.
[3]赵建新,张 灏,田丰伟.丁酸菌的分离、鉴定及筛选[J].无锡轻工大学学报,2002(11):597-601.
[4]宋增福,吴天星,潘晓东.丁酸梭菌对肠道上皮细胞黏附及对鳗弧菌抑制研究[J].中国兽药杂志,2006,40(8):9-12.
[5]孔 青,陈 琳,周 雯,等.丁酸梭菌淀粉培养基的优化研究[J].食品工业科技,2009,30(12):197-199.
[6]施曼玲,戴 赟,章 玲.丁酸梭菌培养条件的研究[J].杭州师范学院学报:自然科学版,2001,18(4):38-40.
[7]刘婷婷,张 帅,邓婕月,等.谷氨酰胺与丁酸梭菌对断奶仔猪生长性能、免疫功能、小肠形态和肠道菌群的影响[J].动物营养学报,2001,23(6):998-1005.
[8]刘凌云,左和宁,杨伟峰.联用乳酸杆菌和丁酸梭菌治疗小鼠溃疡性结肠炎的实验研究[J].实用预防医学,2009(8):1255-1258.
[9]魏秀燕,崔志峰.酿酒酵母的乙醇耐受性分子机理与全转录工程[J].中国酿造,2012,31(2):19-23.
[10]王松丽,凌华云.一种丁酸梭菌与鼠李糖乳杆菌的混合培养方法[J].武汉大学学报,2009,55(5):587-590.
[11]杨 婕,泰 丹.一株优良刺葡萄酒酵母菌生长条件的研究[J].酿酒科技,2010(10):29-31.
[12]谢淑贵,戴 青,赵树森.酒窖底泥中丁酸梭菌的分离及其特性研究[J].微生物学通报,2007,34(6):1047-1051.
[13]曾 爽,靳晓亮,黄振家,等.马克斯克鲁维酵母菌生长条件的优化及其代谢分泌物分析[J].现代农业科技,2009(17):366-368.
[14]周 静,肖嫩群.酵母菌与乳酸菌混合培养条件的研究[J].安徽农业科技,2011,39(15):8824-8825.
[15]贺月林,郭照辉,谭周进,等.酵母菌与乳酸菌混合培养基中试研究[J].现代农业科技,2010(2):29-31.
