源于自然发酵腐乳中5’-AMP脱氨酶高产菌株的筛选
2013-04-23梅光明郭远明饶胜其张小军李佩佩严忠雍
梅光明,郭远明,饶胜其,张小军,李佩佩,严忠雍,龙 举
(1.浙江省海洋水产研究所 浙江省海水增养殖重点实验室,浙江 舟山 316100;2.扬州大学 食品科学与工程学院,江苏 扬州 225009)
自然发酵腐乳也叫腐乳、酱豆腐,为中国著名的传统食品,由新鲜豆腐经过发酵、腌制而成,有“东方奶酪”之称[1-2]。腐乳的制作过程中有霉菌、乳酸菌和酵母菌等多种微生物共同参与发酵作用[3-5]。5’-AMP脱氨酶又称腺苷酸脱氨酶、5’-AMP氨基水解酶,是构成嘌呤核苷酸代谢循环的3种主要酶类之一。在核酸酶水解核酸制备5’-核苷酸的工业化生产过程中,约占总量25%的腺苷酸通常没有多大用途,而5’-AMP脱氨酶可专一性地将腺苷酸转变为肌苷酸,后者可用来生产药品及强力味精,此外脱氨酶还用于生产细胞的H+缓冲剂[6]。当今核酸酶的研究炙手可热且成果产出速度飞速提高,势必导致市场对5’-AMP脱氨酶的需求大大增加,因此大规模化地生产5’-AMP脱氨酶具有广泛的生产应用前景和巨大的经济效益。现在工业生产中使用的生物酶大多由酵母、青霉、曲霉及毛霉等微生物发酵制备,但有关生产工艺的报道却比较少。本实验利用自然发酵腐乳中富集的丰富微生物资源,参考相关文献资料报道的微生物筛选目标菌株的方法[7-21],采用3种固体培养基(PDA、YPD、MRS)对腐乳中的野生菌株进行筛选和平板分离划线培养,使具有不同菌落特征的菌种分离纯化后,测得各菌株5’-AMP脱氨酶的产量与活性表达,筛选出5’-AMP脱氨酶的高产菌株,并对其进行菌种鉴定及一系列的发酵条件优化研究。通过本实验得到一株具有自主知识产权的高产5’-AMP脱氨酶菌株,为进一步研究5’-AMP脱氨酶的性质做准备,并推动其工业化生产步伐奠定一定的基础。
1 材料与方法
1.1 菌株来源
从自然发酵腐乳中分离。
1.2 培养基制备
PDA固体培养基:马铃薯200g,葡萄糖20.0g,琼脂20.0g,蒸馏水1000mL,121℃灭菌20min。。
MRS固体培养基:牛肉膏10.0g,蛋白胨10.0g,酵母浸膏5.0g,K2HPO42.0g,柠檬酸氢二铵2.0g,乙酸钠5.0g,吐温-801.0mL,MgSO4·7H2O0.50g,MnSO40.25g,葡萄糖20.0g,琼脂20.0g,蒸馏水1000mL,121℃灭菌20min,调节pH值至6.2~6.4。
YPD固体培养基:蛋白胨20.0g,酵母浸膏10.0g,葡萄糖20.0g,琼脂20.0g,蒸馏水1000mL,121℃灭菌20min,调节pH值至5.0~5.5。
摇瓶发酵培养基:木糖2.1%,柠檬酸三钠0.28%,蛋白胨1.4%,硫酸镁0.035%,吐温0.084%。121℃灭菌20min。
1.3 试剂
酵母浸膏、牛肉浸膏、蛋白胨、腺苷酸和琼脂均为生化试剂,其余试剂为分析纯。
0.1 mol/L琥珀酸-氢氧化钠缓冲液:称取琥珀酸11.809g,加蒸馏水约950mL溶解,用1mol/L NaOH溶液调节pH值至6.0,定容至1000mL。
0.08 mol/L NaHCO3:称取NaHCO36.72g,用蒸馏水溶解,定容至1000mL。
10%高氯酸溶液:称取10.0mL高氯酸,加适量水稀释,定容至100mL。
5’-AMP反应底物:准确称取139mg腺苷酸,用0.08mol/L NaHCO3溶液定容至10mL,作为原始底物,然后用0.1mol/L琥珀酸-氢氧化钠缓冲液将其稀释400倍,得到最终浓度为0.1×10-3mol/L 的反应底物。
1.4 仪器与设备
TG16-WS型台式高速离心机:湘仪离心机仪器有限公司;DK-S12型电热恒温水浴器:上海森信试验仪器有限公司;SX-500型高压蒸汽灭菌锅:日本TOMMY公司;DGX-9053B-2型生化培养箱:上海福玛试验设备有限公司;BS210S型电子天平:北京赛多利斯天平有限公司;ZHJH-C1209B型垂直流超净工作台:上海智诚分析仪器制造有限公司;755S紫外-可见分光光度计:上海棱光技术有限公司。
1.5 方法
1.5.1 自然发酵腐乳半成品的制备
称取500g市售新鲜豆腐,表面用经灭菌处理的自来水淋洗干净后切成大小适中的小块,放置于干净塑料盒内(塑料盒底部预先放好一层干净报纸并铺上食品保鲜膜),在豆腐表面再铺上一层保鲜膜后再放上一层报纸。盖好塑料盒盖子后在16℃、湿度85%左右的条件下放置培养5d[22]。
1.5.2 自然发酵腐乳半成品中产5’-AMP脱氨酶菌株的筛选
取样:从腐乳半成品上选取菌落特征差别较大的多个点,分别取样品2g左右于50mL锥形瓶中,加入无菌生理盐水10mL,室温条件下120r/min摇床提取30min,以此为菌悬液原液。将菌悬液原液按浓度梯度依次稀释至10-1~10-7。分别取稀释度为10-5~10-7的3种样液350μL,用涂布棒均匀涂布于PDA、MRS、YPD培养基。涂布完成后,置于20℃恒温箱内培养2h~3h,待水分蒸发干后,将培养皿倒置继续培养48h。
分离纯化:选择涂布浓度适宜的平板,挑取形态完整、单独生长的菌落分别划线。用接种环以无菌操作沾取少许待分离的菌,在与涂布平板对应培养基的无菌平板表面进行平行划线,微生物细胞数量将随着划线次数的增加而减少,并逐步分散开来。划线完成后置于20℃恒温箱内培养2d~3d。重复划线培养操作2次,使菌株尽量纯化。
摇瓶发酵培养:本试验使用250mL锥形瓶,每瓶装入约50mL摇瓶发酵培养基,从划线平板接种后,20℃、200r/min摇瓶发酵培养24h后转接5%至新的摇瓶中,继续摇瓶发酵3d,培养完成,取样测量5’-AMP脱氨酶的活性。
菌种保藏及酶液制备:分别取摇瓶发酵培养后的菌悬液1mL于1.5mL离心管中,10000r/min离心5min,下层沉淀加500μL 30%甘油,振荡均匀后于-20℃冰箱中保藏,即为种子。甘油保藏适用于中期或长期保藏菌种。而上层清液即是酶液,可用于测定5’-AMP脱氨酶的活性。
5’-AMP脱氨酶活性的测定:将酶液样品稀释8倍备用,按照文献[23]的方法测定5’-AMP脱氨酶的活性,每个样品做3组平行实验,平行实验数据分别计算得到酶活后取平均值。
1.5.3 菌种鉴定
在倒好培养基平皿中,用接种针从斜面挑取少许孢子在培养皿中按三角顶点位置三点式接种。PDA培养基平皿在20℃培养3d~5d。形成菌落后进行特征观察并记录。对5’-AMP脱氨酶高产菌株进行分类鉴定
1.5.4 发酵条件对5’-AMP脱氨酶高产菌株产酶的影响
培养基初始pH值对产酶的影响:挑取单独生长的纯种菌落于装有50mL不同pH值的液体培养基的250mL锥形瓶中,锥形瓶用8层纱布封口。20℃、200r/min摇床培养24h。发酵培养24h后,转接5%(v/v,下同)至新的装有约50mL液体培养基的250mL锥形瓶中继续培养72h。培养后的酶液用于测定5’-AMP脱氨酶的活性。
摇瓶发酵培养温度对产酶的影响:操作同1.5.4,比较不同温度条件下摇床培养的酶液酶活大小。
接种量对产酶的影响:操作同1.5.4,比较不同接种量至装有约50mL液体培养基的250mL锥形瓶中继续培养72h后的酶液酶活大小。
摇瓶发酵时间对产酶的影响:操作同1.5.4,比较转接5%至装有约50mL液体培养基的250mL锥形瓶中继续培养的时间长短对培养后的酶液酶活大小。
2 结果与分析
2.1 豆腐乳半成品制备及取样点设置

图1 市售新鲜豆腐(a)及放置5d后自然发酵腐乳半成品(b)Fig.1 Fresh tofu (a) and semi-finished tofu products after 5d natural fermentation (b)
市售新鲜豆腐见图1a,放置5d后自然发酵腐乳半成品见图1b。由图1b可知,此时腐乳上的微生物已经生长十分旺盛。选取具有明显菌落特征的取样点,共计7个,分别记为A、B、C、D、E、F、G。

图2 特征性涂布平板Fig.2 Characteristic coated tablet
图2a为在YPD培养基上涂布分离豆腐乳中野生菌株的典型情况;图2b为在MRS培养基上涂布分离豆腐乳中野生菌株的典型情况;图2c为在PDA培养基上涂布分离豆腐乳中野生菌株的典型情况。
涂布完成后,挑取涂布平板上生长单一的特征菌落,依据纯化情况,划线2次或3次。共得到单一菌株36株,从PDA平板上得到20株,YPD平板上得到9株,MRS平板上得到7株。根据培养基种类不同,依次编号为DFP-101~120(PDA培养基),同样有DFY-101~109(YPD培养基),DFM-101~107(MRS培养基)。
2.2 腐乳分离菌株的酶活测量结果
从自然发酵腐乳中筛选得到单一菌株共36株,在接种量5%,20℃、200r/min摇瓶发酵培养条件下发酵72h,分别测得5’-AMP脱氨酶活性,结果见表1。

表1 具有产酶能力的菌株酶活测量结果Table 1 Enzyme activity measurements of strains with ability of enzyme production
实验结果表明,具有5’-AMP脱氨酶活性的共计18株,且这些具有5’-AMP脱氨酶产酶能力的菌株多数在PDA培养基上筛选得到,说明产5’-AMP脱氨酶的菌株较多为霉菌。编号为DFP-102的菌株为5’-AMP脱氨酶的最高产菌株,在上述发酵条件下,5’-AMP脱氨酶的活力达到359.1U/mL。故选取此菌株进行下一步的发酵优化及菌种鉴定试验。
2.3 菌种初步鉴定结果
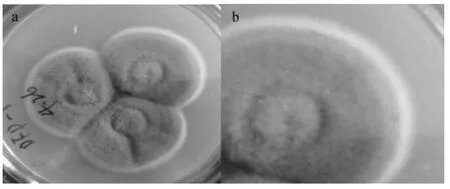
图3 DFP-102菌落形态Fig.3 Colony morphology of DFP-102
图3a为DFP-102的PDA培养基三点式培养菌落图,图3b为图3a右上角菌落的放大图。观察DFP-102的菌落形态:灰色絮状,菌落中间有小圆,边缘呈白色,有同心圆,反面浅黄色。根据相关文献资料[24-25]初步鉴定DFP-102分离菌株是毛霉菌属。
2.4 发酵条件对DFP-102菌株产酶的影响
2.4.1 发酵液初始pH值对产酶的影响
按照1.5.4的方法实验操作,结果(图4)可知,在pH值为4.0~6.0时,酶活随pH值的增加而增加,在pH值为6.0时,酶活达到最大值,此时5’-AMP脱氨酶活是359.1U/mL,当pH值高于6.0以后,酶活随pH值的增加而下降。因此培养液的初始pH值确定为6.0。
2.4.2 摇瓶发酵培养温度对产酶的影响
按照1.5.4的方法实验操作,结果(图5)可知,在18℃~24℃时,随着温度的上升,5’-AMP脱氨酶活性逐渐上升,在24℃时,酶活达到最高,此时5’-AMP脱氨酶活是390.6U/mL。随温度继续上升,5’-AMP脱氨酶活性逐渐下降。因此摇床发酵培养温度应控制为24℃左右。

图4 发酵液初始pH值对酶活的影响Fig.4 Effect of initial pH value of the fermented liquid on enzyme activity
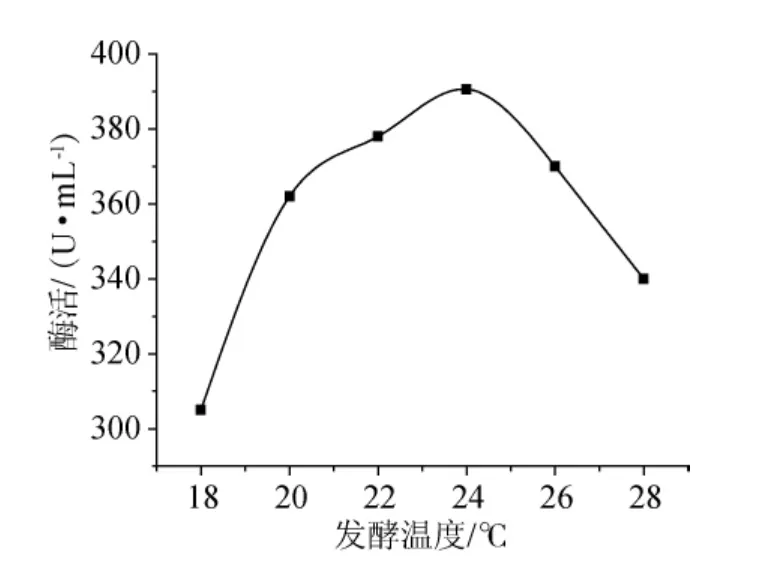
图5 发酵温度对酶活的影响Fig.5 Effect of fermentation temperature on enzyme activity
2.4.3 接种量对产酶的影响

图6 接种量对酶活的影响Fig.6 Effect of inoculum on enzyme activity
按照1.5.4的方法实验操作,结果(图6)可知,接种量大于5%后,随着接种量的增加,酶活开始降低,因此接种量应选为5%,此时5’-AMP脱氨酶活性是390.6U/mL。
2.4.4 摇瓶发酵时间对产酶的影响
按照1.5.4的实验方法操作,结果(图7)可知,在12h~48h内,随着时间的延长,酶的活性逐渐提高,发酵48h时酶活最高,此时5’-AMP脱氨酶活是472.3U/mL,继续延长发酵时间,酶活逐渐降低,因此发酵培养时间确定为48h。
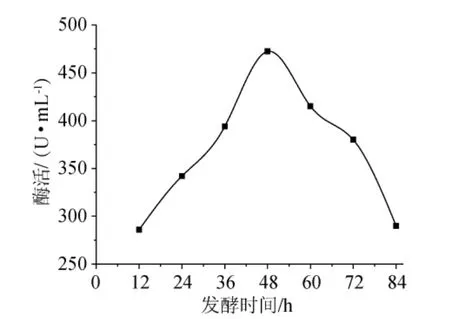
图7 发酵时间对酶活的影响Fig.7 Effect of fermentation time on enzyme activity
3 结论
本研究从自制的自然发酵腐乳中进行菌株的分离与纯化,筛选出单一菌株36株,其中检测到具有5’-AMP脱氨酶活性的有18株。酶活最高的菌株为DFP-102(初步鉴定为毛霉菌属,酶活为359.1U/mL)。经过摇床发酵培养条件的优化,DFP-102菌株产5’-AMP脱氨酶的最适宜发酵条件为培养基pH值为6.0,发酵温度24℃,发酵时间48h,5%接种量。在该最佳发酵条件培养菌株后,5’-AMP脱氨酶活性可达472.3U/mL。本研究筛选得到的高产5’-AMP脱氨酶活性菌株来源于传统发酵食品,具有较低的食品安全风险,且采用液体发酵培养法,生产周期较短,有利于5’-AMP脱氨酶大规模化生产并降低生产成本。后续将开展进一步的研究工作,包括DFP-102菌株的生化鉴定,尝试对DFP-102进行菌株诱变得到更高的5’-AMP脱氨酶高产菌株,对于5’-AMP脱氨酶的性质研究,如稳定性,耐热性等也有待进一步展开。本研究为5’-AMP脱氨酶的性质研究以及工业化生产打下了一定的基础。
[1]张雪梅,蒲 彪.腐乳的研究概况与发展前景[J].食品与发酵工业,2005,31(5):94-97.
[2]汪立君,李里特,齐藤昌义,等.大豆发酵食品风味物质的研究[J].食品科学,2005(增刊):66-69.
[3]程永强,王晓辉,呼 晴.低温发酵腐乳生产菌的微生物鉴定[J].食品科技,2009,34(5):2-5.
[4]鲁 绯.腐乳发酵机理、品质改进和模式识别研究[D].北京:中国农业大学博士论文,2005.
[5]梁恒宇,程建军,马 莺.中国传统大豆发酵食品中微生物的分布[J].食品科学,2004,25(11):401-404.
[6]叶 炜,田吕明,姚 鹃,等.AMP 脱氨酶的生物性质研究[J].食品工业科技,2012,33(1):164-166.
[7]YOSHIMUNE K,KUGIMIYA K,MORIGUCHI M.Purification and characterization of a flavour-enhancing enzyme,thermostable adenosine-phosphate deaminase,from thermophilicAspergillus fumigatusNo.4[J].Ann Microbiol,2005,55(4):267-272.
[8]段作营,刘军昌,毛忠贵.米曲霉腺苷酸脱氨酶的产酶条件[J].无锡轻工大学学报,2002,21(5):472-476.
[9]魏艳红.纤维素酶产生菌的分离鉴定及产酶条件优化[D].武汉:华中师范大学硕士论文,2009.
[10]许 婧,欧阳嘉,何冰芳,等.组成型纤维素酶高产菌的筛选及产酶条件优化[J].食品与生物技术学报,2008,27(4):85-90.
[11]李琢伟,文连奎,胡耀辉,等.腐乳生产用毛霉高产端肽酶菌株诱变条件及发酵特性的研究[J].食品科学,2008,29(11):433-438.
[12]李剑峰,刘必谦,洪松柏,等.高产壳聚糖酶菌株的筛选及其产酶条件的优化[J].水生态学杂志,2010,3(3):127-131.
[13]RAHARDJOYS,SIE S,WEBER F J,et al.Effect of low oxygen concentrations on growth and alpha-amylase production model solid-state fermentation systems[J].Biomol Eng,2005,21(6):163-172.
[14]谢子文,王红宁,邹立扣.植酸酶毕赤酵母工程菌发酵条件优化研究[J].中国食品学报,2008,8(4):69-74.
[15]KIM DY,CHA CH,OH WS,et al.Expression of the promoter for the maltogenic amylase gene inBacillus subtilis168[J].J Microbiol,2004,42(4):319-327.
[16]HANNAN A,BAJWA R,LATIF Z.Screening ofAspergillus nigerstrains for pectinases production potential[J].J Biotechnol,2008,136:304-311.
[17]ZHANG XS,XU DJ,ZHU CY,et al.Isolation and identification of biosurfactant producing and crude oil degradingPseudomonas aeruginosastrains[J].Chem Eng J,2012,209:138-146.
[18]MISSOTTEN JAM,GORIS J,MICHIELS J,et al.Screening of isolated lactic acid bacteria as potential beneficial strains for fermented liquid pig feed production[J].Anim Feed Sci Tech,2009,150(1-2):122-138.
[19]刘军昌,段作营,沈梅生,等.固态发酵生产腺苷酸脱氨酶[J].工业微生物,2002,32(1):36-39.
[20]张徐兰,郑 岩,吴天祥,等.腐乳中γ-氨基丁酸红曲菌株的筛选及其生物学特性研究[J].中国酿造,2008,27(13):34-36.
[21]伍 玲,秦礼康.发酵豆制品中高产转氨酶菌株筛选及固态菌剂制备[J].食品科学,2012,33(3):105-109.
[22]向 喜.家庭风味腐乳的加工[J].农村实用技术与信息,2003(6):54.
[23]刘军昌,段作营,毛忠贵.AMP 脱氨酶活性测定的一种改进方法[J].食品与发酵工业,2001,20(7):30-33.
[24]布坎南,中国科学院微生物研究所译.伯杰氏细菌鉴定手册[M].北京:科学出版社,1984.
[25]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
