模拟缺血再灌注对乳兔窦房结细胞起搏电流的影响
2013-04-23刘如秀汪艳丽刘金凤
刘如秀, 刘 宇, 汪艳丽, 李 泱, 彭 杰, 刘金凤
模拟缺血再灌注对乳兔窦房结细胞起搏电流的影响
刘如秀1*, 刘 宇1, 汪艳丽1, 李 泱2, 彭 杰1, 刘金凤1
(1中国中医科学院广安门医院心内科, 北京 100053;2解放军总医院老年心血管病研究所, 北京 100853)
观察模拟缺血再灌注(I/R)对乳兔窦房结细胞形态及起搏电流(f)的影响,阐明I/R制备窦房结细胞损伤的电生理特征改变。选用新生新西兰乳兔,采用双酶解法/差速贴壁法分离窦房结细胞,模拟I/R制备受损模型,利用膜片钳技术记录动作电位和f。乳兔窦房结细胞主要呈梭形,搏动频率快,细胞表面光滑完整。模拟I/R后大部分细胞肿胀变形,伪足回缩,胞膜有较多颗粒、欠光滑。模拟再灌注后窦房结细胞f最大舒张电位由(-50.9±5.3)mV变为(-43.5±4.6)mV,电流密度由(-3.2±0.41)pA/pF变为(-2.47±0.32)pA/pF,其稳态激活曲线较对照组明显右移,半数激活电压由(-98.6±2.3)mV变为(-107.8±4.7)mV(<0.05)。模拟I/R导致窦房结细胞损伤,细胞电生理发生改变,尤以f重构为主。
窦房结; 再灌注损伤; 膜片钳术; 起搏电流
病态窦房结综合征(病窦综合征,sick sinus syndrome,SSS)是临床常见危重疾病,发病率、猝死率较高,有关其发病机制及防治措施的研究一直是心血管病研究领域的重要内容之一[1]。缺血再灌注(ischemia/reperfusion,I/R)后导致心律失常已有较多研究,但其诱发SSS的机制尚不明确[2]。超极化激活电流(funny current,f),又称起搏电流,其作为心电活动的起始电流,不仅是心脏起搏的主要离子流,在SSS中发挥着关键性作用,而且与再灌注所致的心律失常关系密切[3,4]。本研究采用膜片钳技术比较I/R前后乳兔窦房结细胞(sinoatrial node cells,SNCs)起搏电流的差异,研究I/R对SNCs电生理的影响,初步探讨I/R引起SSS的细胞电生理学机制。
1 材料与方法
1.1 实验动物与主要试剂
出生24h内新西兰大耳白兔,雌雄不拘,由广安门医院动物实验中心提供。DMEM(美国Invitrogen公司),胎牛血清、胰酶(Gibco公司),Ⅱ胶原酶型、Triton-100和EDTA-Na2(Sigma公司)。模拟缺血溶液(mmol/L):NaCl 98.5、KCl 10.0、NaH2PO40.9、NaHCO36.0、CaCl21.8、MgSO41.2、乳酸钠40.0、HEPES 20.0,用1%的稀盐酸调pH至6.8;模拟再灌注溶液(mmol/L):NaCl 129.5、KCl 5.0、NaH2PO40.9、NaHCO320.0、CaCl21.8、MgSO41.2、葡萄糖55.0、HEPES 20.0,用1mmol/L的NaOH调pH至7.4。起搏离子流灌流液(mmol/L):NaCl 137.0、KCl 5.4、CaCl21.8、MgCl20.5、NaHCO323.8、NaH2PO40.4、葡萄糖10.0,以KOH调pH至7.4。起搏离子流电极内液(mmol/L):NaCl 6.0、MgCl21.0、HEPES 5.0、KCl 140.0,以KOH调pH至7.2。
1.2 实验方法
1.2.1 乳兔SNCs的分离、纯化、培养 选择出生24h内的新西兰乳兔75只,每次5只共重复15次,于75%的乙醇中浸泡5~10s,后仰卧位固定置于超净台中,眼科直剪剪开胸前壁,暴露心脏,在解剖显微镜下于界嵴中部静脉窦侧、前腔静脉根部取2mm×2mm×2mm的组织块于DMEM中,吹打后用眼科弯镊将组织块夹入PBS液中冲洗,后置于PBS液中用眼科弯剪剪成0.3mm×0.3mm×0.3mm的小块,吸弃上清。然后加入0.08%的胰酶8ml于37℃水浴中振荡5min,吹打沉淀后吸弃上清液。再次加入0.025%Ⅱ型胶原酶8ml于37℃水浴中振荡10min,再吹打1min,沉淀后吸取上清液于50ml离心管中,离心管中含20ml 15%FBS的DMEM;第三次消化步骤、时间均同前,第四次消化步骤同前,时间改为8min。用400目金属滤网过滤后平均移入离心管中,940r/min离心7min。离心后倒掉上清,加入培养液,调整细胞数为1×105/L,将单细胞悬液接种于6个小的培养皿中,锥虫蓝(台盼蓝)检测活细胞率达95%以上。将培养皿置于37℃、5% CO2培养箱中孵育90min,差速贴壁以除去成纤维细胞,后加入5-溴脱氧尿嘧啶核苷(5-BrdU)使其终浓度为0.1mmol/L并继续培养。24h后细胞换液,此后隔天换液,每次换液均加入0.1mmol/L 5-BrdU。
1.2.2 模拟I/R模型的建立 参考Xiang等[5]的制备方法,以缺氧缺糖模拟缺血,以恢复氧和糖供应模拟再灌注。模拟缺血:将培养皿内培养液吸弃,加入2ml预先用95%N2+5%CO2饱和的模拟缺血溶液,反复冲洗3次,加2ml的缺血液后置于自制密闭盒中持续通以30倍体积约10L的95%N2+5%CO2混合气,充分排尽密闭盒中残余的氧气后,用止血钳钳闭进出管道,以缺氧缺糖模拟缺血放入5%CO2培养箱中培养1h。模拟再灌注:从培养箱内取出自制密闭盒,将培养皿中的缺血液吸弃,加入2ml含10%胎牛血清的模拟再灌注液,反复冲洗3次,再向培养皿内加入2ml模拟再灌注液以恢复氧和糖的供应,放回5%CO2培养箱中继续培养3h。模拟再灌注结束后,即取SNCs行膜片钳实验。
将培养的SNCs分为两组:正常组,细胞于37℃孵育,以模拟再灌注溶液替换培养液,并向其中持续通以95%O2+5%CO2混合气;模拟I/R组,处理方法同上。两组均预先用含15%空白血清的DMEM培养基培养30min。
1.2.3 培养SNCs的形态学鉴定 在倒置显微镜下观察培养SNCs的形态、大小、搏动频率。
1.2.4 SNCs起搏离子流的记录 将各组细胞玻片移入恒温灌流槽内,通入低流量95%O2+5%CO2混合气的灌流液持续灌流,操纵电极与细胞形成巨阻抗封接(>1.0GΩ),负压抽吸配合脉冲电压打破封接的膜片,在电流钳模式下记录到SNCs的最大舒张期电位后,再换为电压钳模式记录f。脉冲发放由计算机通过PClamp软件包(Axon)控制,数字信号经Digidata 1200数模转换器转成电信号,由Axon-200B放大器放大,经电极丝和微电极导入细胞,产生的电信号由模数转换器变成数字信号,经PClamp程序采集并储存于电脑硬盘中。微电极尖端阻抗为4~6MΩ,滤波频率2kHz。实验温度控制在35℃,灌流速度为2ml/min。
1.3 统计学处理
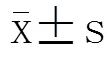
2 结 果
2.1 SNCs的形态学
倒置显微镜观察,SNCs呈梭形,胞核中等大小,呈椭圆形,位于胞体中间,细胞表面光滑完整,状态较好。模拟I/R后大部分细胞都已经凋亡,存活的SNCs虽仍然贴壁,但已出现肿胀变形,伪足回缩,甚至细胞脱落,细胞表面有较多颗粒,表面不够光滑(图1)。

图1 倒置显微镜下观察细胞形态
Figure 1 Morphology of the cells under inverted microscope(×200) A: normal sinoatrial node cells; B: ischemia/reperfusion sinoatrial node cells
2.2 乳兔SNCs的动作电位时程
用电流钳技术通过全细胞记录模式,检测搏动频率较快的SNCs的动作电位,其动作电位有舒张期自动除极化(图2)。先后记录了15个梭形细胞的动作电位,其最大舒张电位为(-50.9±5.3)mV,I/R组为(-43.5±4.6)mV,动作电位幅度为(81.9±4.8)mV,I/R组为(78.8±5.8)mV。

图2 SNCs的动作电位
Figure 2 Action potential of SNCs SNCs: sinoatrial node cells; I/R: ischemia/reperfusion
2.3 起搏离子流的记录
将膜电位钳制在-50mV,超极化至-180mV,钳制时间为2 000ms,各指令电压末端除极化至0mV。在超极化钳制时可见逐渐激活和增大的内向离子流,除极化时记录到大小不等的尾电流,当向灌流液中加入2mmol/L的铯离子(Cs+)时,内向离子流及其尾电流在各测试电位基本消失,表明该内向电流即为f(图3)。
2.4 模拟缺血预适应对SNCs If及电压曲线(I-V)的影响
将膜电位钳制在-40mV,以-10mV步阶超极化至-140mV,钳制时间为2 000ms,各指令电压末端除极化至0mV。在-120mV时,乳兔SNCsf的电流密度为(-3.2±0.41)pA/pF,I/R后电流密度变为(-2.47±0.32)pA/pF(<0.01;图4)。f的幅值具有电压依赖性特征,随着电位向超极化方向移动,正常SNCs电流迅速增加,I/R后电流虽然也有增加,但增加的幅度较正常SNCs显著减小,二者具有显著差异(<0.05;图5)。
2.5 模拟缺血预适应对SNCs If激活曲线的影响
经过3h的模拟再灌注,正常SNCs的半激活电压(Vl/2)由(-98.6±2.3)mV变为(-107.8±4.7)mV(<0.05),提示V1/2移向更负,将不利于通道的激活,而激活曲线斜率虽有差异,但无统计学意义(>0.05;图6)。

图3 SNCs的起搏电流
Figure 3 Funny current ofSNCs SNCs: sinoatrial node cells
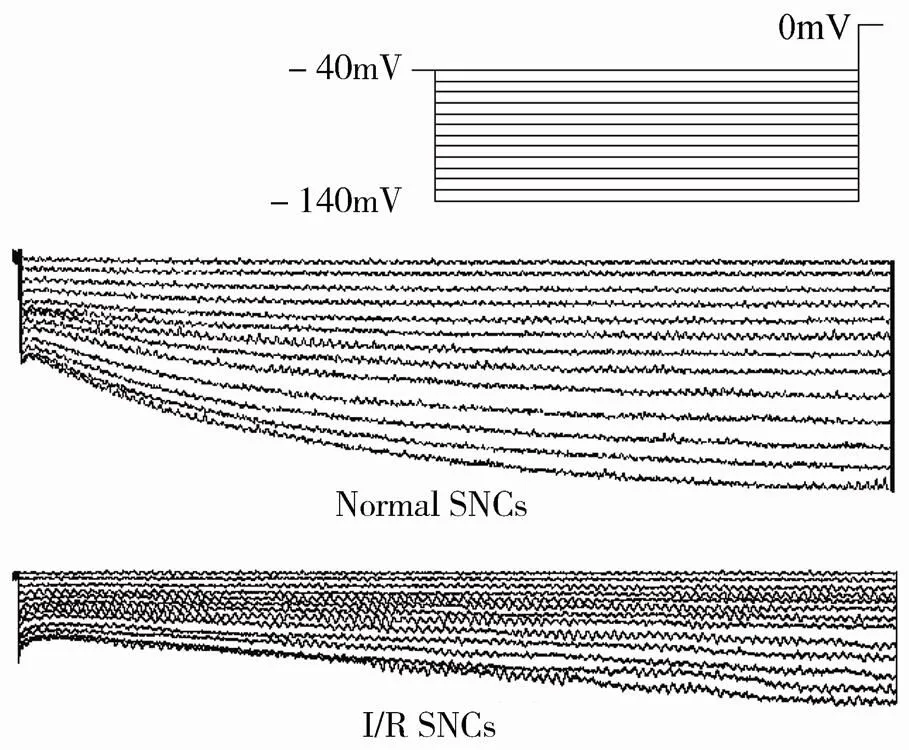
图4 I/R对起搏电流的影响
Figure 4 Effect of I/R on funny current SNCs: sinoatrial node cells; I/R: ischemia/reperfusion
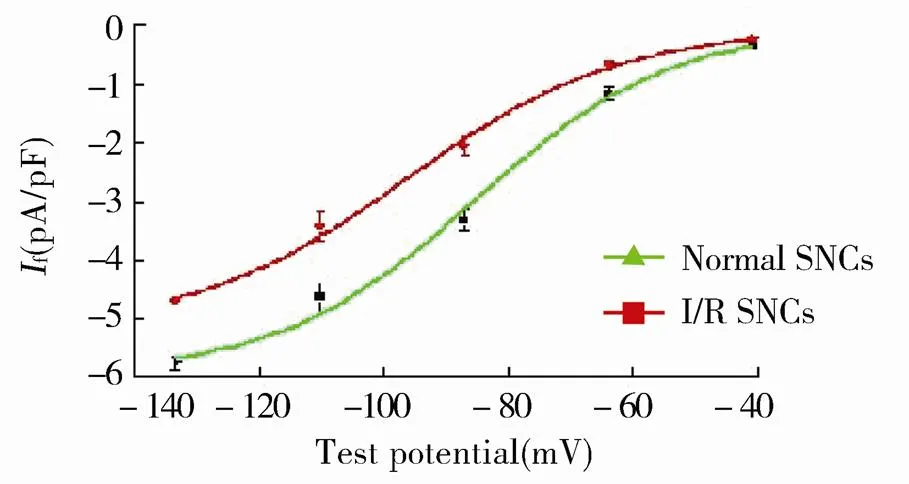
图5 I/R对起搏电流I-V曲线的影响
Figure 5 Effect of I/R on I-V curve of funny current SNCs: sinoatrial node cells; I/R: ischemia/reperfusion
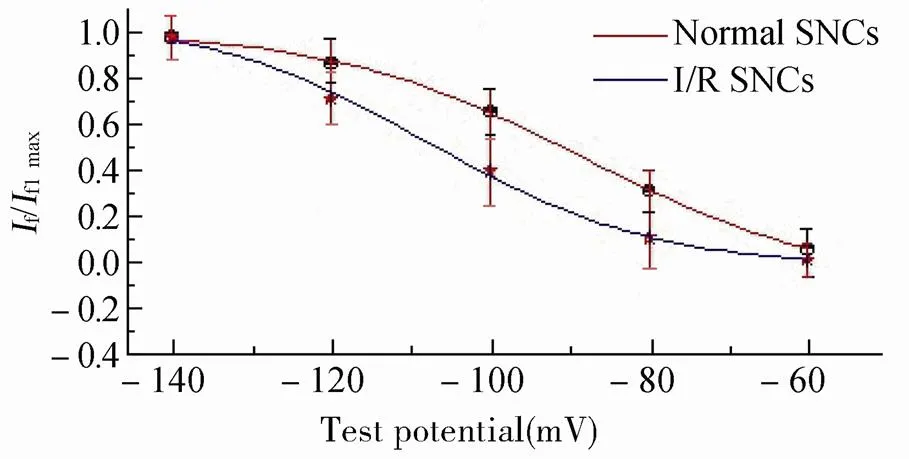
图6 I/R后SNCs If稳态激活曲线变化
Figure 6 Change in steady-state activation curve of SNCs after I/R SNCs: sinoatrial node cells; I/R: ischemia/reperfusion
3 讨 论
本研究发现,模拟I/R使SNCs起搏电流密度显著减低。进一步的离子流电压依赖性研究显示,在各测试电压下,I/R使通道电流均减少,超极化电压越负,此效应越强。进一步从通道的稳态激活研究看出,I/R使通道稳态激活曲线右移,影响通道的开放。研究结果提示,模拟I/R可改变SNCs的电生理特性,减慢起搏电流的激活,影响窦房结的起搏传导功能。I-V曲线上移,激活曲线左移,半数最大激活电压向超极化方向移动,且可显著降低各指令电压下的f密度,延长动作电位时程及复极化时间,导致SNCs起搏电流密度降低,从而降低SNCs的自发性最终产生SSS。
f在调解自主心律和心率方面具有重要作用。笔者前期的研究表明,模拟I/R可引起在体及离体SNCs结构和功能的改变,影响其电信号发放的节律和频率,导致电生理活动的紊乱[6]。I/R可降低乳鼠SNCs瞬时外向钾电流和超速激活延迟整流钾电流通道激活、加快乳鼠SNCs通道失活,同时可降低SNCs的4期自动去极化速度,延长动作电位时程及复极化时间,降低SNCs的自律性。超极化激活环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide-gated channel,HCN)4作为HCN基因家族的亚型,被认为是心脏起搏细胞产生自动节律的基础,其参与编码的超极化激活电流是心脏起搏调控的重要部分[7,8]。f离子流幅值越大,则动作电位4相舒张除极化坡度越陡,f离子流激活速度越快,SNCs的自律性越高[9,10]。Ozcan等[11]研究表明触发或自律性异常是再灌注心律失常的发生机制,钙离子超负荷发挥作用。钟理等[12]研究表明模拟I/R溶液可引起离子浓度的变化与酸碱平衡的紊乱。有研究表明,缺血可导致抑制f电流,腺苷导致f幅值降低[13]。
本实验还发现,胰酶结合Ⅱ型胶原酶逐步消化乳兔窦房结可得到活性高、表面光滑、适合膜片钳实验的细胞,其效果明显优于单胰酶消化法。本实验采用的模拟I/R造模方法参照了Koyama等[14]诱导心肌细胞死亡的模型,考虑到组织缺血时由于糖酵解引起的酸碱平衡紊乱、离子浓度改变等因素对细胞损伤的发生都有重要影响,实验采用了模拟I/R溶液来反映I/R时离子浓度的变化与酸碱紊乱,并用95%N2+5%CO2混合气取代空气来模拟低氧环境。
[1] Gilotra NA, Chow GV, Cingolani OH. Cardiac amyloidosis presenting with prolonged QT interval and recurrent polymorphic ventricular tachycardia[J]. Tex Heart Inst J, 2013, 40(2): 193−195.
[2] Downar E, Janse MJ, Durrer D. The effects of acute coronary occlusion on subepicardial transmembrane potentials in the intact porcine heart[J]. Circulation, 1977, 56(2): 217−224.
[3] Lopaschuk G. Regulation of carbohydrate metabolism in ischemia and reperfusion[J]. Am Heart, 2000, 139(2): S115−S119.
[4] Alexandre J, Schiariti M, Rouet R. Rabbit ventricular myocardium undergoing simulated ischemia and reperfusion in a double compartment tissue bath: a model to investigate both antiarrhythmic and arrhythmogenic likelihood[J]. Int J Physiol Pathophysiol Pharmacol, 2013, 5(1): 52−60.
[5] Xiang FL, Lu X, Liu Y,. Cardiomyocyte-specific overexpression of human stem cell factor protects against myocardial ischemia and reperfusion injury[J]. Int J Cardiol, 2013. doi:pii: S0167-5273(13)00832-2. 10.1016/j.ijcard.2013.04.165. [Epub ahead of print]
[6] 刘如秀, 王妮娜, 李汇博, 等. 康心复律方对病态窦房节综合征家兔窦房结电生理功能影响[J]. 中国中西医结合杂志, 2011, 21(8): 1118−1121.
[7] Bucchi A, Baruscotti M, Nardini M,. Identification of the molecular site of ivabradine binding to HCN4 channels[J]. PLoS One, 2013, 8(1): e53132.
[8] Yaniv Y, Maltsev VA, Ziman BD,. The “funny” current (f) inhibition by ivabradine at membrane potentials encompassing spontaneous depolarization in pacemaker cells[J]. Molecules, 2012, 17(7): 8241−8254.
[9] 付 勇, 廖 斌, 于风旭, 等. 缺血再灌注损伤对在体兔窦房结细胞特异性通道蛋白表达的影响[J]. 中国修复重建外科杂志, 2009, 23(7): 856−860.
[10] Verkerk AO, van Ginneken AC, Wilders R. Pacemaker activity of the human sinoatrial node: role of the hyperpolarization-activated current,f[J]. Int J Cardiol, 2009, 132(3): 318−336.
[11] Ozcan C, Palmeri M, Horvath TL,. Role of uncoupling protein 3 in ischemia-reperfusion injury, arrhythmias, and preconditioning[J]. Am J Physiol Heart Circ Physiol, 2013, 304(9): H1192−H1200.
[12] 钟 理, 宋志远. 模拟缺血-再灌注诱导原代培养乳鼠窦房结细胞凋亡的研究[J]. 第三军医大学学报, 2001, 23(1): 59−61.
[13] 富冀枫, 胡优敏, 张 照, 等. 心肌缺血时腺苷对绵羊浦肯野纤维f电流的影响[J]. 中国应用生理学杂志,2000, 16(2): 129−132.
[14] Koyama T, Temma K, Akera T. Reperfusion-induced contracture develops with a decreasing [Ca2+]i in single heart cells[J]. Am J P hysiol, 1991, 261(4): H1115−H1122.
(编辑: 张青山)
Effect of simulated ischemia-reperfusion on funny current in newborn rabbit sinoatrial node cells
LIU Ru-Xiu1*, LIU Yu1, WANG Yan-Li1, LI Yang2, PENG Jie1, LIU Jin-Feng1
(1Department of Cardiology, Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 10053, China;2Institute of Geriatric Cardiovascular Diseases, Chinese PLA General Hospital, Beijing 100853, China)
To determine the effect of simulated ischemia/reperfusion (I/R) on the morphology and funny current(f) in sinoatrial node cells(SNCs) of newborn rabbits, and clarify the electrophysiological characteristic changes of SNCs after ischemia-reperfusion injury.SNCs were isolated from newborn New Zealand rabbits by double enzyme hydrolysis/differential anchoring velocity, and then cultured under simulated ischemia reperfusion damage(95%N2+5%CO2for 1h followed by 95%O2+5%CO2for 3h). The cells cultured under normal condition(95%O2+5%CO2) served as normal control. The morphological changes of the cells were observed under inverted microscope. Patch-clamp technique was used to record action potential and thef.Normal SNCs were mainly spindle in shape and smooth and complete in surface, with fast frequency of pulsation. While, the SNCs after simulated I/R injury showed swelling and distortion, with granular and unsmooth cell membrane and retraction of pseudopodia. After simulated reperfusion, the maximum diastolic potential offin SNCs was changed from (-50.9±5.3)mV to (-43.5±4.6)mV, current density was changed from (-3.2±0.41)pA/pF to (-2.47±0.32)pA/pF, with its steady-state activation curve obvious to the right when compared with that of control, and the half activating voltage was changed from (-98.6±2.3)mV to (-107.8±4.7)mV (<0.05).Simulated I/R induces injury in SNCs. Cell electrophysiological characteristics are changed, mainly in thefreconstruction.
sinoatrial node; reperfusion injury; patch-clamp technique; funny current
(81173447).
R364.1
A
10.3724/SP.J.1264.2013.00215
2013−05−08;
2013−06−17
国家自然科学基金(81173447)
刘如秀, E-mail: liuruxiu1@163.com
