冠心病患者外周血内皮祖细胞数量及生物学功能与肝细胞生长因子的关系
2013-04-23哈小琴邓芝云董菊子彭俊华李晓云
哈小琴*, 邓芝云, 董菊子, 赵 勇, 彭俊华, 李晓云, 王 鲲
冠心病患者外周血内皮祖细胞数量及生物学功能与肝细胞生长因子的关系
哈小琴*, 邓芝云, 董菊子, 赵 勇, 彭俊华, 李晓云, 王 鲲
(兰州军区兰州总医院检验医学中心, 甘肃省干细胞与基因药物重点实验室, 兰州 730050)
观察冠心病患者外周血内皮祖细胞(EPCs)数量及生物学功能的变化,进一步探讨肝细胞生长因子(HGF)对其影响,为临床应用HGF提供理论依据。收集50例非冠心病患者(对照组)、50例冠心病患者(冠心病组;每例分为HGF干预组和非HGF干预组)外周血,应用流式细胞仪和ELISA法分别检测各组CD133+/CD34+细胞的数量和HGF水平;采用密度梯度离心法分离培养各组外周血中EPCs,通过MTT法、Transwell迁移试验、黏附能力测定试验及PI-AnnexinⅤ双重染色法来分别检测EPCs的增殖、迁移、黏附能力和凋亡水平。与对照组比较,冠心病组外周血中CD133+/CD34+细胞数量减少[(2.15±0.69)%(5.26±1.16)%,<0.01],血浆中HGF浓度升高[(6.80±1.22)(2.62±0.83)µg/L,<0.01],EPCs增殖、迁移、黏附等生物学功能减弱(<0.05);HGF干预组EPCs增殖、迁移、黏附等生物学功能显著改善(<0.05)。各组细胞凋亡水平差异无统计学意义(>0.05)。外周血中CD133+/CD34+细胞数量和血浆中HGF水平的变化可能成为冠心病患者新的危险评估因素。
冠心病; 内皮祖细胞; 肝细胞生长因子
内皮祖细胞(endothelial progenitor cells,EPCs)是一种能定向分化为成熟血管内皮细胞、具有很高的增殖潜能的前体细胞,能迁移、归巢至血管新生部位,并在归巢部位进一步增殖、分化为成熟的内皮细胞(endothelial cells,ECs),形成新的血管[1];在受损内膜的再内皮化和维持内皮组织自身平衡中也起关键作用[2]。冠心病的本质为血管病变,其与内皮损伤和内皮功能障碍关系密切;EPCs可参与内皮修复,循环EPCs水平与内皮功能密切相关,在冠心病的发生、发展中可能扮演重要角色[3]。肝细胞生长因子(hepatocyte growth factor,HGF)是一种具有多种功能的促血管生长因子,是间充质和上皮/内皮细胞间相互作用的重要信息分子,对内皮系统的生物学功能起重要的调节作用[4]。本研究通过观察冠心病患者外周血中EPCs在HGF干预前后各项生物学功能及凋亡的变化,来探讨HGF对EPCs增殖、黏附、迁移能力及凋亡的影响,为HGF在冠心病防治中的应用提供试验基础。
1 对象与方法
1.1 对象
研究对象均为兰州军区兰州总医院住院患者并知情同意。冠心病诊断参照世界卫生组织1979年诊断标准。选取50例冠心病患者(冠心病组)和50例非冠心病患者(对照组)。两组在年龄、性别、高血压、糖尿病及高血脂等临床资料方面条件齐同;排除有外伤、溃疡、视网膜病、炎症、肿瘤、近期外科手术、近3个月发生急性心肌梗死者。试验分组:非冠心病患者为对照组,冠心病组患者依据是否应用HGF干预分为HGF干预亚组和非HGF干预亚组。
1.2 试剂
M199培养基、Ficoll分离液(Gibco),胰蛋白酶(Amresco),Transwell小室(Costar),明胶和胎牛血清(杭州四季青);小鼠抗人CD133单克隆抗体、小鼠抗人VEGFR2单克隆抗体、小鼠抗人CD34单克隆抗体(R&D);免疫组化染色试剂盒及浓缩型DAB试剂盒(北京中杉金桥),二甲基亚砜(DMSO)及噻唑蓝(二苯基四氮唑溴盐,MTT;Sigma),小鼠抗人HGF单克隆抗体、重组人HGF蛋白纯品(R&D);PI-AnnexinⅤ凋亡检测试剂盒(TaKaRa)。
1.3 全血CD133+/CD34+细胞数量检测
将各组200μl EDTA抗凝全血与PE标记的小鼠抗人CD133单克隆抗体及FITC标记的小鼠抗人CD34单克隆抗体避光4℃孵育30min后,用FACSort流式细胞仪(Becton Dickinson,CellQuest软件)分析检测标记细胞的数量。各样本以其同型IgG作阴性对照。
1.4 血浆HGF水平检测
将各组分离血浆与包被液以1∶3包被酶联免疫反应板,4℃过夜,20%BSA封闭,加入工作浓度的鼠抗人HGF单克隆抗体(1mg/L),37℃作用1h,随后用PBST(PBS+0.05%吐温-20)洗涤,加入辣根过氧化物酶标记(HRP)的羊抗小鼠IgG(1∶1500)稀释,37℃作用1h,PBST洗涤,OPD显色,2mol/L硫酸中止反应。同时用重组人HGF蛋白纯品做标准曲线,于酶标仪上检测490nm吸光度(490nm)值,并依据标准曲线计算HGF水平。
1.5 EPCs的分离培养
分别采集每名非冠心病患者空腹外周血15ml和冠心病患者空腹抗凝外周血15ml,采用密度梯度离心法分离单个核细胞,将单个核细胞接种于M199培养基(含20%胎牛血清,青霉素100kU/L,链霉素100kU/L)中,37℃、5%CO2培养4d,PBS再洗掉非贴壁细胞,换培养液继续培养至7d,PBS洗掉非贴壁细胞,贴壁细胞可进行后续试验。HGF干预亚组在试验时另加终浓度20μg/L的HGF蛋白纯品(剂量依据预试验选定)。
1.6 EPCs的鉴定
培养7d后的细胞制备爬片,采用免疫细胞化学法鉴定EPCs表面的特异性标志:CD133,CD34和VEGFR2。即取出细胞爬片,PBS漂洗后10%甲醛固定细胞,滴加正常山羊血清工作液室温20min;滴加一抗(小鼠抗人CD133,CD34和VEGFR2单克隆抗体),4℃过夜,PBS冲洗;滴加生物素化二抗工作液和HRP标记链霉卵白素工作液室温置30min后,DAB显色,苏木素复染,荧光显微镜下观察。
1.7 EPCs生物学功能的检测
1.7.1 EPCs增殖能力检测 将各组贴壁细胞培养7d后,用0.25%胰蛋白酶消化并计数,调整细胞悬液为3×107/L,将100μl接种于包被有0.1%明胶的96孔培养板中,同时设空白对照孔(仅加培养液),每组6个复孔。继续培养72h后每孔加入MTT(5g/L)20μl,培养4h后,吸弃上清液,再加入DMSO(150μl/孔),充分振荡后,置酶标仪测490nm值。
1.7.2 EPCs黏附能力检测 各组贴壁细胞培养7d后,用0.25%胰蛋白酶消化收集各组贴壁细胞,悬浮在500μl完全培养液中吹打均匀,然后将同等数目的EPCs接种在包被有明胶的96孔培养板里,37℃、5%CO2培养30min后,洗去未贴壁细胞,计数贴壁细胞。
1.7.3 EPCs迁移能力检测 各组贴壁细胞消化并计数,将3×103个细胞置入Transwell小室的上室,含有HGF的培养液注入下室,培养24h后,取出Transwell小室,PBS液淋洗,用消毒棉签擦去微孔膜上层的未移动细胞,用甲醇固定,Giemsa染色,随机选择5个显微镜视野(×200),计数迁移到滤膜下面的细胞。
1.7.4 EPCs凋亡水平检测 用不含血清的M199培养细胞,置37℃、5%CO2培养箱中培养。分别于12和24h观察3组细胞的存活状态。并根据凋亡检测试剂盒说明书进行染色检测。于荧光显微镜下观察结果及摄片。
1.8 统计学处理
采用SPSS13.0软件进行统计学分析。实验数据用均数±标准差表示,组间比较采用两独立样本比较的检验。<0.05为差异有统计学意义。
2 结 果
2.1 外周血中CD133+/CD34+细胞数
流式细胞仪检测结果显示(图1,表1),与对照组比较,冠心病组外周血CD133+/CD34+细胞数量明显减少,差异具有统计学意义(<0.01)。
2.2 外周血浆中HGF的表达水平
ELISA结果显示(表1),与对照组比较,冠心病组外周血浆中HGF的表达水平明显升高,差异具有统计学意义(<0.01)。

表1 冠心病组和对照组患者外周血中CD133+/CD34+细胞比例及HGF含量
CHD: coronary heart disease; HGF: hepatocyte growth factor. Compared with control group,**<0.01
2.3 EPCs的鉴定
分离培养的单个核细胞3d后开始贴壁生长,随着培养时间的延长,大部分细胞由小圆形逐渐伸展变成长梭形内皮样细胞,小部分细胞呈鹅卵石样内皮形态。小部分细胞成圆形,部分细胞形成集落,中心是圆形细胞,四周长梭形细胞呈放射样排列(图2A)。分别用小鼠抗人CD133,CD34和VEGFR2单克隆抗体检测第7天贴壁细胞表面抗原的表达,结果均呈阳性反应(图2B,2C,2D)。即分离培养的贴壁细胞具有EPCs特征。
2.4 各组外周血EPCs生物学功能的检测
冠心病组患者外周血EPCs的增殖、黏附和迁移能力较对照组患者均明显下降(<0.05);在冠心病组中,HGF干预亚组较非HGF干预亚组EPCs的增殖、黏附和迁移各项生物学指标明显增高(<0.05;表2,图3)。
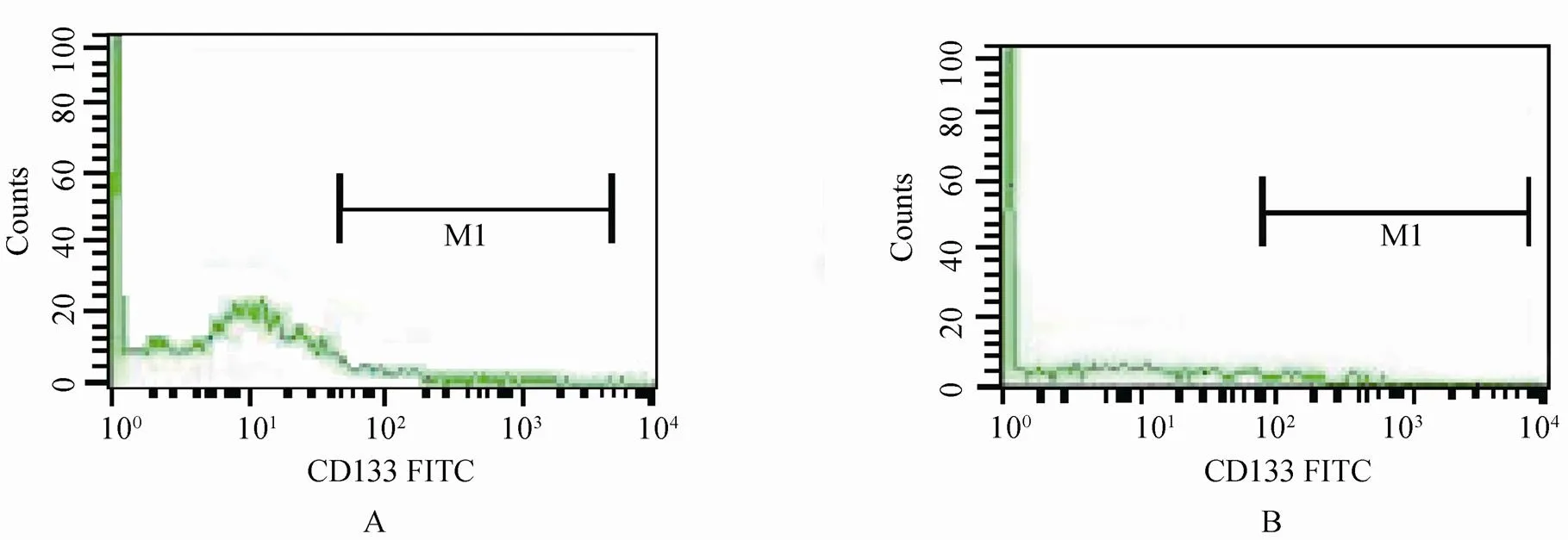
图1 冠心病组和对照组患者外周血中CD133+/CD34+细胞流式细胞检测
Figure1 Detection of CD133+/CD34+cells in peripheral blood of patients by flow cytometry A: control group; B: CHD group

图2 免疫细胞化学法对培养第7天EPCs进行表面抗原鉴定
Figure 2 Identification of surface antigen in EPCs cultured at 7 days by immunocytochemistry (DAB staining×10) EPCs: endothelial progenitor cells; A: EPCs ; B: CD133 positive EPCs; C: CD34 positive EPCs; D: VEGFR2 positive EPCs
2.5 HGF对外周血EPCs凋亡的影响
12和24h凋亡细胞的比例在冠心病组与对照组间差异无统计学意义(>0.05),冠心病非HGF干预亚组和冠心病HGF干预亚组间在12和24h的凋亡细胞比例仍无明显差异(>0.05;表3,图4)。
3 讨 论
近年的研究表明,内皮损伤和功能障碍与冠心病密切相关。内皮功能障碍的本质是内皮损伤和修复之间动态平衡的破坏[5]。EPCs在血管新生和维持内皮功能完整中具有重要作用。血管EPCs不仅参与胚胎期的血管发育,也存在于成年机体的骨髓及外周血,参与成人机体血管新生和内皮损伤后的修复,新生血管中25%的内皮细胞是由EPCs分化而来[6,7]。近年的研究表明,骨髓、外周血及脐血中的CD34+细胞或VEGFR-2+细胞或CD133+细胞离体培养2周后均能分化为内皮细胞,从而证实成年个体中也存在EPCs[8];EPCs在血管新生和维持内皮功能完整中具有重要作用。研究发现冠心病患者循环EPCs的数量及其迁移活性明显受损,并与冠状动脉粥样硬化程度呈正相关[9,10]。因此,如何促进EPCs迁移至病变血管段黏附,并促进其增殖与生长,是解决这一问题的有效途径。

表2 各组EPCs增殖、黏附和迁移能力的变化
CHD: coronary heart disease; HGF: hepatocyte growth factor. Compared with control group,*<0.05; compared with CHD without HGF subgroup,#<0.05

表3 HGF对外周血EPCs凋亡的影响
CHD: coronary heart disease; HGF: hepatocyte growth factor
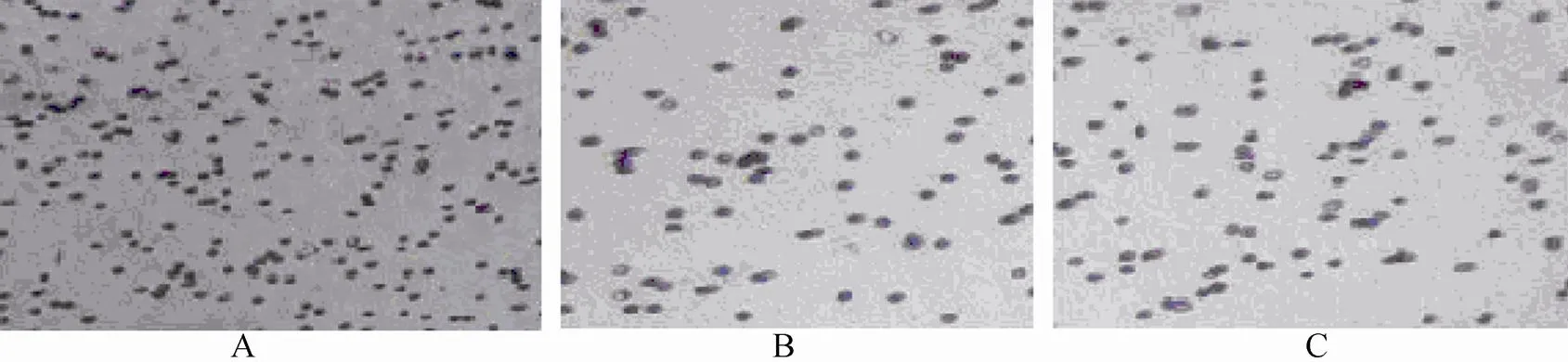
图3 各组EPCs迁移能力的变化
Figure 3 Changes in migration capability of EPCs in 3 groups (Giemsa staining×20) EPCs: endothelial progenitor cells; A: control group; B: CHD without HGF subgroup; C: CHD with HGF subgroup. Compared with control group, the migration capability of EPCs in patients with CHD group was significantly decreased. HGF treatment can improve the migration capability of EPCs in CHD group

图4 PI-AnnexinⅤ双重染色观察EPCs凋亡
Figure 4 EPCs apoptosis by PI-AnnexinⅤ double staining (×10) EPCs: endothelial progenitor cells; A, B: EPCs apoptosis at 12 and 24h in control group; C,D: EPCs apoptosis at 12 and 24h in CHD with HGF; E,F: EPCs apoptosis at 12 and 24h in CHD without HGF
本研究用流式细胞技术检测冠心病患者外周血中的CD133+/CD34+细胞及体外培养EPCs,发现冠心病患者外周血中CD133+/CD34+细胞数目减少,与此同时冠心病患者外周血分离的EPCs生物学功能均显著下降,进一步证实上述发现。
血管EPCs表达CD133、CD34、Tie22、vW因子等多种分子,同时也表达HGF的受体c-Met[11]。HGF是一种具有多种功能的促血管生长因子,通过与其特异性膜受体c-Met结合而在发育、组织器官再生、伤口愈合和血管发生中发挥重要的调节作用[12,13]。HGF与其受体结合,引起一系列信号分子的激活,最终可导致内皮细胞的生长和迁移。本研究检测发现,冠心病患者血浆中HGF表达水平是上升的,HGF能够明显改善体外培养的冠心病患者EPCs的各项生物学功能;并且发现HGF对于EPCs增殖能力的改善明显强于对黏附及迁移能力的改善,提示HGF对EPCs功能影响主要在于提高其量而非质。同时表明冠心病患者血浆中的HGF是代偿性增加的。从细胞凋亡的角度出发,HGF对冠心病患者EPCs无保护作用。
[1] Asahara T, Murohara T, Sullivan A,. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997, 275(5302): 964−967.
[2] Hunting CB, Noort WA, Zwaginga JJ. Circulating endothelial (progenitor) cells reflect the state of the endothelium: vascular injury, repair and neovascularization[J]. Vox Sang, 2005, 88(1): 1−9.
[3] Baumhakel M, Werner N, Bohm M,. Circulating endothelial progenitor cells correlate with erectile function in patients with coronary heart disease[J]. Eur Heart J, 2006, 27(18): 2184−2188.
[4] Morishita R, Aoki M, Hashiya N,. Therapeutic angiogenesis using hepatocyte growth factor(HGF)[J]. Curr Gene Ther, 2004, 4(2): 199−206.
[5] Filippov AE, Khandzhian AM, Salodukhin KA,. Endothelial dysfunction and risk factors in coronary heart disease[J]. Klin Med (Mosk), 2006, 84(2): 28−32.
[6] Wyler von Ballmoos M, Yang Z, Volzmann J,. Endothelial progenitor cells induce a phenotype shift in differentiated endothelial cells towards PDGF/PDGFRβ axis-mediated angiogenesis[J]. PLoS One, 2010, 5(11): e14107.
[7] Hill JM, Zalos G, Halcox JP,. Circulation endothelial progenitor cells, vascular function and cardiovascular risk[J]. N Engl J Med, 2003, 348 (7): 593−600.
[8] Padfield GJ, Tura-Ceide O, Freyer E,. Endothelial progenitor cells, atheroma burden and clinical outcome in patients with coronary disease[J]. Heart, 2013, 99(11): 791−798.
[9] Werner N, Wassmann S, Ahlers P,. Endothelial progenitor cells correlate with endothelial function in patients with coronary heart disease[J]. Basic Res Cardiol, 2007, 102(6): 565−571.
[10] Ruan C, Shen Y, Chen R,. Endothelial progenitor cells and atherosclerosis[J]. Front Biosci(Landmark Ed), 2013, 18: 1194−1201.
[11] Sanada F, Taniyama Y, Azuma J,. Hepatocyte growth factor, but not vascular endothelial growth factor, attenuates angiotensinⅡ-induced endothelial progenitor cell senescence[J]. Hypertension, 2009, 53(1): 77−82.
[12] Madonna R, Cevik C, Nasser M,. Hepatocyte growth factor: molecular biomarker and player in cardioprotection and cardiovascular regeneration[J]. Thromb Haemost, 2012, 107(4): 656−661.
[13] Chen M, Guan M, Li J,. Effects of hepatocyte growth factor on wound healing of rabbit maxillary sinus mucosa[J]. J Otolaryngol Head Neck Surg, 2012, 41(4): 253−258.
(编辑: 周宇红)
Relationship of number and biological functions of endothelial progenitor cells in peripheral blood of coronary heart disease patients with hepatocyte growth factor
HA Xiao-Qin*, DENG Zhi-Yun, DONG Ju-Zi, ZHAO Yong, PENG Jun-Hua, LI Xiao-Yun, WANG Kun
(Center of Clinical Laboratory, Key Laboratory of Stem Cells and Gene Medicine of Gansu Province, Lanzhou General Hospital, Lanzhou Military Command, Lanzhou 730050, China)
To investigate the changes of the number and biological functions of endothelial progenitor cells (EPCs) in peripheral blood of patients with coronary heart disease (CHD) and determine the effect of hepatocyte growth factor (HGF) on the cell number and function, so as to provide theoretical basis for further clinical application of HGF.A random controlled trial was carried out on 50 CHD patients and 50 control subjects matched in age, sex, hypertension, diabetes and hyperlipidemia. The number of EPCs (CD133+/CD34+) and the level of HGF in peripheral blood of each group were measured respectively by flow cytometry and ELISA. The proliferation, migration, apoptosis and adhering ability of EPCs were detected by MTT assay, Transwell migration experiment, PI-AnnexinⅤ double staining and adhering experiment, respectively.Compared with control group, the number of CD133+/CD34+cells in peripheral blood of CHD patients was significantly lower[(2.15±0.69)%(5.26±1.16)%,<0.01]; the plasma level of HGF was higher [(6.80±1.22)(2.62±0.83)µg/L,<0.01]; and the ability of proliferating, migrating and adhering of EPCs was reduced(<0.05). HGF significantly improved the biological function of EPCs isolated from patients with CHD(<0.05), but had no effect on the apoptosis of EPCs(>0.05).The number of CD133+/CD34+cells in peripheral blood and plasma level of HGF might be used as new risk assessment factor for CHD patients.
coronary heart disease; endothelial progenitor cells; hepatocyte growth factor
(81060015, 81273568).
R541.4
A
10.3724/SP.J.1264.2013.00204
2013−06−19;
2013−08−06
国家自然科学基金(81060015, 81273568)
哈小琴, E-mail: 842917389@qq.com
