胰腺癌多层螺旋CT影像学表现与肿瘤侵犯的关系研究
2013-04-20王宇军
俞 伟,王宇军
在恶性肿瘤的生长过程中,微血管、淋巴管大量生成是其重要环节,在很大程度上为实体瘤的生长、营养提供了一定条件[1]。肿瘤微血管生成、局部浸润以及肝转移均是导致胰腺癌迅速生长、手术切除率较低以及患者预后差的原因[2]。血管内皮生长因子(VEGF)、血管内皮生长因子C(VEGF-C)、基质金属蛋白酶(MMP)在胰腺癌组织中均有高表达;CT检查可以对患者术前状况进行评估,但其对胰腺癌的诊断是建立在胰腺周围组织以及大血管侵犯的基础上,对于肿瘤转移及微小的肝脏腹膜转移的诊断准确性不高。本研究旨在探讨胰腺癌多层螺旋CT(MSCT)影像学表现与肿瘤侵犯的关系,现报道如下。
1 资料与方法
1.1 一般资料 选择我院2009年12月—2012年2月收治的胰腺癌患者40例,均经手术病理明确诊断,收集其肿瘤组织病理切片和石蜡块。40例患者中男26例,女14例;年龄25~69岁,平均55.2岁;肿瘤部位:胰头25例,胰体胰尾15例;肿瘤转移:十二指肠11例,脾脏7例,胆管5例,横结肠2例;治疗过程中淋巴转移15例,肝脏转移4例;手术方式:胰十二指肠切除术31例,胰体尾联合脾脏切除9例;病理分级:Ⅰ级4例,Ⅱ级29例,Ⅲ级7例;国际抗癌协会癌症临床分期(UICC分期):Ⅰ期15例,Ⅱ期11例,Ⅲ期10例,Ⅳ期4例。
1.2 MSCT 所有患者术前进行MSCT三期扫描,包括动脉期、胰腺期及门静脉期;对比剂选用碘普罗胺注射液(优维显)300 mgI/ml,90 ml,采用高压注射器由患者前臂静脉注射,速度3.0 ml/s;采用64排螺旋CT扫描仪,参数设定:电压120 kV,电流160 mAs,准直2.5 mm,层厚3.0 mm,扫描间隔0.5 s,螺距5 mm。每期扫描时间6~9 s,延迟设定:动脉期23 s,胰腺期30 s,门静脉期60 s;扫面结束后将动脉期和胰腺期所得数据经过内插重建后进行图像重组,成像方法主要包括最大密度投影、容积再现及多平面重组。根据血管受侵分级标准(Loyer分级标准)将胰腺周围血管侵犯程度分为5级:A级:低密度肿瘤和(或)正常胰腺与邻近血管之间有脂肪分隔;B级:低密度肿瘤与血管之间有正常胰腺组织;C级:低密度肿瘤与血管之间有凸面点状接触;D级:低密度肿瘤与血管有凹面接触,或者部分包绕;E级:低密度肿瘤完全包绕邻近血管,但尚未造成管腔变化;F级:低密度肿瘤阻塞血管或浸润血管致使管腔狭窄[3]。
胰腺周围血管包括肠系膜上动静脉、脾动静脉、肝总管、门静脉、上下腔静脉,肾动静脉,上述血管中1支Loyer分级≥D级定义为该血管侵犯。依照Dietd制订的标准,由2位经验丰富的医学影像医师采用双盲法进行影像分析,对病变范围、大小、密度、毗邻关系、周围组织及血管侵袭情况、淋巴及脏器转移情况进行全面的分析、分级。胰腺周围组织侵犯表现为胰腺周围脂肪消失,肿瘤与邻近脏器贴邻仅提示肿瘤与邻近脏器粘连或相互压迫,不确诊为受侵。
1.3 免疫组织化学及苏木素-伊红(HE)染色 从收集的肿瘤组织病理切片和石蜡块选择肿瘤组织丰富的石蜡块连续切片,共切取6张,取1张进行HE染色[4],另外5张行免疫组化染色,观察VEGF、VEGF-C、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)、CD34的表达。
在100倍光镜下[5]查找新生微血管,计数管腔形态有棕色颗粒着色的内皮细胞,每张切片随机取5个视野取平均值,各因子均以肿瘤细胞外基质层胞质和毛细血管内皮细胞胞质内出现棕黄色颗粒为阳性表达(见图1);计分方法:无棕黄色颗粒计为0分;可见棕黄色颗粒,但阳性细胞数<10%计为1分;阳性细胞数10%~50%计为2分;阳性细胞数>50%计为3分。以0~1分无意义,2~3分为有意义。
1.4 统计学方法 应用SPSS 18.0软件进行统计学分析,计数资料的比较采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 胰腺周围血管侵犯 40例患者中胰腺周围血管侵犯25例,未侵犯周围血管15例(见图2),侵犯周围血管组与未侵犯周围血管组肿瘤部位、淋巴转移率、肝脏转移率、UICC分期、病理分级及VEGF、VEGF-C、MMP-2、MMP-9、CD34阳性率比较,差异均无统计学意义(P>0.05,见表1)。
2.2 胰腺周围组织侵犯 40例患者中胰腺周围组织侵犯19例,未侵犯周围组织21例(见图3),侵犯周围组织组与未侵犯周围组织组肿瘤部位、淋巴转移率、肝脏转移率、UICC分期、病理分级及VEGF、VEGF-C、MMP-2、MMP-9、CD34阳性率比较,差异均无统计学意义(P>0.05,见表2)。

注:A:VEGF阳性表达;B:MMP-9阳性表达
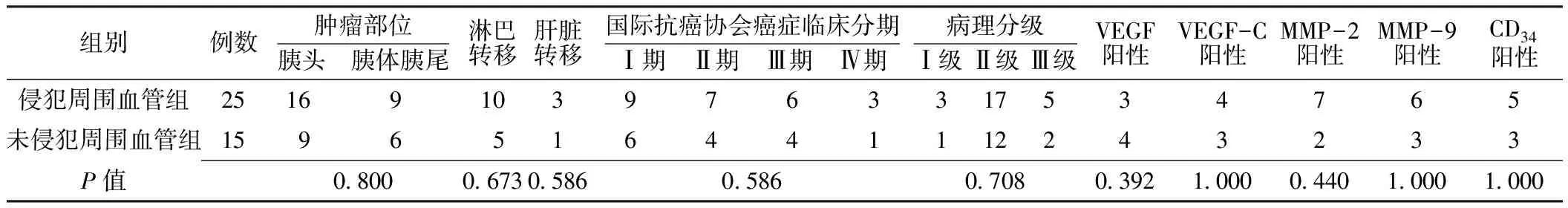
表1 侵犯周围血管组和未侵犯周围血管组肿瘤特征比较(例)
注:VEGF=血管内皮生长因子,VEGF-C=血管内皮生长因子C,MMP-2=基质金属蛋白酶-2,MMP-9=基质金属蛋白酶-9

表2 侵犯周围组织组与未侵犯周围组织组肿瘤特征比较(例)
3 讨论
血管的生成较为复杂,但其在肿瘤的生长、侵犯等过程中起着重要作用。新生血管的形成主要是由一些炎性细胞因子介导的,VEGF是其中常见的因子,在血管通透性和肿瘤血行转移方面发挥着重要作用。微血管密度(MVD)是近年来确定的检测肿瘤血管生长的可靠指标,其直接反映了微血管生成活性,同肿瘤临床分期密切相关,是恶性肿瘤的独立预后影响因子[6]。
本研究观察了胰腺癌周围血管侵犯及胰腺周围组织侵犯的MSCT影像学表现,但没有将淋巴结及远处转移纳入观察范围,主要是考虑到淋巴结转移及远处转移类似于肝脏和腹膜转移,在MSCT影像学下表现并不明显。胰腺周围血管侵犯及周围组织侵犯都是癌症恶性程度高的表现,本研究结果显示,侵犯周围血管组与未侵犯周围血管组、侵犯周围组织组与未侵犯周围组织组UICC分期间均无统计学差异,但MSCT发现的周围组织或血管侵犯患者UICC分期多为晚期。侵犯周围血管组与未侵犯周围血管组病理分级间无统计学差异,而侵犯周围组织组与未侵犯周围组织组病理分级间亦无统计学差异,提示肿瘤恶性程度与胰腺周围组织侵犯关系不大。此外,侵犯周围血管组与未侵犯周围血管组、侵犯周围组织组与未侵犯周围组织组VEGF阳性率间均无统计学差异,说明新生血管形成是影响胰腺癌生长及侵犯等的重要因素,肿瘤侵犯的生物学行为与其内在生物学特性及MVD密切相关。
本研究结果同时显示,侵犯周围血管组与未侵犯周围血管组淋巴转移率、肝脏转移率均无统计学差异,提示胰腺癌新生血管形成是帮助其完成侵犯过程的重要环节,而当早期有周围血管侵犯时并不一定出现淋巴转移或肝脏转移。因此,临床上发现瘤体侵犯血管时应当将受侵血管整段切除并行断端吻合术[7]。
MSCT的出现使CT检查有了革命性的发展,其容积扫描技术可以重建出层厚为0.625 mm的薄层图像,更有利于微小病变的观察。胰腺MSCT三维成像利用工作站后处理软件,可以生成胰腺三维图像,有利于全方位、多角度地观察胰腺癌与周围组织的解剖关系,为临床手术提供更多的参考信息。但早期胰腺癌的影像学特征有时不是很明显,可以结合其他灵敏度较高的实验室检查指标如糖类抗原19-9(CA19-9)等综合诊断[8]。
综上所述,MSCT可显示胰腺周围血管侵犯、周围组织侵犯,可帮助诊断胰腺癌,用于观察微小病变,指导手术。
1 陆勇,宋卫峰,许志伟,等.胰腺癌的CT影像表现与临床病理因素及血管生成的关系[J].临床放射学杂志,2007,26(2):153-157.
2 宋卫峰,陆勇,许志伟,等.MSCT影像表现及肿瘤血管生成对胰腺癌预后价值的探讨[J].放射学实践,2006,21(5):442-445.
3 尚建敏,夏进东,赵年,等.多层螺旋CT血管成像对胰腺癌侵犯胰周血管的表现及可切除性评价[J].放射学实践,2010,25(6):662-665.
4 吴江,朱虹,王中秋,等.胰腺癌CT表现与手术病理及D2-40表达的相关性研究[J].医学影像学杂志,2012,22(1):97-101,105.
5 陈华成,高珊珊,孙晓东,等.胰腺恶性肿瘤侵犯结肠的多层螺旋CT表现[J].潍坊医学院学报,2012,34(6):450-451.
6 张雯杰,吴宁,周纯武,等.18FDG PET/CT与增强CT对胰腺癌分期的价值[J].中国医学影像技术,2012,28(4):727-730.
7 孙立辉,左玉江.CT影像学诊断慢性胰腺炎与胰腺癌的临床研究[J].健康之路,2013,12(3):24-25.
8 陈雷,杨国志,刘洋,等.MSCT增强检查在胰腺癌术前评估中的应用[J].中国现代药物应用,2012,06(21):52-53.
