蛋白激酶5 过度激活诱发β细胞凋亡和调节胰岛素分泌的机制研究
2013-04-20郑亚莉陆晓华罗红艳兰晓梅
郑亚莉,陆晓华,曹 丽,王 慧,李 博,鄂 静,保 莉,罗红艳,兰晓梅
糖尿病的病理生理机制主要是β细胞数量的减少和功能障碍导致胰岛素分泌减少。β细胞的减少在糖尿病发生之前即存在,并贯穿于整个糖尿病发病的始终[1-3]。研究发现,慢性葡萄糖毒性抑制胰岛素分泌、胰岛素基因表达缺陷及氧化应激可导致β细胞损害和凋亡[4-6]。近期的研究发现细胞周期素依赖的蛋白激酶5(CDK5) 及其激活蛋白p35广泛存在于胰腺β细胞,可能参与胰岛素分泌调节[7]。CDK5的主要激活剂p35主要存在于中枢神经组织,与CDK5结合使其激活,参与神经递质的分泌并对维持神经元的正常功能发挥重要的作用[8]。由于胰岛β细胞与神经元有着共同的外分泌特征[9],近年来发现高糖环境下、p35表达增高,参与了哺乳动物血糖的调节[10],但其机制如何,相关研究报道较少。本研究通过采用不同浓度葡萄糖刺激胰岛β细胞,观察p35和其裂解产物p25的表达水平、CDK5活性、胰岛素分泌变化以及胰岛β细胞的凋亡情况,研究p35在胰岛素调节过程中可能的作用机制。
1 材料与方法
1.1 材料 CDK5单克隆和多克隆抗体(C-8)、p35多克隆(C-19)抗体购自Santa Cruz公司;一步法cDNA合成试剂盒、Lipofectamine基因转染试剂购自Invitrogen公司;DMEM培养液购自Gibco公司; DMSO购自Sigma公司;胎牛血清购自Hyclone公司;CDK5、p35、胰岛素分泌测定酶标免疫试剂盒购自Linco Research 公司。
1.2 方法 采用不同浓度的葡萄糖(5 mmol/L组、20 mmol/L组和30 mmol/L组)刺激胰岛β细胞6 h,收取和固定细胞,行免疫印迹和免疫荧光法测定p35的表达;将p35基因克隆到腺病毒载体中,将p35病毒和空载体病毒(EV)分别转染到胰岛β细胞中(p35组和EV组),测定p35蛋白表达、CDK5活性及胰岛素分泌水平;为进一步证实CDK5活性可以调节胰岛素分泌,采用CDK5抑制剂(p35+Ros组)进行抑制试验;为验证p25可引起胰岛β细胞的损伤,采用细胞凋亡相关抗体Cleaved caspase 3测定胰岛β细胞凋亡,具体如下。
1.2.1 细胞培养 Min6小鼠胰岛β细胞(由NIH,Dr.Abner Notkins′lab 赠送)。胰岛β细胞在含4.5 mg/ml葡萄糖,10%胎牛血清加100 U/ml青霉素G和100 μg/ml链霉素的细胞培养皿中培养。
1.2.2 免疫沉淀及CDK5活性测定 用细胞裂解液收取细胞,提取蛋白,BCA法进行蛋白定量分析。取200 μg蛋白加CDK5多克隆抗体(C-8),在4 ℃中旋转孵育过夜, 次日加免疫球蛋白(Ig)A琼脂糖凝胶珠在4 ℃中旋转孵育4 h,用细胞溶解液洗3次,做免疫印迹或用同位素-32P标记测定酶的活性。
1.2.3 免疫印迹 将提取的蛋白按每道35 μg与上样缓冲液混合后,上样到4%~20%聚丙烯酰胺凝胶电泳(SDS)-PACE凝胶,电泳分离,转膜到聚偏二氟乙烯(PVDF)膜(100 V,90 min)。用封闭液封闭1 h;一抗反应液(以5 %脱脂奶粉封闭液稀释,抗CDK5和p35多克隆抗体1∶200),4 ℃孵育过夜;TBST缓冲盐溶液漂洗4次,与辣根过氧化物酶标记的二抗(1∶5 000)在室温下孵育1~2 h;TBST缓冲盐溶液漂洗4次,增强化学发光法(ECL)显色,X射线底片曝光。
1.2.4 p35和CDK5基因的病毒制备 克隆p35和CDK5 DNA质粒:设计引物,合成;聚合酶链式反应(PCR)扩增,将DNA扩增产物装入TA载体,做DNA测序。如果测序正常,用EcorV和Not1限制酶消化装有靶基因的TA载体和pAdTrack-CMV病毒质粒(37 ℃ 水浴,2 h),然后用DNA连接酶连接靶基因片段和pAdTrack-CMV质粒片断,获得pAdTrack-CMV-靶基因病毒质粒。将上述基因病毒质粒转入HEK239细胞内,48 h后收取细胞及上清液,离心,用冻溶法提取病毒,然后用氯化铯梯度离心纯化病毒。病毒转染浓度滴度检测找出最佳的转染浓度。
1.2.5 p35基因病毒转染和胰岛素分泌水平测定 将胰岛β细胞铺板到6孔培养盘(100万/孔),在DMEM培养基中培养,其中加10%胎牛血清和100 U/ml青链霉素。放在37 ℃,5% CO2细胞培养箱中培养。次日加p35病毒(每孔浓度1 μg/ml)。48 h后收取细胞上清液,使用胰岛素分泌测定试剂盒,用免疫酶标方法进行测定分析。
1.2.6 免疫荧光染色 各实验组细胞(组织切片)用4%甲醛固定30 min,5% BSA/PBS(含0.1% TritonX-100)封闭液封闭30 min,加入用封闭液稀释的一抗,4 ℃孵育过夜或室温下2 h。 然后加入免疫荧光标记的IgG抗体(二抗)在室温下孵化1 h,然后用PBS洗涤3遍,细胞核用Hoescht 33342染色。使用Zeiss LSM - 510扫描共聚焦显微镜观察荧光图像,图像处理使用Adobe Photoshop。

2 结果
2.1 不同浓度葡萄糖培养的胰岛β细胞p35和CDK5的表达 免疫印迹测定,不同浓度葡萄糖培养的胰岛β细胞p35的表达比较,差异有统计学意义(P<0.05);20 mmol/L组和30 mmol/L组p35的表达较5 mmol/L组升高,30 mmol/L组p35的表达较20 mmol/L组升高,差异均有统计学意义(P<0.05)。不同浓度葡萄糖培养的胰岛β细胞CDK5 的表达比较,差异无统计学意义(P>0.05,见表1、图1A)。荧光免疫染色显示高浓度葡萄糖(30 mmol/L)刺激Min6细胞可引起p35表达增高;而CDK5的表达无区别 (图1B)。

表1 不同浓度葡萄糖培养的胰岛β细胞p35和CDK5的表达比较
注:与5 mmol/L组比较,*P<0.05
2.2 不同浓度葡萄糖对胰岛β细胞CDK5活性、胰岛素分泌的影响 20 mmol/L组和30 mmol/L组胰岛β细胞CDK5活性较对5 mmol/L组增高,差异均有统计学意义(P<0.05)。30 mmol/L组胰岛β细胞CDK5活性较20 mmol/L组增高,差异有统计学意义(P<0.05,见图2A、2B)。20 mmol/L组和30 mmol/L组在刺激6 h较2 h胰岛素分泌均降低,差异均有统计学意义(P<0.05,图2C)。
2.3 高浓度葡萄糖对p35组和EV组p35活性和CDK5活性的影响 p35组p35表达较EV组增高,p35组可见p25条带(图3A),p35组CDK5活性较EV组增高,差异有统计学意义(P<0.05,见图3B、3C);p35组胰岛素分泌水平较EV组增高,差异有统计学意义(P<0.05,图3D)。
2.4 p35组、EV组和p35+Ros组细胞凋亡和胰岛素分泌情况 p35组细胞凋亡相关抗体Cleaved caspase 3表达较EV组增加,差异有统计学意义(P<0.05);p35+Ros组细胞凋亡相关抗体Cleaved caspase 3表达明显较p35组减少,差异有统计学意义(P<0.05)。EV组和p35+Ros组胰岛素分泌较p35组增加,差异有统计学意义(P<0.05,见图4)。
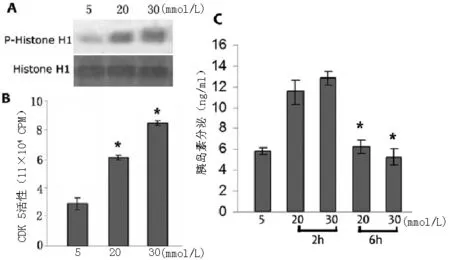
图2 不同浓度葡萄糖对胰岛β细胞CDK5活性、胰岛素分泌的影响
Figure2 In different concentrations of glucose environment,CDK5 activityand insulin secretion of islet beta cells

注:A免疫印迹测定,B荧光免疫染色
图1 不同浓度葡萄糖刺激下p35、CDK5在胰岛β细胞中的表达
Figure1 In different concentration of glucose environment,p35,CDK5 expression in islet beta cells

图3 高浓度葡萄糖对p35组和EV组p35表达和CDK5活性的影响
Figure3 In high concentrations of glucose environment,p35 expression level and CDK5 activity level and insulin secretion in p35 group and EV group
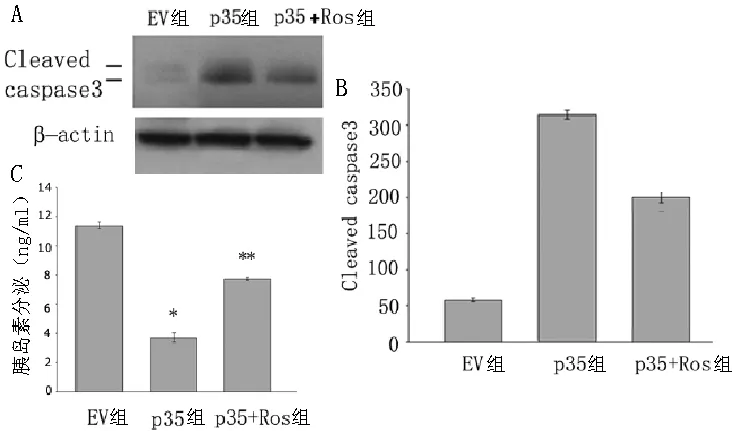
图4 p35组、EV组和p35+Ros组细胞凋亡和胰岛素分泌情况
Figure4 Apoptosis and insulin secretion in P35 group,EV group and p35 +Ros group
3 讨论
CDK5是细胞周期素依赖蛋白激酶(CKD)家族的特殊成员,是脯氨酸限制性丝氨酸/苏氨酸蛋白激酶,普遍存在于哺乳动物的细胞内[11]。p35和p39是CDK5的激活亚基,生理情况下,CDK5与其激活亚基p35结合形成CDK5/p35复合物而被激活,并通过底物水平磷酸化在神经系统的发育、神经递质的分泌以及维持神经元正常功能方面发挥着重要的作用[8]。
研究发现,在病理状态下,如氧化应激、高血糖等环境下,诱导p35分解为p25,形成CDK5/p25复合物,使CDK5处于过度激活状态,并过度磷酸化某些底物,诱导细胞凋亡,使得机体相应的功能发生障碍,如诱导神经元细胞的凋亡,表现为神经退行性疾病,比如阿尔茨海默病等[11-12]。2型糖尿病与阿尔茨海默病发病有着相似的生理机制,近年来也证实,p35在2型糖尿病患者的胰岛β细胞中也有很高的表达,且可以通过激活CDK5的活性,调节胰岛素的分泌。Jonas 等[5]发现通过抑制CDK5的活性可以增加胰岛素的分泌。这也就提示过度的CDK5激活可能对胰岛素的分泌起抑制作用。p35的表达和CDK5的活性变化可能在糖尿病的发病过程中也起着重要的作用,相关研究鲜见报道。
本研究结果首先证实了高浓度的葡萄糖可以增加胰岛β细胞p35的表达,且用同位素标记的方法研究发现,高糖情况下,胰岛β细胞CDK5的活性明显增强。而且,此时胰岛β细胞分泌胰岛素也减少。引起这一结果的机制是否也与其p35的表达增加有关?本研究采用基因克隆和病毒转染的方法,将p35基因通过病毒转染到胰岛β细胞中,并以转染空载体病毒为对照, 发现p35组的CDK5活性明显增强。而且转染了p35基因的细胞在高糖刺激下可以诱发p25的表达,而在转染空载体的细胞则无p25的表达,故推测在高糖环境下,p25 的产生引起CDK5过度激活在调节胰岛素分泌中发挥重要的作用。进一步采用CDK5抑制剂处理处于CDK5过度激活状态的胰岛β细胞,结果发现: CDK5的活性明显受到抑制,则更加证明高浓度的葡萄糖是通过增加p35的表达,进而诱发p25的表达,引起CDK5过度活性,从而抑制胰岛素分泌。同时也发现,在p25表达的同时伴有胰岛β细胞凋亡增加,表明使胰岛素的分泌减少是通过增加胰岛β细胞的凋亡实现的。相反,在CDK5过度激活的细胞组加入CDK5抑制剂后,则细胞凋亡情况明显降低,进一步证实CDK5过度激活通过增加胰岛β细胞凋亡使胰岛素分泌减少。另外也发现,20 mmol/L组和30 mmol/L组与5 mmol/L组比较,仅有p35表达和CDK5活性增加,而没有CDK5表达增加,说明参与整个病理过程的是CDK5的过度激活而非其表达增加。
总之,本研究发现高浓度葡萄糖是通过增加p35的表达,进而诱发p25的表达,引起CDK5的过度激活,使胰岛β细胞凋亡增加,从而抑制胰岛素的分泌。这可能是高糖导致胰岛β细胞病理状态下胰岛素分泌调节失常的作用机制之一。CDK5过度激活可以通过与各种信号传导途径如MAPK、P38、PKC等的互相调节作用增加胰岛β细胞凋亡,减少胰岛素的分泌;最近的研究发现CDK5/p25活性磷酸化过氧化物酶体增殖物激活受体γ(PPAR-γ),抑制PPAR-γ的活性从而增加外周组织对胰岛素的抵抗[13-14]。因此更多更深入的有关CDK5/p25及其抑制剂在胰岛素分泌调节机制研究将为在分子水平寻找治疗2型糖尿病的新方法奠定理论基础。
致谢:感谢美国国立研究院神经疾病及中风研究所Harish C.Pant教授和南方医院神经内科实验室主任胡亚芳教授赠送Min6细胞株和腺病毒载体以及在基因病毒构建过程中给予的大力支持和指导!
1 Matveyenko AV,Butler PC.Relationship between beta-cell mass and diabetes onset[J].Diabetes Obes Metab,2008,10(Suppl 4):23-31.
2 金京姬,许玉子,孙明子.糖耐量正常者胰岛素敏感性和β细胞功能的研究[J].中国全科医学,2011,14(12):4101.
3 周文敬,李卿姬,李素香,等.口服葡萄糖-胰岛素释放试验者β细胞功能及胰岛素敏感性分析[J].中国全科医学,2011,14(4):1248.
4 Kaneto H,Kawamori D,Matsuoka TA,et al.Oxidative stress and pancreatic beta-cell dysfunction[J].Am J Ther,2005,12(6):529-533.
5 Jonas JC,Bensellam M,Duprez J,et al.Glucose regulation of islet stress responses and beta-cell failure in type 2 diabetes[J].Diabetes Obes Metab,2009,11(Suppl 4):65-81.
6 Andrali SS,Sampley ML,Vanderford NL,et al.Glucose regulation of insulin gene expression in pancreatic beta-cells[J].Biochem J,2008,415(1):1-10.
7 Wei FY,Nagashima K,Ohshima T,et al.Cdk5-dependent regulation of glucose-stimulated insulin secretion[J].Nat Med,2005,11(10):1104-1108.
8 Hisanaga S,Saito T.The regulation of cyclin-dependent kinase 5 activity through the metabolism of p35 or p39 Cdk5 activator[J].Neurosignals,2003,12(4/5):221-229.
9 Li L,Holscher C.Common pathological processes in Alzheimer disease and type 2 diabetes:a review[J].Brain Res Rev,2007,56(2):384-402.
10 Ubeda M,Rukstalis JM,Habener JF.Inhibition of cyclin-dependent kinase 5 activity protects pancreatic beta cells from glucotoxicity[J].J Biol Chem,2006,281(39):28858-28864.
11 Dhavan R,Tsai LH.A decade of CDK5[J].Nat Rev Mol Cell Biol,2001,2(10):749-759.
12 Patrick GN,Zukerberg L,Nikolic M,et al.Conversion of p35 to p25 deregulates Cdk5 activity and promotes neurodegeneration[J].Nature,1999,402(6762):615-622.
13 Choi JH,Banks AS,Estall JL,et al.Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5[J].Nature,2010,466(7305):451-456.
14 Doshi LS,Brahma MK,Bahirat UA,et al.Discovery and development of selective PPAR gamma modulators as safe and effective antidiabetic agents[J].Expert Opin Investig Drugs,2010,19(4):489-512.
