鲍曼不动杆菌耐药率与抗菌药物使用情况的相关性分析
2013-04-20许弄章金忠华
许弄章,金忠华
鲍曼不动杆菌(Acinetobacter baumannii)是非发酵革兰阴性菌,广泛存在于医院环境中,尤其是重症监护病房内,是最为常见的条件致病菌[1]。近来随着抗菌药物的广泛、高强度的应用,医院感染鲍曼不动杆菌分离率越来越高,对多种抗菌药物耐药,且耐药率多呈上升趋势[1]。本研究旨在探讨医院抗菌药物应用与鲍曼不动杆菌耐药性产生的相关性。
1 资料与方法
1.1 资料来源 2011年第三季度至2012年第三季度我院临床分离的鲍曼不动杆菌菌株及药敏试验结果。
1.2 细菌分离、鉴定及药敏试验 细菌分离、鉴定按《全国临床检验操作规程》[2]进行,采用法国生物梅里埃细菌鉴定系统的ATB复合检测板进行细菌的药敏试验。
1.3 抗菌药物使用情况 利用医院药品使用的计算机管理系统,按季度统计2011年第三季度至2012年第三季度抗菌药物的病区使用率、总的使用强度(AUD)及β-内酰胺类、氟喹诺酮类、氨基糖苷类抗菌药物的AUD。限定日剂量(DDD)参考《卫生部抗菌药物临床应用监测网药品字典及DDD值》[3]和相关药品说明书制定。AUD以平均每日每百张床位所消耗的DDD数表示,即AUD=DDD/同期收治患者人天数×100。
1.4 统计学方法 采用SPSS 19.0统计软件将鲍曼不动杆菌的季度总耐药率分别与抗菌药物使用率,所有抗菌药物的AUD,β-内酰胺类、氟喹诺酮类、氨基糖苷类抗菌药物的AUD进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2011年第三季度至2012年第三季度共检出鲍曼不动杆菌281株,占细菌检出总数(1 426株)的19.7%。
2.1 鲍曼不动杆菌的耐药情况见表1,主要抗菌药物使用情况见表2。
2.2 鲍曼不动杆菌耐药率与抗菌药物使用情况的相关性 鲍曼不动杆菌耐药率与抗菌药物使用率、总AUD、氟喹诺酮类和β-内酰胺类药物的AUD的相关性有统计学意义(P<0.05),而与氨基糖苷类AUD的相关性无统计学意义(P>0.05,见表3、图1~4)。
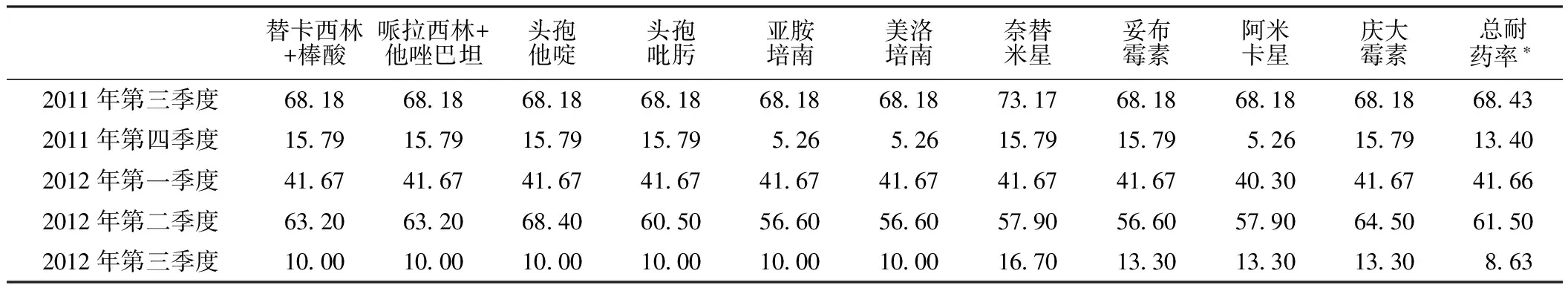
表1 2011年第三季度至2012年第三季度鲍曼不动杆菌的耐药率(%)
注:*包括表中列出的抗菌药物及其他未列出的使用量少、代表性不强的抗菌药物
表2 2011年第三季度至2012年第三季度各抗菌药物的AUD
Table2 AUD of antimicrobial drugs from the third quarter of 2011 to the third quarter of 2012
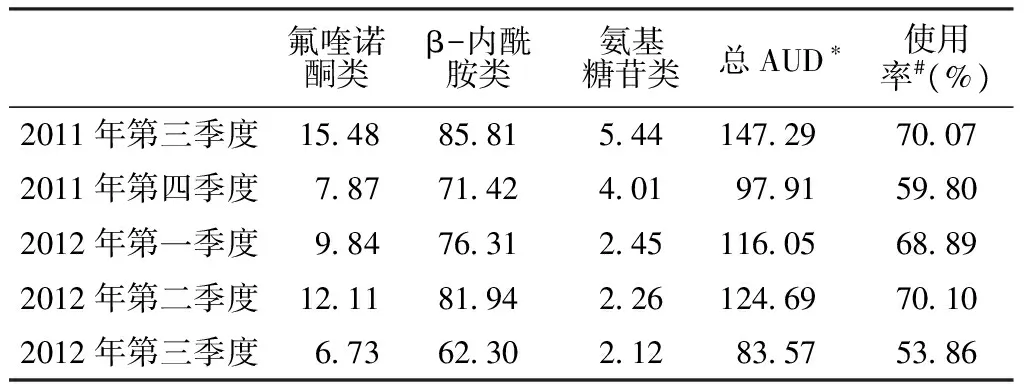
氟喹诺酮类β-内酰胺类氨基糖苷类总AUD∗使用率#(%)2011年第三季度154885815441472970072011年第四季度7877142401979159802012年第一季度98476312451160568892012年第二季度121181942261246970102012年第三季度673623021283575386
注:*包括表中列出的抗菌药物及其他未纳入分析的抗菌药物;#使用率=(本季度使用某类抗菌药物的患者数/本季度所有患者总数)×100%;AUD=使用强度
表3 鲍曼不动杆菌耐药率与抗菌药物使用情况的相关性
Table3 The relationship between Acinetobacter baumannii resistance rates and antimicrobial consumption
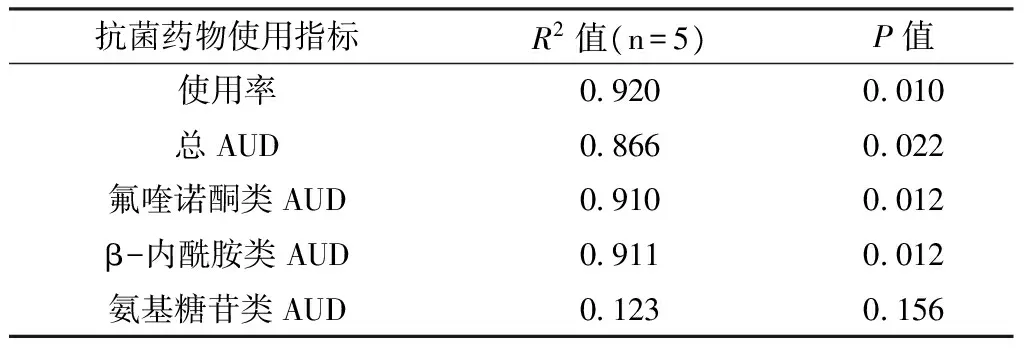
抗菌药物使用指标R2值(n=5)P值使用率09200010总AUD08660022氟喹诺酮类AUD09100012β-内酰胺类AUD09110012氨基糖苷类AUD01230156
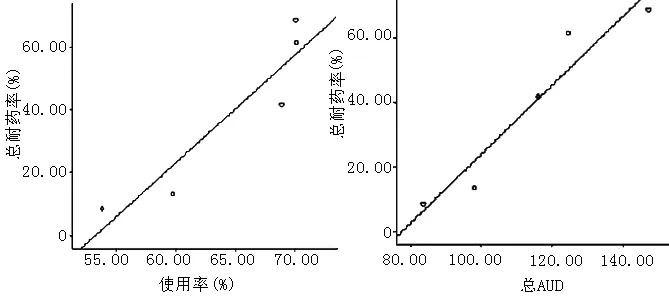
图1 鲍曼不动杆菌耐药率与抗菌药物使用率、AUD的相关性分析
Figure1 Correlation analysis between Acinetobacter baumannii resistance rates and the utility rate,AUD of antimicrobial drugs
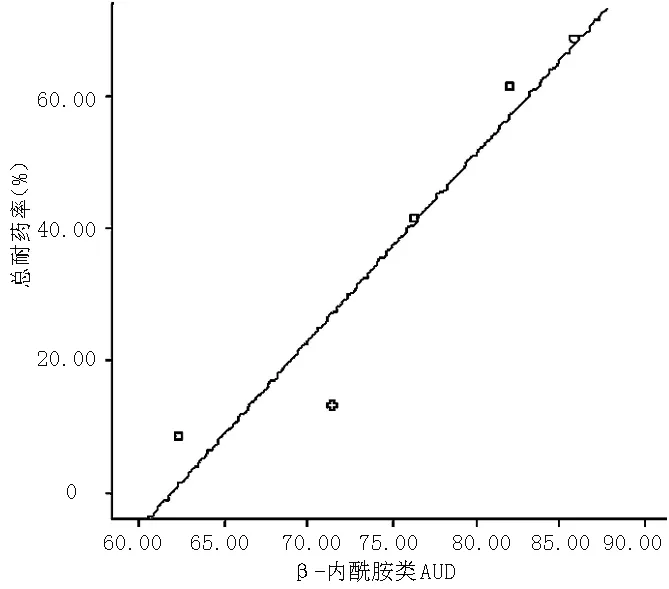
图2 鲍曼不动杆菌耐药率与β-内酰胺类AUD的相关性分析
Figure2 Correlation analysis between Acinetobacter baumannii resistance rates and the AUD of β-lactam
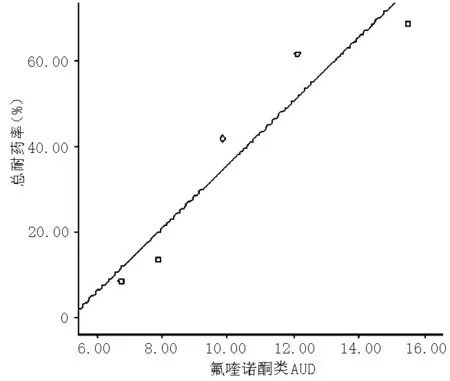
图3 鲍曼不动杆菌耐药率与氟喹诺酮类AUD的相关性分析
Figure3 Correlation analysis between Acinetobacter baumannii resistance rates and the AUD of Fluoroquinolones
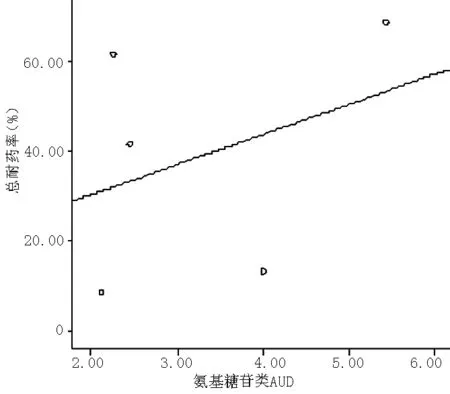
图4 鲍曼不动杆菌耐药率与氨基糖苷类AUD的相关性分析
Figure4 Correlation analysis between Acinetobacter baumannii antimicrobial resistance rates and the AUD of Aminoglycoside
3 讨论
抗菌药物使用指标的控制情况对于促进合理用药、降低细菌耐药具有十分重要的意义。使用率和AUD均是目前监测抗菌药物的重要指标,可实现多视角比较,如不同机制的抗菌药物产生耐药的机会等,从而采取相关的干预措施。本研究结果显示,当抗菌药物使用率低于60%、AUD有所下降时,鲍曼不动杆菌耐药率明显下降。显示了《抗菌药物临床应用管理办法》规定的临床抗菌药物使用率不高于60%的合理性。
目前,本院的鲍曼不动杆菌检出率与全国医院监控网所提供的比例相似[4]。临床治疗鲍曼不动杆菌的主要药物是三、四代头孢菌素,氨基糖苷类和氟喹诺酮类药物[5]。下面根据其耐药率与上述三类药物使用情况的相关性进行逐一探讨。
3.1 鲍曼不动杆菌的耐药率与β-内酰胺类药物AUD呈正相关。随着该类药物的广泛使用,逐渐诱导该细菌产生β-内酰胺酶,包括超广谱β-内酰胺酶类(ESBLs)、金属酶类、AmpC酶和OXA型酶,是其耐药的最主要原因。该菌主要通过质粒介导或染色体突变诱导产生β-内酰胺酶,破坏该类药物内酰胺结构,使抗菌药物丧失活性。ESBLs是细菌质粒介导产生能水解甲氧亚氨基β-内酰胺类抗菌药物,如头孢他啶、氨曲南等。TEM型ESBLs有70余种,其中TEM-1是革兰阴性菌中最常见的β-内酰胺酶,TEM-2的基因介导对β-内酰胺类耐药[6]。TEM-1、TEM-2在鲍曼不动杆菌的广泛存在,是其对β-内酰胺类耐药的主要机制。有研究显示30%的鲍曼不动杆菌携带由质粒突变酶[7]。AmpC酶主要由头霉素、碳青霉烯和β-内酰胺酶抑制剂诱导产生,如2011年第三季度这三类药物总AUD为29.63,占β-内酰胺类药物AUD(85.81)的34.53%,而且该季度耐药率也较高,显示头霉素的广泛使用也是造成鲍曼不动杆菌耐药率升高的原因之一[8]。按照Albmer分子分类将碳青霉烯酶分为A、B、D三类,其中D类仅见于不动杆菌,B类为金属酶,见于铜绿假单胞菌、不动杆菌和肠杆菌属,所以临床上广泛使用抗铜绿假单胞菌和肠杆菌均可诱导鲍曼不动杆菌耐药。
3.2 氟喹诺酮类药物使用也诱导鲍曼不动杆菌耐药产生。包括两种机制:(1)DNA拓扑异构酶突变;(2)外膜通透性改变和主动流出泵外排系统。其中染色体基因突变是不动杆菌对氟喹诺酮耐药的主要机制[9]。有研究表明,鲍曼不动杆菌决定细胞内药物吸收量和药物主动排出系统的基因突变,导致外膜蛋白表达量降低,可刺激细菌主动排除药物,降低药效[10]。
3.3 未见氨基糖苷类药物与鲍曼不动杆菌耐药的相关关系,这主要由于氨基糖苷类药物使用量很低,不如其他类药物对不动杆菌耐药率产生影响明显。但仍然可以显示出正相关的趋势。在临床中,尽管氨基糖苷类的副作用限制其广泛使用,也正因为如此,才保证在和内酰胺类药物协同作用中,不动杆菌对其有较高的敏感性。
综上所述,鲍曼不动杆菌的耐药情况与抗菌药物使用率、总AUD、氟喹诺酮类和β-内酰胺类药物的AUD呈正相关,与氨基糖苷类药物无明显相关性。鲍曼不动杆菌对临床常用的抗菌药物均有不同程度的耐药情况,其机制主要涉及灭活酶的产生,基因突变致靶位、结合部位、膜通透性的改变和主动外排系统功能的增强,同时由质粒和基因共同转导,使得该菌耐药性可以很快地在菌属之间传播,给临床治疗带来困难。只有严格规范临床使用抗菌药物,合理选药,减少用药的广度和强度,才能有效延缓细菌耐药性的产生。
1 习慧明,徐英春,朱德妹,等.2010年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2012,12(2):98-104.
2 叶应妩,王毓三.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006.
3 卫生部.抗菌药物临床应用监测网药品字典及DDD值[Z].2011.
4 张世阳,连羡玉,金继红,等.Cox-Staurt趋势检验分析医院感染鲍曼不动杆菌耐药趋势[J].中国全科医学,2012,15(4):450-453.
5 卫生部.抗菌药物临床应用管理办法[Z].卫生部令第84号,2012.
6 Segal H,Nelson EC,Elisha BG.Genetic environment and transcription of ampC in an Acinetobacter baumannii clinical isolate[J].Antimicrob Agents Chemother,2004,48(2):612-614.
7 吴显劲,袁汉尧,戴湘春,等.98例鲍曼不动杆菌的β-内酰胺酶的检测及耐药分析[J].中国热带医学,2007,7(3):405-406.
8 Devaud M,Kayser FH,Bachi B.Transposon-mediated multiple antibiotic-resistance in Acinetobacter strains[J].Antimicrob Agents Chemother,1982,22(2):323-329.
9 En LL,Mitscher LA,Sharma PN,et al.Mechanism of inhibiiton of DNA gyrase by quinolone antibacterials:A cooperative drug DNA binding model [J].Biochemistry,1989,28 (9):3886-3889.
10 糜祖煌,秦玲.多药耐药鲍氏不动杆菌5类抗菌药物机制研究[J].中华医院感染学杂志,2008,18(7):761-764.
