类风湿关节炎合并肺间质病变的临床特点及与白介素33及其受体人基质裂解素2的相关性研究
2013-04-20张丹丹董争争
王 燕,冯 欣,高 薇,张丹丹,董争争
类风湿关节炎(rheumatoid arthritis,RA)是以对称性多关节炎为主要临床表现的异质性、系统性、自身免疫性疾病,可反复迁延多年,最终导致关节畸变及功能丧失。然而,RA病变并非只局限于关节,也呈现关节外的系统性多脏器受累,产生一系列病理生理变化,其中侵犯肺致肺间质病变(interstitial lung disease,ILD)是其中严重的临床类型之一。因其累及肺脏早期无明显的临床症状及体征常不能及时诊断[1],到晚期出现ILD预后极差且不可逆[2-3],相当一部分患者因呼吸衰竭而死亡。所以对类风湿关节炎合并肺间质病变(RA-ILD)患者早期发现早期干预意义重大[4],本研究对RA-ILD的临床特点及与血清白介素33(interleukin-33,IL-33)及其受体人基质裂解素2(human stromelysin-2,ST2)的相关性进行探讨,现报道如下。
1 资料与方法
1.1一般资料收集2012年3—7月在辽宁医学院第一附属医院风湿免疫科门诊及病房就诊初诊为RA患者114人,其中RA-ILD患者21例,均以肺部高分辨率CT(HRCT)确诊[5-6];男4例,女17例;年龄44~77岁,平均年龄为(61±11)岁;病程16周~30年,平均病程(10±6)年。未出现ILD的RA患者93例,其中男13例,女80例;年龄23~74岁,平均年龄为(48±10)岁;病程8周~20年,平均病程(5±4)年。RA患者均符合1987年美国风湿病学会(ACR)的分类诊断标准[7]。RA-ILD患者的诊断参照2000年美国胸科协会/欧洲呼吸协会(ATS/ERS)提出的特发性肺间质纤维化(IPF)的临床诊断标准[8]。同时选取30例健康志愿者为对照组,均为我院体检中心健康体检者;男11例,女19例;年龄21~60岁,平均年龄为(47±6)岁。严格遵循赫尔辛基宣言中人体医学研究的伦理准则,所选患者自愿签署知情同意书,有以下情况者除外:曾患肺结核或有结核感染者、支气管扩张、支气管哮喘、慢性支气管炎、肺气肿、肺源性心脏病、结节病、肺部肿瘤患者等呼吸系统疾病者;慢性心、肝、肾功能不全者以及其他结缔组织病患者;妊娠及准备妊娠者,精神病患者,急性感染、栓塞、控制不良的糖尿病、消化性溃疡、严重骨质疏松患者,长期吸烟者。
1.2研究方法
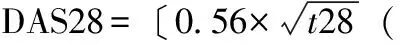
1.2.2血清细胞因子测定所有参加试验者均清晨空腹抽血5 ml,离心半径13.5 cm,3 000 r/min离心5 min分离血清后置于-20 ℃冰箱冻存,酶联免疫吸附实验(ELISA)法测定血清细胞因子IL-33及ST2,测定方法按照试剂盒内说明进行,如下:(1)准备试剂,样品和标准品;(2)加入准备好的样品和标准品,生物素标记二抗和酶标试剂,37 ℃反应60 min;(3)洗板5次,加入显色液A、B,37 ℃显色10 min;(4)加终止液;(5)使用酶标仪(450 nm)检测OD值,建立标准曲线,根据标准曲线计算样本IL-33及ST2浓度。正常血清标本IL-33浓度预期平均值为5~2 000 ng/L;ST2的浓度预期平均值为20~6 000 ng/L。
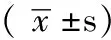
2 结果
2.1一般情况及实验室检查结果RA-ILD在RA患者中的发生率为18.4%(21/114),两组患者平均年龄、病程、晨僵时间、压痛关节数、肿胀关节数、关节功能分级、手X线分期差异均有统计学意义(P<0.01,见表1)。主要实验室检查指标两组相比,CRP、ERS、RF、ACPA、DAS28评分差异有统计学意义(P<0.05),而IgG、IgA、IgM差异无统计学意义(P>0.05,见表2)。RA-ILD患者中16例出现呼吸系统症状,主要呼吸系统表现有咳嗽(13例)、咳痰(6例)、胸闷(8例)、气短(9例)、胸痛(5例)、Velcro啰音(8例)、活动后呼吸困难(7例)。
2.2肺功能检查及动脉血气分析由于考虑到具体患者年龄、体质量、身高等的差异,统计中所采用的数据是实际值与预计值的比值,以百分比的形式表示。肺功能检查显示,两组患者VC、FVC、MMF和DLCO间差异均有统计学意义(P<0.01,见表3)。RA-ILD患者主要表现为弥散功能下降(17/21)、限制性通气障碍(13/21)、气道功能受损(9/21)、混合性肺功能障碍(4/21)。动脉血气分析显示,两组患者pH和PaCO2间差异无统计学意义(P>0.05),而PaO2间差异有统计学意义(P<0.01,见表3)。
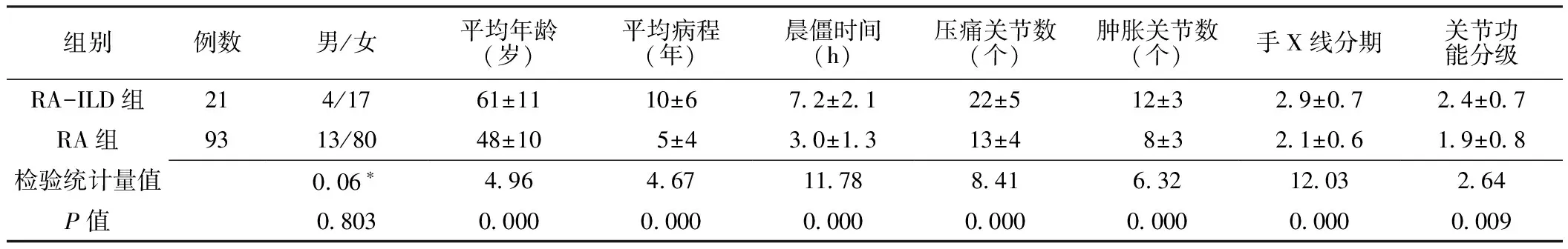
表1 两组患者一般情况比较
注:*为χ2值,余检验统计量值为t值;RA=类风湿关节炎,RA-ILD=类风湿关节炎合并肺间质病变
表2 两组患者实验室检查指标比较
注:ESR=红细胞沉降率,CRP=C-反应蛋白,RF=类风湿因子,ACPA=抗环瓜氨酸多肽抗体,Ig=免疫球蛋白,DAS28=疾病活动度评分
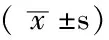
表3 两组患者肺功能及血气分析结果比较
注:VC=肺活量,FVC=用力肺活量,FEV1=第1秒呼气容积,MMF=最大呼气中段流量,DLCO=一氧化碳弥散量,PaO2=动脉血氧分压,PaCO2=动脉血二氧化碳分压
2.3肺部HRCT表现RA-ILD患者肺部损害HRCT表现主要有磨玻璃影(6例)、小叶间隔增厚(11例)、小叶内间质增厚(5例)、叶间胸膜肥厚(7例)、血管支气管壁增厚(7例)、肺实质带(2例)、马赛克征(6例)、小结节影(5例)、肺气肿(2例)、斑片状阴影(4例)、蜂窝样改变(3例)、肺动脉高压(2例)、胸膜病变(8例),病变多分布于双肺中、下野,晚期有广泛肺纤维化。
2.4血清细胞因子变化3组血清IL-33及ST2水平间差异均有统计学意义(P<0.01),两两间差异亦有统计学意义(P<0.01,见表4)。相关性分析显示,IL-33水平与RF、ACPA滴度呈正相关(r值分别为0.817、0.550,P<0.01,见图1、2);与DLCO水平呈负相关(r=-0.801,P<0.01,见图3),与ESR、CRP、DAS28等活动性指标无相关性。

表4 3组血清IL-33及ST2水平比较
注:IL-33=白介素33;ST2=人基质裂解素2
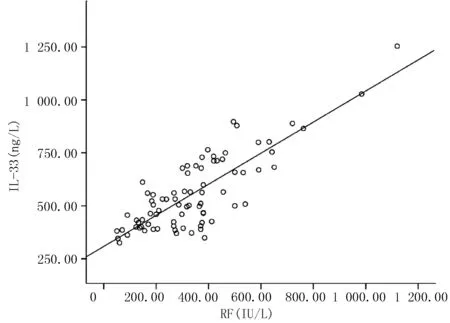
图1 血清IL-33与RF相关性分析

图2 血清IL-33与ACPA相关性分析
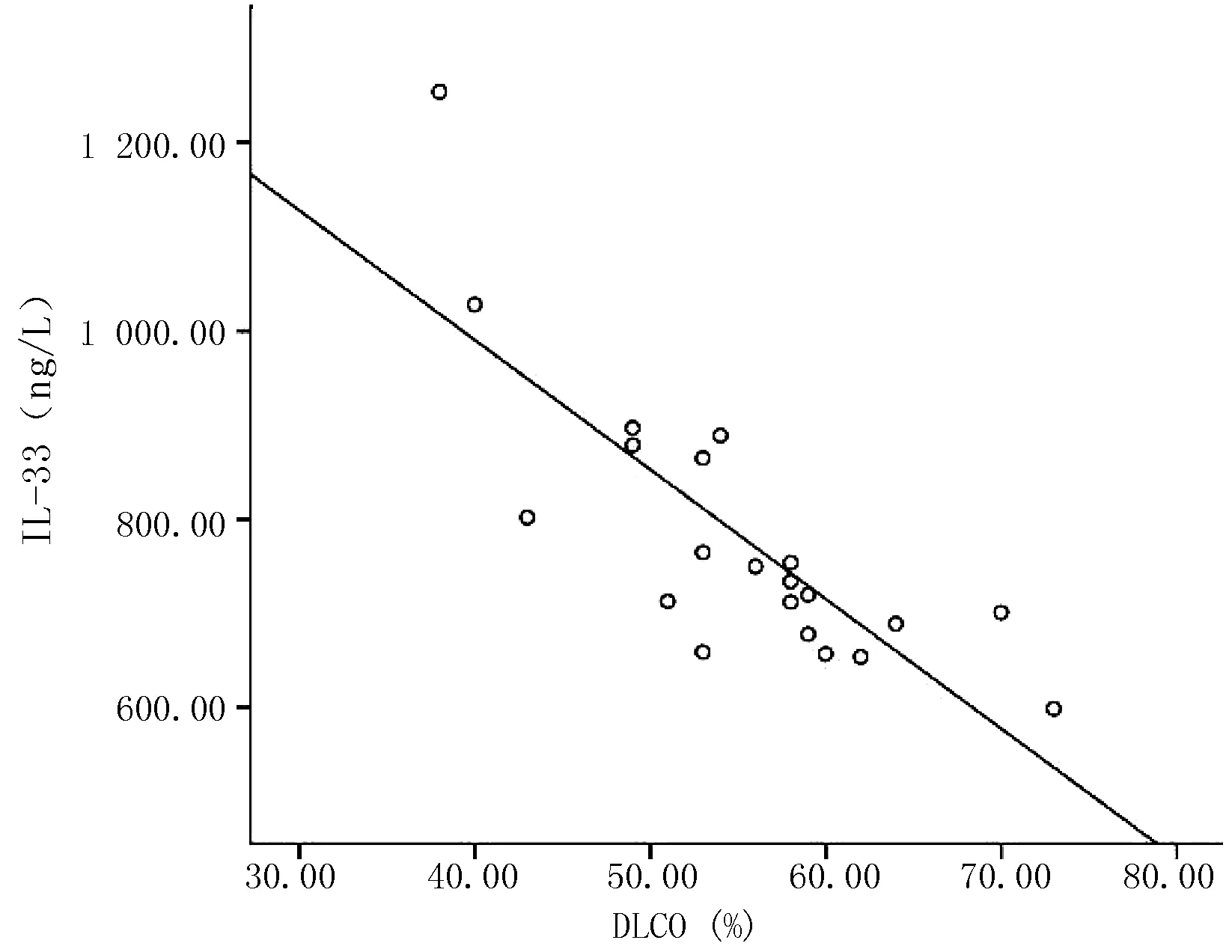
图3 血清IL-33与DLCO相关性分析
3 讨论
本研究显示RA-ILD易发生于年龄偏大、病程较长、关节功能评价及手X线分期较差的RA患者;RA-ILD组DAS28评分及ACPA较RA组升高,表明RA患者发生ILD很大程度上与RA疾病活动度相关,疾病活动度越高者越易出现ILD。另外RA-ILD患者可出现明显的低氧血症及肺功能损害,本研究患者中有弥散功能者下降者占80%以上,主要由肺间质纤维组织增生弥散距离增加所致。限制性通气功能障碍者占60%以上,由肺顺应性降低、肺活量和肺总量减少引起。有些患者无呼吸道症状而肺功能已经表现异常,提示RA-ILD患者肺功能异常早于临床症状出现,有助于早期ILD的发现。而本研究所做的ELISA法测定IL-33水平发现,RA、RA-ILD组均高于对照组,且RA-ILD组高于RA 组。提示IL-33可能对RA的发病机制有重要作用,且可能与RA-ILD发病相关;本研究同时发现IL-33水平与 RF、ACPA水平及肺功能指标具有相关性,由于RF和ACPA是RA的诊断和判断预后的重要指标,这提示IL-33水平增高可能是RA预后不良的标志,所以临床工作的医务工作者注重对患者的一般状况、疾病活动度及实验室检查的综合性分析评估,对早期发现早期预防RA-ILD意义重大。
RA-ILD发生率较高,且早期无明显临床症状及体征及易漏诊,晚期预后极差[9],逐渐成为近年来RA患者死亡的重要原因,因此寻找特异灵敏的诊断指标早期发现及治疗RA-ILD越来越受到人们的关注。RA基本病理改变为滑膜炎,但其发病机制目前尚不清楚,研究表明,炎性细胞因子如肿瘤坏死因子-α(TNF-α)、白介素1(IL-1)、白介素15(IL-15)、白介素18(IL-18)、白介素6(IL-6)、白介素12(IL-12)和白介素17(IL-17)等在RA滑膜病变中起核心作用,被认为是介导RA发生发展、造成滑膜损害和组织破坏的主要因素[10]。ILD的发病机制尚未完全阐明,根据免疫效应细胞的比例不同,可将ILD的肺间质和肺泡炎分为中性细胞型肺泡炎和淋巴细胞型肺泡炎[11],肺泡巨噬细胞等炎性细胞可释放TNF-α、血小板衍生生长因子等细胞因子,均对肺纤维化的形成产生作用,最后导致广泛肺纤维化,研究证明炎性细胞、免疫细胞、肺泡上皮细胞和成纤维细胞及其分泌的间质和细胞因子,在引起肺间质纤维化的发病上起重要作用。RA所致的间质相关性肺疾病发病机制亦成为近年来的研究热点,其中以细胞因子的研究为著,如IL-1、白介素8(IL-8)、转化生长因子-β1(TGF-βl)、TNF-α、胰岛素样生长因子-α(IGF-α)[12],而细胞因子IL-33是Schmitz等[13]在2005年发现的IL-1家族中的细胞因子,随后又发现其特异性受体为ST2。有研究发现,IL-33能使肥大细胞表达IL-1、IL-6、IL-13 等炎性因子[14-15],在RA的发病过程中,滑膜肥大细胞能够被抗关节自身抗体免疫复合物所激活,诱发超敏反应,分泌出TNF-α、IL-1等一系列效应因子,介导炎症、渗出、趋化以及组织损伤过程,从而起到重要的调控作用。人们并不清楚体内IL-33的表达,目前研究证实IL-33表达同时存在于巨噬细胞、肥大细胞[15-16]、树突状细胞、皮肤角质细胞、上皮细胞等中[17]。也有研究证明IL-33在小鼠的胃、肺脏、脊髓、脑、皮肤有高表达,而在淋巴组织、脾脏、胰腺、肾脏和心脏中也有低表达,IL-33和其受体ST2发挥作用的方式应该是调节免疫应答,影响炎性反应。哮喘患者的血清IL-33表达升高,IL-33与ILD的发病机制相关性罕见报道;对于膜型ST2 表达的细胞类型的研究仅限于变态反应和自身免疫相关的免疫细胞和炎性细胞,在肺脏等器官中的作用罕见研究。本研究适用于RA尤其早期合并ILD便于早期发现早期干预,预后良好。而本研究的局限性为病例数少可能存在有偏倚及误差,且血清细胞因子检查费用高,短期内得不到普及。但目前提倡对 RA-ILD 的早期诊断和早期强化治疗,深入了解IL-33在RA和RA-ILD的作用机制对RA、RA-ILD的早期发现及早期预防可能有重要的意义;为寻找并干预调控靶点研究带来新的突破,为RA-ILD细胞因子靶向治疗变成现实奠定了基础。
1邓琳,唐友国,朱红斌,等.类风湿关节炎患者特异性标记物与肺间质病变的关系[J].中国全科医学,2010,13(10):3364.
2Brown KK.Rheumatoid lung disease[J].Proc Am Torac Soc,2007,4(5):443-448.
3闫慧明,王永福.不同年龄类风湿关节炎患者临床特征分析[J].中国全科医学,2012,15(7):2259.
4Leslie KO,Trahan S,Gruden J.Pulmonary pathology of the rheumatic diseases [J].Semin Respir Crit Care Med,2007,28(4):369-378.
5Mayberry JP,Primack SL,Muller NL.Thoracic manifestations of systemic autoimmune diseases:Radiographic and high-resolution CT findings[J].Radiographics,2000,20(6):1623-1635.
6Daimon T,Johkoh T,Honda O,et al.Nonspecific interstitial pneumonia associated with collagen vascular disease:Analysis of CT features to distinguish the various types[J].Intern Med,2009,48(10):753-761.
7Arnelt FC,Edworth SM,Bloch DA,et al.The american rheumatism association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31(3):315-324.
8Demedts M,Costabel U.ATS/ERS international multidisciplinary consensus classification of the idiopathic international pneumonias[J].Eur Respir J,2002,19(5):794-796.
9Koduri G,Norton S,Young A,et al.Interstitial lung disease has a poor prognosis in rheumatoid arthritis:Results from an inception cohort[J].Rheumatology,2010,49(8):1483-1489.
10髙薇,鲁静.炎性细胞因子与类风湿关节炎[J].中国现代医学杂志,2007,17(14):450-457.
11陆再英,钟南山,谢毅,等.内科学[M].7版.北京:人民卫生出版社,2008:98-109.
12Jian XD,Guo GR,Ruan YJ,et al.Clinical observation of rheumatoid arthritis associated interstitial lung disease patients and changes of serum cytokines thereof[J].Zhonghua Yi Xue Za Zhi,2008,88(27):1884-1887.
13Schmitz J,Owyang A,Oldham E,et al.IL-33,an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2 associated cytokines [J].Immunity,2005,23(5):479-490.
14Allakhverdi Z,Smith DE,Comeau MR,et al.Cutting edge:The ST2 ligand IL-33 potently activates and drives maturation of human mast cells[J].Immunol,2007,179(4):2051-2054.
15Verri WA Jr,Souto FO,Vieira SM,et al.IL-33 induces neutrophil migration in rheumatoid arthritis and is a target of anti-TNF therapy[J].Ann Rheum Dis,2010,69(9):1697-1703.
16Moussion C,Ortega N,Girard JP.The IL-1-like cytokine IL-33 is constitutively expressed in the nucleus of endothelial cells and epithelial cells in vivo:A novel ′alarmin′?[J].PLoS One,2008,3(10):e3331.
17Ku chler AM,Pollheimer J,Balogh J,et al.Nuclear interleukin-33 is generally expressed in resting endothelium but rapidly lost upon angiogenic or proinflammatory activation[J].Am J Pathol,2008,173(4):1229-1242.
