2型糖尿病的相关影响因素及铁营养与氧化应激水平的相关性研究
2013-04-20张惠英杜雪雪
张惠英,李 瑞,杜雪雪
糖尿病是受免疫、遗传和环境等多种因素共同作用的代谢性疾病[1]。由于代谢紊乱和血糖增高,可直接或间接导致微量元素铁代谢异常,微量元素铁又参与胰岛素的合成、分泌、贮存、活性以及能量代谢过程,其异常会影响胰岛素的合成与分泌等,从而促进糖尿病的发生与发展[2-3]。氧化应激是指机体在遭受各种有害刺激时,体内高活性分子,如活性氧自由基和活性氮自由基(RNS)产生过多,其氧化程度超出氧化物的清除速度,氧化系统和抗氧化系统失衡,从而导致组织损伤。
有学者认为,铁是一把“双刃剑”,一方面,当铁缺乏时,可以减少一些含铁的抗氧化酶〔如过氧化氢酶(CAT)〕的合成,从而降低了体内抗氧化能力;另一方面,当体内铁负荷时,微量元素铁也可能通过参与氧化反应从而对机体造成损伤[4-5]。本研究主要探讨2型糖尿病患者铁营养状况与氧化应激水平的相关性,分析影响2型糖尿病的相关因素,为2型糖尿病的防治提供参考。
1 资料与方法
1.1一般资料2010年3—7月收集在宁夏自治区两所二级甲等以上医院(中国人民解放军第五医院和中卫市人民医院)住院且确诊的2型糖尿病患者182例为病例组,按照1999年糖尿病诊断标准,按是否合并并发症分为单纯组88例和并发症组94例,同时收集在这两所医院进行健康体检正常者87例为对照组。3组受检者的年龄、性别、学历及职业间差异无统计学意义(P>0.05,见表1),具有可比性。
1.2方法
1.2.1血样采集晨起取空腹血5 ml,离心后,取血清于-80 ℃低温冰箱保存待测。
1.2.2体内铁营养指标血清铁(SI)采用ICP-OES法。血清铁蛋白(SF)、可溶性转铁蛋白受体(sTfR)均采用ELISA法,美国R&D System公司试剂盒。
1.2.3氧化应激指标包括丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和CAT。以上指标测定所用试剂盒均来自南京建成生物研究所,其实验室操作步骤均按照试剂盒说明书操作。
1.2.4实验仪器722分光光度计、Varian710-ES电感耦合等离子体发射光谱仪、北京普朗新技术有限公司酶标工作站(DNM-9602G型酶标分析仪和DNX-9620A型电脑洗板机)、石墨炉、高速离心机、旋涡混匀器和微型振荡器等仪器。


表1 3组受检者一般资料比较
注:*为F值
2 结果
2.1体内铁营养状况比较与对照组比较,单纯组和并发症组的SI、SF水平均升高,且差异有统计学意义(P<0.05);而sTfR水平均降低,且差异有统计学意义(P<0.01,见表2)。
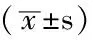
Table2 Comparison of the nutritional status of study object among three groups

组别例数SI(mg/L)SF(μg/L)∗sTfR(nmol/L)对照组873 41±3 34 2 31±0 32 29 68±14 59 单纯组884 76±3 94△2 44±0 34△21 08±11 55▲并发症组946 86±3 98△2 57±0 33▲16 63±11 82▲F值11 1436 7818 728P值0 0000 0010 000
注:*为几何均数值;SI=血清铁,SF=血清铁蛋白,sTfR=可溶性转铁蛋白受体;与对照组比较,△P<0.05,▲P<0.01
2.2氧化应激水平比较与对照组比较,单纯组和并发症组的MDA水平均升高,且差异有统计学意义(P<0.05);而SOD、CAT水平均降低,且差异有统计学意义(P<0.01);3组GSH-Px水平比较,差异无统计学意义(P>0.05,见表3)。
2.3体内SF水平与氧化应激水平的关系不同SF水平组中,MDA、CAT水平差异无统计学意义(P>0.05);SOD、GSH-Px水平差异有统计学意义(P<0.05,见表4)。
2.42型糖尿病相关因素的Logistic回归分析以2型糖尿病为因变量,年龄、性别、学历、MDA、SOD、CAT、SI及SF为自变量,进行Logistic回归分析。结果显示,年龄、性别、SI、SF、MDA、SOD及CAT进入回归方程(P<0.05,见表5)。
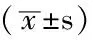
表3 3组受检者氧化应激水平的比较
注:MDA=丙二醛,SOD=超氧化物歧化酶,GSH-Px=谷胱甘肽过氧化物酶,CAT=过氧化氢酶;与对照组比较,△P<0.05,▲P<0.01
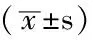
Table4Comparison of antioxidant level among groups with different serum protein content

例数SF(μg/L)∗MDA(μmol/L)SOD(U/ml)GSH-Px(U/L)CAT(U/ml)Q1组662 02±0 134 61±1 34107 62±30 06228 79±167 944 09±2 85Q2组692 29±0 074 88±1 31106 60±26 28244 93±180 234 47±3 44Q3组672 56±0 094 75±1 43106 87±29 57309 03±181 744 00±3 48Q4组672 91±0 154 71±1 21107 00±33 42277 54±172 644 22±3 86F值752 5200 4893 0813 0130 347P值0 0000 6690 0280 0310 791
注:*为几何均数值
表52型糖尿病相关因素的有序Logistic回归分析
Table5Logistic regression analysis on the relationship between T2DM and related factors
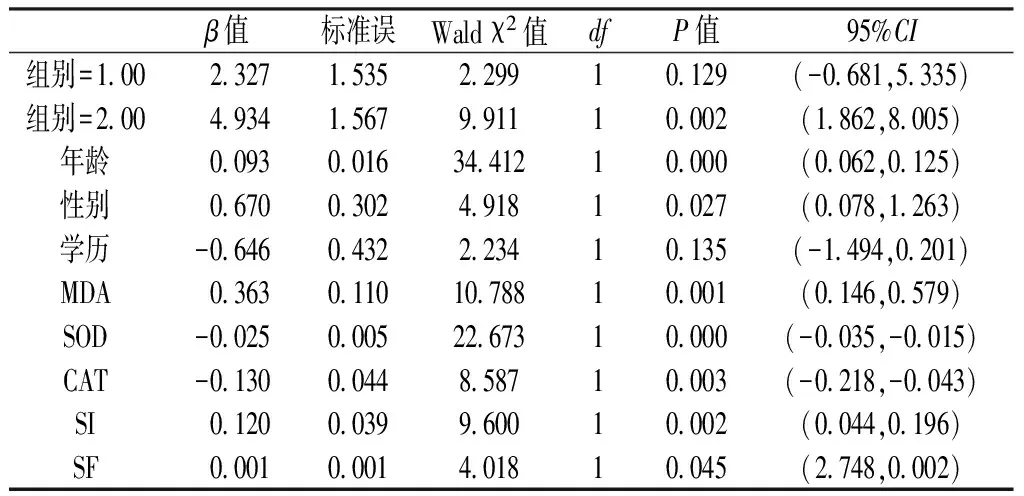
β值标准误Waldχ2值dfP值95%CI组别=1 002 3271 5352 29910 129(-0 681,5 335)组别=2 004 9341 5679 91110 002(1 862,8 005)年龄0 0930 01634 41210 000(0 062,0 125)性别0 6700 3024 91810 027(0 078,1 263)学历-0 6460 4322 23410 135(-1 494,0 201)MDA0 3630 11010 78810 001(0 146,0 579)SOD-0 0250 00522 67310 000(-0 035,-0 015)CAT-0 1300 0448 58710 003(-0 218,-0 043)SI0 1200 0399 60010 002(0 044,0 196)SF0 0010 0014 01810 045(2 748,0 002)
3 讨论
研究发现,2型糖尿病患者体内存在铁负荷[7-9]。SI主要反映血液中铁水平,SF主要反映体内铁储存的情况,sTfR是转铁蛋白受体分解的片段,主要用来衡量体内铁代谢情况,而sTfR的水平随着体内SF的活跃而减少[9]。体内铁代谢越旺盛,则血清sTfR的水平就越低。李剑虹等[6]研究表明,sTfR可用于判定体内铁过量。本研究结果显示,对照组体内的SI和SF水平降低,单纯组和并发症组则升高;对照组sTfR水平升高,单纯组和并发症组则降低,sTfR在单纯组和并发症组差异有显著性,且均低于对照组,进一步说明糖尿病患者体内铁代谢较活跃。
2型糖尿病是一个多因素导致的慢性代谢性疾病,是以高血糖为特征的代谢紊乱,体内氧化应激同样存在紊乱[10-11]。MDA是细胞膜脂质过氧化的终产物之一,其水平可间接估计脂质过氧化的程度。2型糖尿病患者高血糖状态会引起葡萄糖氧化过程中氧化应激增强,脂质过氧化产物MDA增多。本研究结果显示,2型糖尿病患者体内脂质过氧化水平较正常组增加,说明2型糖尿病患者体内氧化应激水平增高,与常东等[11-12]研究结果一致。在不同SF水平组中,SOD、CAT水平有明显差异,而且对照组升高,并发症组降低。这与单春燕等[10-12]研究结果一致。本研究结果表明,2型糖尿病患者体内氧化应激水平增高、抗氧化能力减弱。
本研究中,不同SF水平组的SOD、GSH-Px的水平有明显差异,其余几个指标无明显差别。这可能与SOD能够特异性地清除体内游离的二价铁,通过发生Fenton反应产生更具细胞毒性的羟基(-OH)或氧自由基有关。据估计,50%以上的自由基造成的分子损伤由-OH造成[13]。铁与巯基结合有很强的催化作用,也能产生活性很强的-OH和其他氧化剂[14-15]。另外,活性铁是脂质过氧化的催化剂,能使脂质过氧化反应所产生的脂烷基和脂烷过氧基再度作用于脂质,使反应以链式不断进行,进而加重反应造成的损害[16]。铁络合剂去铁胺、转SF能制止或减缓铁参与脂质过氧化反应[17]。不同的SF水平组中,游离的二价铁离子将增多,这也可能加剧了SOD活性的减少。GSH-Px主要的作用亦是清除过氧化物等氧化剂,铁的增多也助于氧化剂的产生,从而降低了GSH-Px的活性[18]。这进一步说明,体内铁营养状况与抗氧化酶的活性有一定关系。
在对不同病例组中2型糖尿病相关因素的有序Logistic回归分析中,发现不同病例组中,年龄、性别、SI、SF及MDA水平对2型糖尿病起促进作用;SOD、CAT水平对2型糖尿病起保护作用。由此可知,年龄、性别、SI、SF以及MDA是2型糖尿病的危险因素;而SOD、CAT是2型糖尿病的保护因素,这与付正菊等[8-10]的研究相似。
综上所述,2型糖尿病患者体内存在铁负荷情况,并同时存在铁代谢紊乱,铁负荷是2型糖尿病的一个危险因素。2型糖尿病患者体内氧化应激水平增高、抗氧化能力减弱。不同SF水平组,氧化应激水平有所改变。因此可以认为,2型糖尿病患者体内铁负荷与氧化损伤同时存在,铁与氧化应激水平可能存在一定的关联,并将作为后续研究内容。
1卫生部疾病控制司、中华医学会糖尿病学分会.中国糖尿病防治指南(试行本)[J].中国慢性病预防与控制,2004,12(6):283-285.
2冯婷,杨波,张祥迅,等.铁超负荷对胰岛β细胞分泌胰岛素功能的影响[J].四川医学,2007,28(12):1341-1343.
3Brewer GJ.Risks of copper and iron toxicity during aging in humans[J].Chem Res Toxicol,2010,23(2):319-326.
4孙燕,朱本章.微量元素与糖尿病氧化应激[J].国外医学:医学地理分册,2005,25(4):159-161.
5冯烨,李成江.铁代谢与糖尿病的关系[J].浙江医学,2008,30(6):662-663,666.
6李剑虹,朴建华,杨晓光.转铁蛋白受体评估铁过量状况最佳临界值的研究[J].营养学报,2007,29(5):431-434.
7Sun L,Franco OH,Hu FB,et al.Ferritin concentrations,metabolic syndrome,and type 2 diabetes in middle-aged and elderly chinese[J].J Clin Endocrinol Metab,2008,93(12):4690-4696.
8付正菊,刘敏,汪之顼,等.2型糖尿病与铁营养状况相关性研究[J].中国糖尿病杂志,2008,16(8):493-494.
9孙雪松,何庆瑜.含铁蛋白介导的铁转运分子机制[J].化学进展,2007,19(12):1987-1990.
10单春艳,郑少雄,陈莉明,等.2型糖尿病患者血清氧化应激指标水平的改变[J].实用糖尿病杂志,2006,2(2):14-17.
11常东,潘洪志,许风娟,等.糖尿病及其视网膜病变患者抗氧化酶及氧化应激产物的变化[J].哈尔滨医科大学学报,2008,42(5):475-478.
12贾文波,许继取,宋方方,等.2型糖尿病患者胰岛素抵抗和氧化应激反应[J].中国公共卫生,2006,22(7):769-771.
13Fumeron F,Pean F,Driss F,et al.Ferritin and transferrin are both predictive of the onset of hyperglycemia in men and women over 3 years:the data from an epidemiological study on the Insulin Resistance Syndrome(DESIR)study[J].Diabetes Care,2006,29(9):2090-2094.
14Halliwell B.Oxidants and the central nervous system:some fundamental questions.Is oxidant damage relevant to Parkinson′s disease,Alzheimer′s disease,traumatic injury or stroke? [J].Acta Neurol Scand Suppl,1989(126):23-33.
15雷海燕,顾萍,邵加庆,等.血清铁蛋白与2型糖尿病及其相关危险因素的关系[J].中国全科医学,2010,13(1):36.
16刘冯,莫东华,刘智屏,等.可溶性转铁蛋白受体在急性溶血性贫血诊断中的意义[J].中国全科医学,2010,13(5):1528.
17韦安阳,周春兰.微量元素铜、铁、锰、锗与自由基[J].广东微量元素科学,2001,8(6):15-16.
18Van Campenhout A,Van Campenhout C,Lagrou AR,et al.Impact of diabetes mellitus on the relationships between iron-,inflammatory- and oxidative stress status[J].Diabetes Metab Res Rev,2006,22(6):444-454.
