模拟肽 L-4F 对动脉粥样硬化小鼠的保护作用及机制*
2013-04-20应如袁勇秦亚飞冯力田迪郭志刚李明星
应如,袁勇,秦亚飞,冯力,田迪,郭志刚,李明星
·基础与实验研究·
模拟肽 L-4F 对动脉粥样硬化小鼠的保护作用及机制*
应如,袁勇,秦亚飞,冯力,田迪,郭志刚,李明星
目的:观察载脂蛋白 A-1(Apo A-1)模拟肽 L-4F(L-4F)与辛伐他汀比较对载脂蛋白 E 基因敲除 (Apo E-/-) 小鼠动脉粥样硬化及胆固醇流出率的影响,并探讨其可能的机制。
动脉粥样硬化;胆固醇流出率;载脂蛋白 A-1 模拟肽;高密度脂蛋白
(Chinese Circulation Journal, 2013,28: 379.)
动脉粥样硬化所致缺血性心血管疾病是中老年人群发病和死亡的常见原因。他汀类药物有效防治动脉粥样硬化的作用,已在临床广泛使用。尽管他汀类药物能有效降低低密度脂蛋白胆固醇(LDL-C),却仅能减少三分之一的冠状动脉(冠脉 )事件发生[1]。因此,寻找其他有效的抗动脉粥样硬化药物势在必行。研究发现,高密度脂蛋白胆固醇 (HDL-C)水平与动脉粥样硬化的发生发展呈 负 相 关, 具 有 心 血 管 保 护 功 能[2]。 然 而, 疾 病状态如急性冠脉综合征患者高密度脂蛋白(HDL)中炎 性 蛋白 的增 加导 致 HDL 变 为失 功能[3]。载 脂蛋白 A-1(ApoA-1)是 HDL 的主要成分,在 HDL抗动脉粥样硬化过程中发挥重要作用,包括促进胆固醇流出[4]、抗炎抗氧化[4,5]和改善血管舒缩功能[6]等,其中促进胆固醇流出在抗动脉粥样硬化过程中发挥关键作用。肝脏是胆固醇代谢的主要部位,三磷酸腺苷结合盒转运蛋白 A1(ATP binding cassette transporter A1, ABCA1)、B 族 I 型 清 道 夫受体(Scavenger receptor class B type I , SR-BI)和三磷酸腺苷结合盒转运蛋白 G1(ATP binding cassette transporter G1, ABCG1)是胆固醇流出的 3 种主要调节蛋白。
ApoA-1 模拟肽 具有和 ApoA-1 相 似的功 能,L-4F 是 一 种 高 生 物 活 性 的 ApoA-1 模 拟 肽[7], 能够促进胆固醇流出。然而,与他汀类药物相比,模拟肽 L-4F(L-4F)对动脉粥样硬化及胆固醇流出的影响国内外鲜有研究。因此,本实验研究 L-4F 及辛伐他汀对动脉粥样硬化及胆固醇流出率的影响,进行比较,并观察它们对肝脏 ABCA1、SR-BI及ABCG1 表达的影响,探讨 L-4F 及辛伐他汀抗动脉粥样硬化的机制。
1 材料与方法
主要试剂 : L-4F 由深圳瀚宇药物有限公司合成(氨基酸序列 DWFKAFYDKVAEKFK- EAF 为 18个氨基酸多肽),辛伐他汀(20 mg/片)购自默沙东制药有限公司(美国 );RAW264.7 细胞购自广州学友公司;3H- 胆固醇购自 PerkinElmer公司(美国 );8-Br- 环磷酸腺苷(cAMP)购自美国 Sigma 公司;反转录试剂盒购自TOYOBO生物有限公司(日本);荧光染料 SYBR@Premix Ex TagTMII购自日本 Takara公司;引物由 Invitrogen 公司(美国 )合成;ABCA1、SR-BI一抗为美国 Novus公司产品,ABCG1 一抗为英国 Abcam 公司产品。
实验模型的建立和干预:8 周龄健康雄性 Apo E-/-小鼠(购自南方医科大学实验中心 )以高脂饮食(0.15% 胆固醇,21%猪油)分笼饲养,并随机分为 3组,每组6只:①动脉粥样硬化组:单纯喂食高脂饮食;②辛伐他汀组:在高脂饲料喂养的基础上,予以每日灌服辛伐他汀 5 mg/(kg·d);③ L-4F 组:在高脂饲料喂养的基础上,予以腹腔注射 L-4F 1 mg/(kg·d)[8,9]。以上给药均在每日上午 9时,16周末麻醉各组小鼠,取各种标本。
血脂测定:小鼠空腹8小时状态下,乙醚麻醉后心脏采血,用自动生化仪测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇;用小鼠酶联免疫法(ELISA)试剂盒测定血清载脂蛋白A-1浓度。
[3H]胆 固 醇 流 出 率 的 测 定:将 RAW264.7 细胞置于 24 孔细胞培养板(细胞终浓度 2×105/ml),分别以 DMEM 培养液(含 2% 胎牛血清 )1 ml于37℃,5%CO2培养箱中静置培养,在培养液中分别加入 [3H]胆固醇(终浓度 1µCi/ml)及乙酰化低密度脂蛋白 (Ac-LDL,终浓度 50 µg/ml)促进细胞对胆固醇吸收,同时将 8- 环磷酸腺苷(cAMP,0.3 mmol/L)加入其中共同孵育 6 h。培养 24 h 后去除培养基,并以 DMEM 培养液洗涤2次后,再次加入 DMEM 培养液(含 2% 胎牛血清)培养 18 h 后弃培养液。洗涤细胞后,将含小鼠血清(2%)的培养基加入细胞,促进 [3H]胆固醇转出,其中设一对照孔加不含血清的培养基。4 h 后细胞用 PBS 平衡液洗涤并加入 1ml NaOH(0.1 mol/L)室温孵育 30 min。液闪计数仪检测细胞溶解物及细胞介质的 [3H]放射量。[3H]胆固醇转出率=(加血清培养液放射量 - 未加血清培养基放射量)/总 CPM×100%。
主动脉粥样斑块面积的计算:自主动脉根部至髂动脉分叉处分离小鼠主动脉,然后纵行剖开观察动脉内膜斑块形成情况,并用油红O染色显示动脉粥样硬化斑块,应用 Image-Pro Plus Version 6.0 专业图像分析软件进行分析。主动脉斑块面积以粥样斑块面积 (染为红色 )占血管内膜总面积的百分比表示。
反转录聚合酶链反应分析肝脏 3种 mRNA 的表达 : 分别取各组小鼠肝脏 100 g,液氮中研磨组织,按 TRIzol试剂盒说明书提取 RNA,分光光度计测定 RNA含量和纯度。按反转录试剂盒说明书将 RNA 反转录为 cDNA。用 SYBR@Green l嵌合荧光法在 AB7500 上进行 PCR 扩增。所有引物均参照 Gengbank 提供的序列。引物设计如下 :ABCA1 为5'-CTTCCCACATTTTTGCCTGG-3’(正义链)和 5’-AAGGTTCCGTCCTACCAAGTCC-3’(反义链 );SR-BI为 5'-GCAAATTTGGCCTGTTTGTT-3’(正义链 )和 5'-GATCTTGCTGAGTCCGTTCC-3’(反义链 );ABCG1 为5'-CGAGAGGGCATGTGTGACG-3’(正义链 )和5'- CCGAGAAGCTATGGCAACC-3(反义链 );β- 肌动蛋白为 5'-CAGATCATGTTTGAGACCTTCAAC-3’( 正义链)和 5'- TCGAAGTCTAGAGCAACATAGCAC-3’(反义链)。由电脑自动分析并计算Ct值。选用 β 肌动蛋白作为内参基因,采用 2-△(△Ct)法分析基因表达差异。
免疫印迹标记法分析肝脏3种蛋白的表达:分别取各组小鼠肝脏 100 g,液氮中研磨组织后,用RIPA 裂解液裂解组织,收集裂解的组织在 4℃下,12000 r /min 离心 5 min,BCA 蛋白浓度测定试剂盒进行蛋白质定量,用 5%十二烷基硫酸钠 -聚丙烯酰胺凝胶 (SDS-PAGE)进行电泳分离,转 PVDF 膜。封闭液常温封闭 1 h,加一抗 (ABCAl 1:500;SR-BI 1:1000;ABCG1 1:1000),4℃孵育过夜,TBST 缓冲液洗 3 次,加辣根过氧化物酶标记二抗 (1:15000),室温孵育 1 h,TBST 缓冲液洗 3 次,用凝胶成像分析系统显色并曝光显影。
统计学处理:Image J 软件分析 Western blot结果的灰度值。实验所得数据采用均数±标准差表示,用 SPSS 13.0 统计软件包进行处理;数值变量多组间比较采用单因素方差分析;两两间比较方差齐时采用 LSD-t 检验,方差不齐时采用 Dunnett’s T3 法检验;检验水准为双侧 α=0.05,P<0.05 表示差异有统计学意义。相关分析采用 Pearson 积矩相关分析。
2 结果
血脂水平变化:16 周末,辛伐他汀组与动脉粥样硬化组比较血清胆固醇、甘油三酯、低密度脂蛋白胆固醇水平明显降低,而高密度脂蛋白胆固醇水平明显升高,差异均有统计学意义(P<0.05~0.01);而 L-4F 组较动脉粥样硬化组的 ApoA-1 水平明显升高,差异有统计学意义(P<0.05)。(表1)
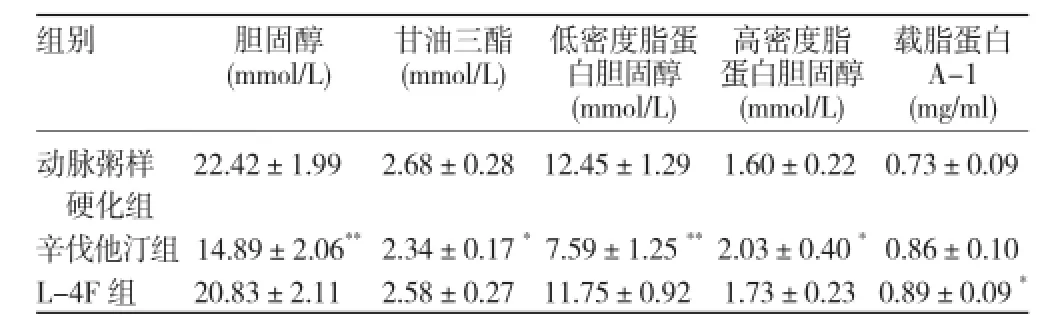
表1 16 周末小鼠血脂水平变化(n=6,±s)
胆固醇流出率:动脉粥样硬化组胆固醇流出率 为 (16.82±0.39)%, 辛 伐 他 汀 组 胆 固 醇 流 出 率为 (20.55±0.98)% , L-4F 组 干 预 后 胆 固 醇 流 出 率 为(22.47±1.16)%;L-4F 组与辛伐他汀组、动脉粥样硬化组比较胆固醇流出率均增高,差异均有统计学意义(P<0.001);而辛伐他汀组与动脉粥样硬化组相比胆固醇流出率也增高,差异也有统计学意义(P<0.001)。(图1)
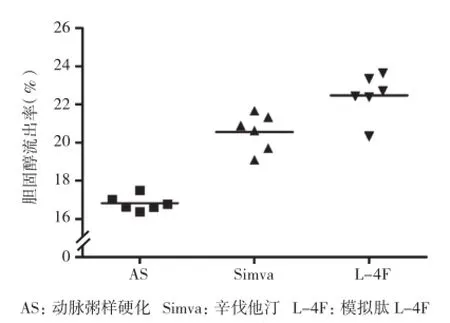
图1 胆固醇流出率 3 组结果比较
主动脉粥样斑块面积:与动脉粥样硬化 组(44.30±11.85)% 相 比, 辛 伐 他 汀 组(19.77±1.95)% 和 L-4F 组(22.58±6.88)% 的主动脉粥样斑块面积均明显减少(P<0.001),差异均有统计学意义。(图2)
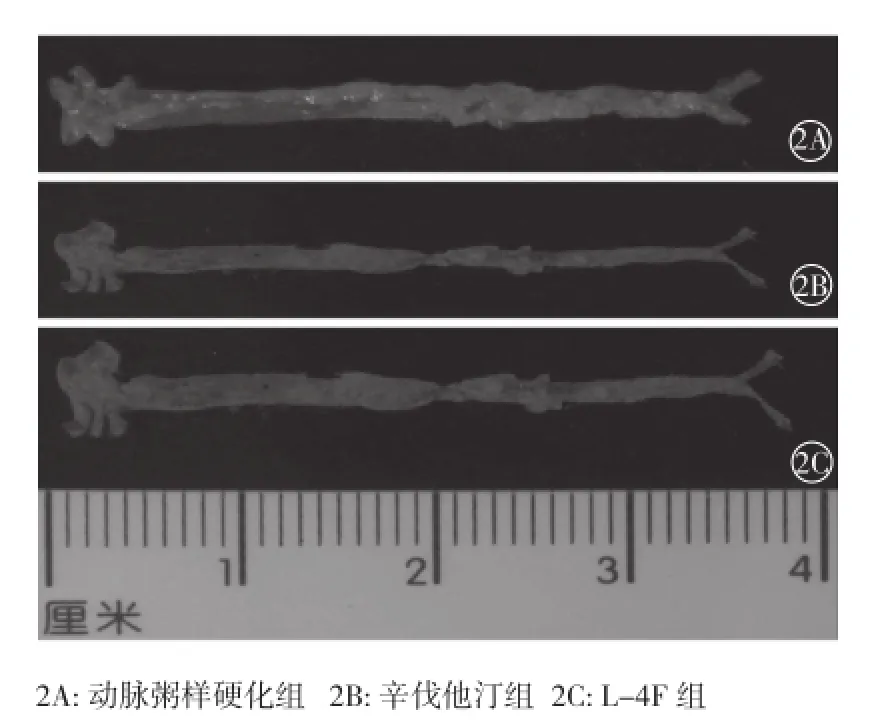
图2 经油红 O 染色观察的主动脉内膜粥样斑块面积
肝脏 3 种 mRNA 的表达:动脉粥样硬化组、L-4F组及辛伐他汀组肝脏均有 ABCA1、SR-BI、ABCG1 mRNA 表达,辛伐他汀组与动脉粥样硬化组相比,ABCA1 和 ABCG1 mRNA 表达明显增多,差异有统计学意义(P<0.001)。L-4F 组三种 mRNA 表达较动脉粥样硬化组均增多,差异有统计学意义(P<0.001)。(表2)
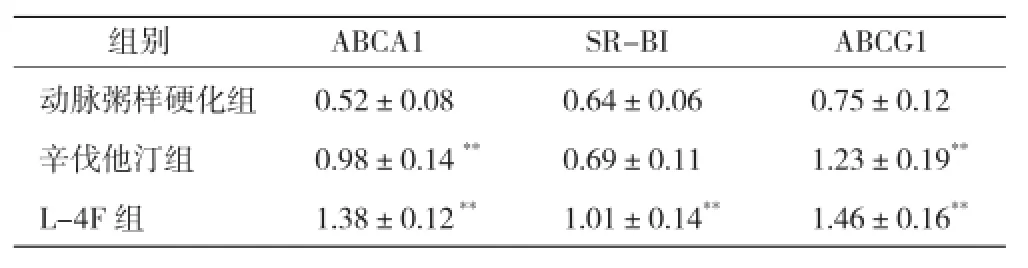
表2 肝脏 3 种 mRNA 的表达(n=6,±s)
肝脏3种蛋白的表达:动脉粥样硬化组、L-4F 组及辛伐他汀组肝脏均有 ABCA1、SR-BI、ABCG1蛋白表达,辛伐他汀组较动脉粥样硬化组ABCA1、ABCG1 蛋白表达增加(P<0.001),L-4F组较动脉粥样硬化组 ABCA1、SR-BI和 ABCG1蛋白表达增加(P<0.001),差异均有统计学意义。(图3)
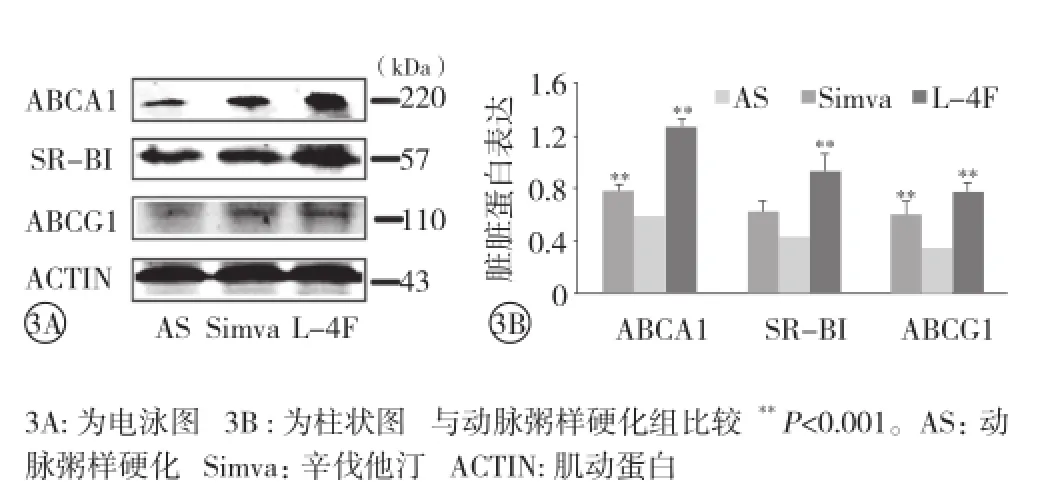
图3 免疫印迹标记法检测肝脏三磷酸腺苷结合盒转运蛋白 A1(ABCA1)、B族 I型清道夫受体 (SR-BI)、三磷酸腺苷结合盒转运蛋白 G1(ABCG1)蛋白表达
3 讨论
冠心病是由冠状动脉粥样硬化引起的心肌缺血性疾病,脂质代谢异常是动脉粥样硬化主要原因之一[10]。大量基础和临床研究发现,低密度脂蛋白胆固醇水平与冠心病的发生呈明显正相关,低密度脂蛋白胆固醇水平的异常增高是冠心病发病的重要病因[11]。因此,降低低密度脂蛋白胆固醇浓度成为治疗冠心病的重要靶点。他汀类药物 (statins)是目前临床使用最广泛有效的调脂药。他汀类药物不仅能显著降低低密度脂蛋白胆固醇和极低低密度脂蛋白胆固醇,还具有改善内皮功能、抗炎抗氧化、抗血小板集聚和稳定斑块等功能[12],具有抗动脉粥样硬化作用。
与低密度脂蛋白作用相反,高密度脂蛋白具有抗动脉粥样硬化作用。高密度脂蛋白主要功能包括促进胆固醇逆转运、抑制低密度脂蛋白氧化、改善内皮细胞功能失调、抗炎、抗血栓及促纤溶等[13]。胆固醇逆转运(RCT,reverse cholesterol transport)是周围组织(包括动脉粥样斑块)游离胆固醇通过血浆脂蛋白转运到肝脏进行再循环或是以胆酸的形式排泄的过程,包括细胞内胆固醇的流出、胆固醇酯化和从体内排泄[14]。其中,胆固醇流出是细胞内游离胆固醇经细胞膜的特定区域流出到细胞外的过程,是 RCT关键步骤。胆固醇流出率较高密度脂蛋白胆固醇更能代表高密度脂蛋白抗动脉粥样硬化功能[2],而在炎症、脂质紊乱以及代谢性疾病中,高密度脂蛋 白 抗动 脉 粥样 硬 化特 性 会受 到 影响[15]。 本研究发现,辛伐他汀不仅能降低低密度脂蛋白胆固醇水平,而且能改善动脉粥样硬化小鼠的高密度脂蛋白功能,促进胆固醇流出,可能为其抑制动脉粥样硬化的机制之一。
4F为目前生物活性最高的载脂蛋白 A1模拟肽,L-4F 为全部由左旋氨基酸合成,而 D-4F 为右旋氨基酸合成,目前认为二者除了受胃酶的影响(L-4F在胃肠道更易被蛋白酶水解,故不能口服,D-4F 则否 )不同之外[16],大部分作用和性质是相似的,包括抗动脉粥样硬化、抗炎抗氧化等。然而目前研究发现 D-4F 具有促进胆固醇流出作用,而 L-4F 对胆固醇流出的影响国内外都鲜有研究,本研究发现L-4F 能够促进胆固醇流出,不仅说明促进胆固醇流出为 L-4F 抗动脉粥样硬化的机制之一,也证实L-4F和 D-4F 均具有促进胆固醇流出的作用。同时本研究首次发现 L-4F 较辛伐他汀促进胆固醇流出的作用强,但二者抗动脉粥样硬化的作用无明显差异,说明 L-4F 和辛伐他汀发挥抗动脉粥样硬化的主要机制存在差异。因此,L-4F 和他汀联合使用可能发挥更有效的抗动脉粥样硬化作用,为临床抗动脉粥样硬化提供新思路新途径。
细胞内胆固醇流出受多个跨膜转运蛋白调节,主 要包 括 ABCA1、SR-BI、ABCG1[17]。肝 脏 是参 与胆固醇逆转运过程中的关键部位,肝细胞 ABCA1、SR-BI和 ABCG1 在 RCT 过 程 中 发 挥 重 要 作 用。ABCA1 主要介导细胞内游离胆固醇(FC)、磷脂及其他亲脂分子通过胞膜转运给贫脂载脂蛋白 A-1[18]。SR-BI介导 FC 的双向转运,既介导胞内胆固醇流出,也介导肝细胞及相关组织细胞对 HDL胆固醇的摄取[19]。ABCG1 主要介导 FC 转运给 成熟 HDL[20]。 本研究发现 L-4F 能明显地增加肝脏 ABCA1、SR-BI 和ABCG1 的 mRNA 及蛋白表达,可能为其促进胆固醇流出的主要机制。而辛伐他汀能增加肝脏 ABCA1和 ABCG1 的 mRNA 及蛋白表达,从而促进胆固醇流出。
综上所述,L-4F 可通过增加肝脏 ABCA1、SRBI 和 ABCG1 表达,促进胆固醇流出,有效减少了主动脉粥样斑块面积。因此,L-4F 可能为治疗动脉粥样硬化提供新途径。
[1]Anantharamaiah G, Navab M, Reddy ST, et al. Synthetic peptides: managing lipid disorders. Curr Opin Lipidol, 2006, 17: 233-237.
[2]Di Angelantonio E, Sarwar N, Perry P, et al. Major lipids, apolipoproteins, and risk of vascular disease. JAMA, 2009, 302: 1993-2000.
[3]谭迎 , 田迪 , 刘挺榕 , 等 . 高密度脂蛋白亚组分促胆固醇逆转运及抗氧化功能研究 . 中国循环杂志 , 2013, 28: 25-28.
[4]Navab M, Anantharamaiah GM, Reddy ST, et al. Oral D-4F causes formation of pre-beta high-density lipoprotein and improves highdensity lipoprotein-mediated cholesterol efflux and reverse cholesterol transport from macrophages in apolipoprotein E-null mice. Circulation, 2004, 109: 3215-3220.
[5]Navab M, Anantharamaiah GM, Hama S, et al. D-4F and statins synergize to render HDL antiinflammatory in mice and monkeys and cause lesion regression in old apolipoprotein E-null mice. Arterioscler Thromb Vasc Biol, 2005, 25: 1426-1432.
[6]Ou J, Ou Z, Jones DW, et al. L-4F, an apolipoprotein A-1 mimetic, dramatically improves vasodilation in hypercholesterolemia and sickle cell disease. Circulation, 2003, 107: 2337-2341.
[7]Peterson SJ, Kim DH, Li M, et al. The L-4F mimetic peptide prevents insulin resistance through increased levels of HO-1, pAMPK, and pAKT in obese mice. J Lipid Res, 2009, 50: 1293-1304.
[8]Imaizumi S, Grijalva V, Navab M, et al. L-4F differentially alters plasma levels of oxidized fatty acids resulting in more antiinflammatory HDL in mice. Drug Metab Lett, 2010, 4: 139-148.
[9]Ou J, Ou Z, Jones DW, et al. L-4F, an apolipoprotein A-1 mimetic, dramatically improves vasodilation in hypercholesterolemia and sickle cell disease. Circulation, 2003, 107: 2337-2341.
[10]Arsenault BJ, Boekholdt SM, Kastelein JJ. Lipid parameters for measuring risk of cardiovascular disease. Nat Rev Cardiol, 2011, 8: 197-206.
[11]Boden WE. High-density lipoprotein cholesterol as an independent risk factor in cardiovascular disease: assessing the data from Framingham to the Veterans Affairs High--Density Lipoprotein Intervention Trial. Am J Cardiol, 2000, 86: 19L-22L.
[12]金鑫 , 李拥军 . 他汀类药物在心血管疾病中应用的研究进展 . 临床荟萃 , 2010, 1: 86-89.
[13]Navab M, Reddy S T, Van Lenten BJ, et al. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat Rev Cardiol, 2011, 8: 222-232.
[14]Alexander ET, Weibel GL, Joshi MR, et al. Macrophage reverse cholesterol transport in mice exprexxing ApoA-l Milano. Arterioscler Thromb Vasc Biol, 2009, 29: 1496-1510.
[15] 严晓伟 , 包婺平 . 疾病状态下高密度脂蛋白的功能缺陷 . 中国循环杂志 , 2007, 22: 152-154.
[16]Navab M, Ruchala P, Waring AJ, et al. A novel method for oral delivery of apolipoprotein mimetic peptides synthesized from all Lamino acids. J Lipid Res, 2009, 50: 1538-1547.
[17]Wang X, Collins HL, Ranalletta M, et al. Macrophage ABCA1 and ABCG1, but not SR-BI, promote macrophage reverse cholesterol transport in vivo. J Clin lnvest, 2007, 117: 2216-2224.
[18]Wang N, Silver D L, Thiele C, et al. ATP-binding cassette transporter A1 (ABCA1) functions as a cholesterol efflux regulatory protein. J Biol Chem, 2001, 276: 23742-23747.
[19]Reaven E, Cortez Y, Leers-Sucheta S, et al. Dimerization of the scavenger receptor class B type I: formation, function, and localization in diverse cells and tissues. J Lipid Res, 2004, 45: 513-528.
[20]Yvan-Charvet L, Wang N, Tall AR. Role of HDL, ABCA1, and ABCG1 transporters in cholesterol efflux and immune responses. Arterioscler Thromb Vasc Biol, 2010, 30: 139-143.
Protective Effect and Mechanism of Apolipoprotein A-1 Mimetic Peptide L-4F on Atherosclerosis in Mice Model
YING Ru, YUAN Yong, QIN Ya-fei, FENG Li, TIAN Di, GUO Zhi-gang, LI Ming-xing.
Department of Cardiology, Zhongshan Hospital, Sun Yat-sen University, Zhongshan (528403), Guangdong, China
YUAN Yong, Email:yuanyong1123@yahoo.com.cn
Objective: To observe the effects of apolipoprotein A-1 (Apo-A1) mimetic peptide L-4F (L-4F) and simvastatin on cholesterol efflux and atherosclerosis in Apo E-/-mice model.Methods: 8 weeks male Apo E-/-mice were randomly divided into 3 groups, Atherosclerosis (AS) group, the mice were treated with high fat diet, Simvastatin group, high fat diet+simvastatin, and L-4F group, high fat diet+ L-4F. n=6 in each group. All animals were treated for 16 weeks, and then, serum lipid level was recorded, Apo-A1 concentration was examined by ELISA, aortic AS plaque was observed by red O oil staining, cholesterol efflux was evaluated by liquid scintillationspectrometry. The mRNA and protein expression of liver ABCA1, SR-BI and ABCG1were detected by RT-PCR and Western blot respectively.Results: ① Compared with AS group, Simvastatin group presented decreased levels of TC, TG, LDL-C and increased HDL-C, P<0.05~0.01, while L-4F group showed obviously increased Apo-A1 concentration, P<0.05. ② Compared with Simvastatin group and AS group, L-4F group had increased cholesterol efflux, P<0.001, compared with AS group, Simvastatin group also had increased cholesterol efflux, P<0.001. ③ Compared with AS group, the other 2 groups had smaller AS plaque area, P<0.001. ④ Compared with AS group, Simvastatin group presented increased protein expression of ABCA1 and ABCG1, P<0.001 and L-4F group showed increased protein expression of ABCA1, SR-BI and ABCG1, P<0.001.Conclusion: L-4F may promote cholesterol efflux by up-regulating ABCA1, SR-BI and ABCG1 expression in the liver, and therefore, attenuate the atherosclerosis in Apo E-/-mice model.
Atherosclerosis; Cholesterol efflux; Apolipoprotein A-1 mimetic peptide; High density lipoprotein
2013-04-17)
(编辑:梅平)
广东省中山市科技计划重大专项(20102A016)
528403 广东省中山市,中山大学附属中山医院 心内科(应如、袁勇、秦亚飞、冯力、李明星 );南方医科大学附属南方医院心内科(田迪、郭志刚)
应如 硕士研究生 主要从事血脂研究 Email:yingru2005@163.com 通讯作者:袁勇 Email:yuanyong1123@yahoo.com.cn
R541
A
1000-3614(2013)05-0379-05
10.3969/j.issn.1000-3614.2013.05.017
方法:研究对象为 8 周龄雄性 Apo E-/-小鼠,分为 3 组:①动脉粥样硬化组:以单纯高脂饮食;②辛伐他汀组:高脂饮食基础上予辛伐他汀治疗;③ L-4F 组:高脂饮食基础上予 L-4F 治疗。在实验第 16 周末取标本。用自动生化仪测定小鼠血脂水平,利用酶联免疫吸附法(ELISA)检测血清 ApoA-1 浓度;油红 O 染色分析主动脉粥样斑块面积;同时用液闪计数仪检测胆固醇流出率;并采用反转录聚合酶链反应(RT-PCR)和免疫印迹标记法(Western blot)分析肝脏三磷酸腺苷结合盒转运蛋白 A1(ABCA1 )、B 族 I型清道夫受 体( SR-BI)和三磷酸腺苷结合 盒 转 运 蛋 白 G1(ABCG1)mRNA 和蛋白表达水平。
结果:16 周末血脂变化:与动脉粥样硬化组比较,辛伐他汀组血清胆固醇、甘油三酯、低密度脂蛋白胆固醇水平明显降低,高密度脂蛋白胆固醇(HDL-C)水平明显升高(P<0.05~0.01);而 L-4F 组较动脉粥样硬化组的 ApoA-1水平明显升高(P<0.05),差异均有统计学意义。胆固醇流出率:L-4F 组与辛伐他汀组、动脉粥样硬化组比较胆固醇流出率均增高(P<0.001),而辛伐他汀组与动脉粥样硬化组相比胆固醇流出率也增高(P<0.001),差异均有统计学意义。主动脉粥样斑块面积:与动脉粥样硬化组相比,辛伐他汀组、L-4F 组斑块面积均明显减少,差异均有统计学意义(P<0.001)。肝脏 3 种蛋白的表达:辛伐他汀组较动脉粥样硬化组 ABCA1、ABCG1 蛋白表达增加(P<0.001),L-4F组较动脉粥样硬化组 ABCA1、SR-BI 和 ABCG1 蛋白表达增加(P<0.001),差异均有统计学意义。
结论: L-4F 可能通过上调肝脏 ABCA1、SR-BI和 ABCG1 的 mRNA 和蛋白表达,促进巨噬细胞胆固醇流出,有效发挥抗动脉粥样硬化作用。
